- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Введение в химию гетероциклических соединений презентация
Содержание
- 1. Введение в химию гетероциклических соединений
- 2. Гетероциклические соединения – органические вещества, молекулы которых
- 3. Применение и роль гетероциклических соединений Многочисленные гетероциклические
- 4. анальгин
- 5. В зависимости от числа атомов, образующих гетероциклы,
- 6. Номенклатура гетероциклических соединений
- 7. Для большинства гетероциклических соединений применяются тривиальные названия.
- 8. Молекулы простейших гетероциклов содержат трехчленные циклы: Наиболее
- 9. Гетероциклы с двумя гетероатомами: Бициклические гетероциклы: оксазол тиазол имидазол пиразол пиримидин пурин индол
- 10. 1. ТРИВИАЛЬНАЯ НОМЕНКЛАТУРА «ПИКОЛИН» Например, метилпиридины имеют
- 11. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
- 12. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
- 13. ПРИМЕРЫ ГЕТРОЦИКЛОВ С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ ФЕНАНТРИДИН АКРИДИН ПЕРИМИДИН ФЕНАЗИН ФЕНОТИАЗИН ФЕНОКСАЗИН
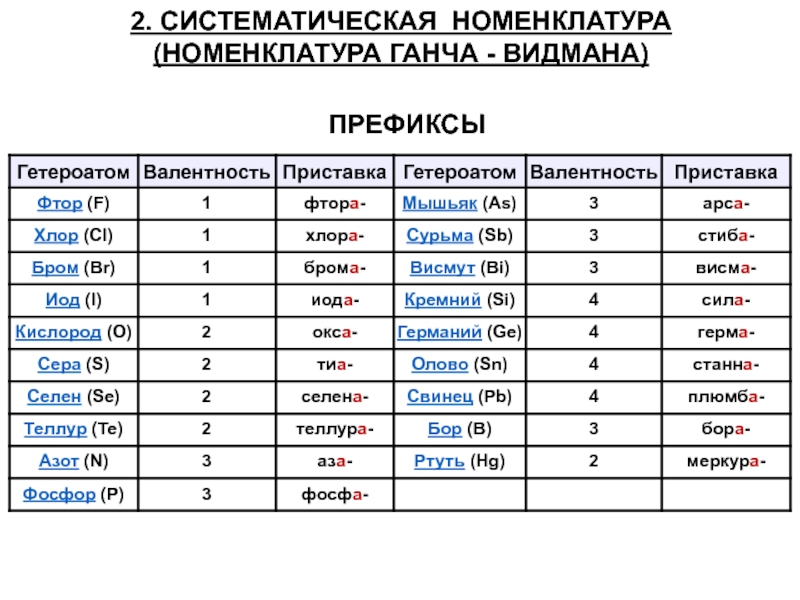
- 14. 2. СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (НОМЕНКЛАТУРА ГАНЧА - ВИДМАНА) ПРЕФИКСЫ
- 15. КОРНИ ДЛЯ СИСТЕМАТИЧЕСКОЙ НОМЕНКЛАТУРЫ оксиран оксетан оксолан 3Н-индол 1 2 3 2Н-азол 1 2
- 16. 3. ЗАМЕНИТЕЛЬНАЯ НОМЕНКЛАТУРА Заменительная номенклатура рассматривает гетероциклическое
- 18. Название цикла, который выбран основным, становится корнем
- 19. названия пери-конденсированных гетероциклических систем После составления названия
- 20. Практическое занятие
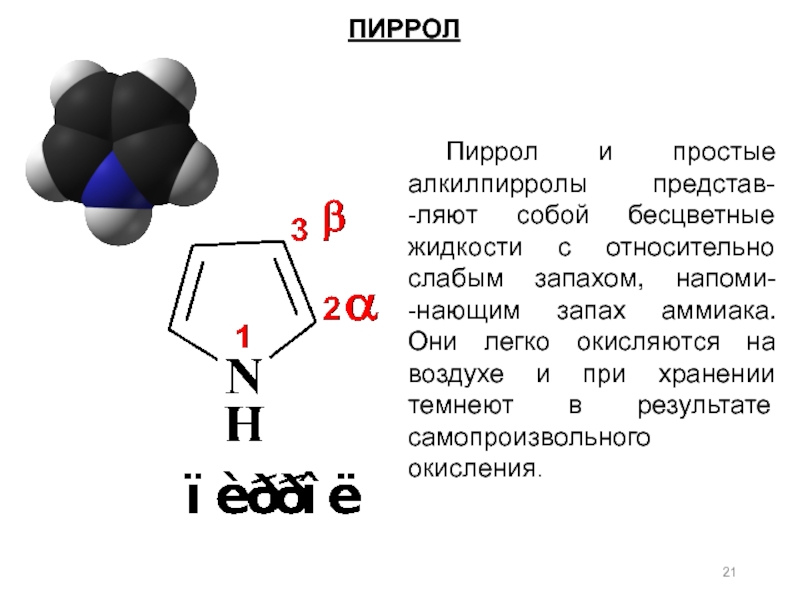
- 21. ПИРРОЛ Пиррол и простые алкилпирролы представ- -ляют
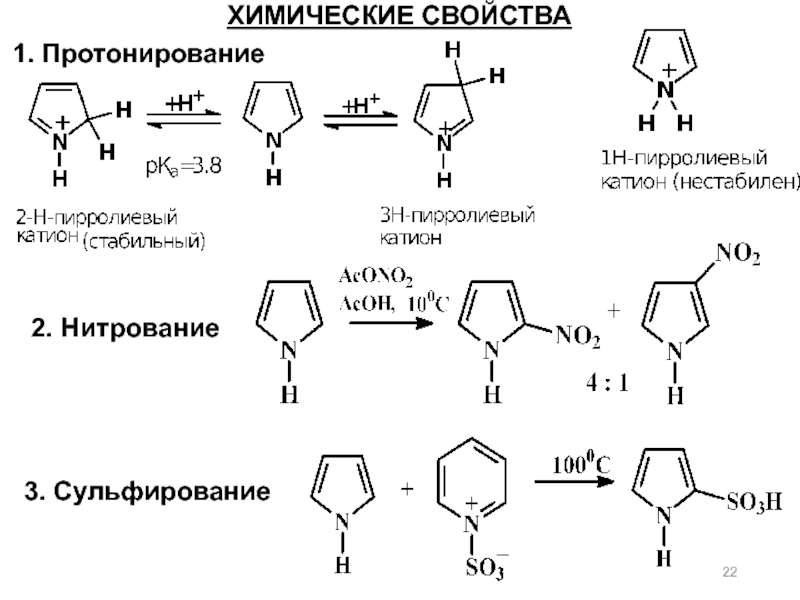
- 22. ХИМИЧЕСКИЕ СВОЙСТВА 1. Протонирование 2. Нитрование 3. Сульфирование
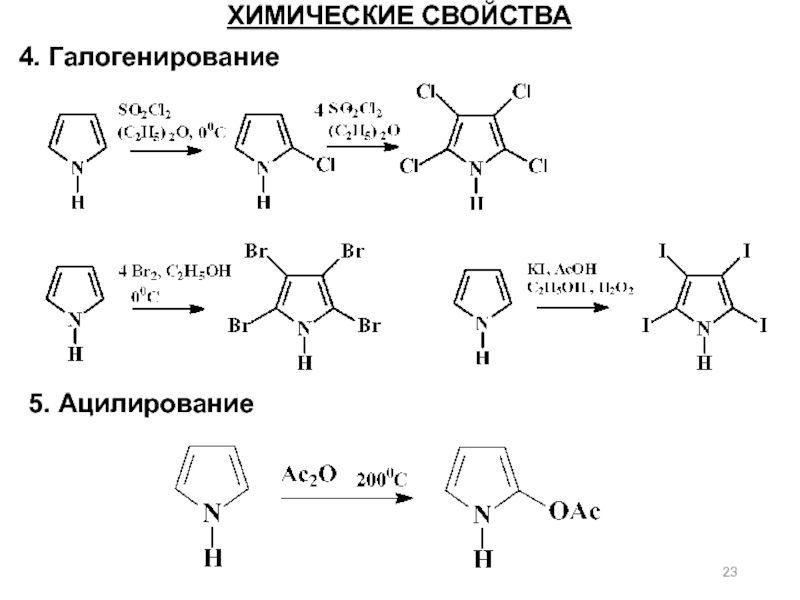
- 23. ХИМИЧЕСКИЕ СВОЙСТВА 4. Галогенирование 5. Ацилирование
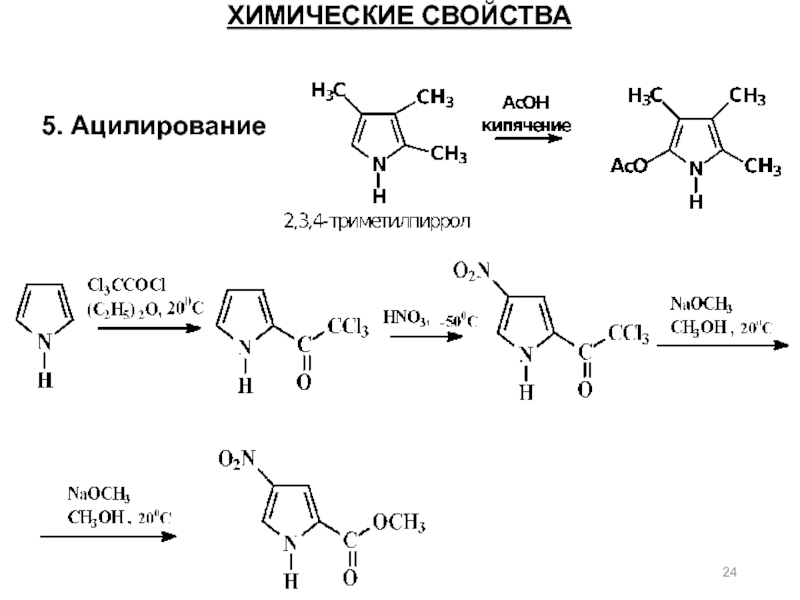
- 24. 5. Ацилирование ХИМИЧЕСКИЕ СВОЙСТВА
- 25. 6. Конденсация с иминиевыми ионами(аминометилирование) ХИМИЧЕСКИЕ СВОЙСТВА α-(N,N-диэтиламинометил)-пиррол 7. Полимиризация
- 26. ХИМИЧЕСКИЕ СВОЙСТВА 8. Сочетание с солями диазония Реакция с реактивом Гриньяра
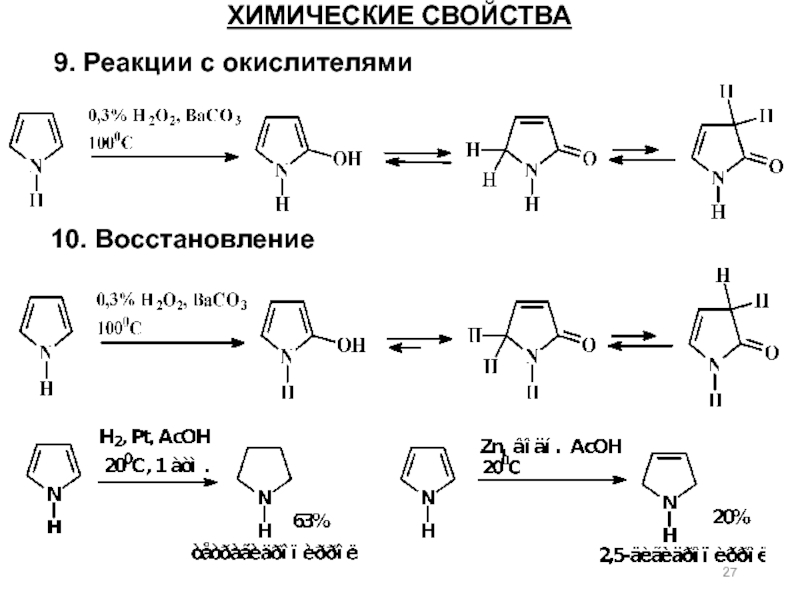
- 27. ХИМИЧЕСКИЕ СВОЙСТВА 9. Реакции с окислителями 10. Восстановление
- 28. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 1. Из 1,4-дикарбонильного соединения, аммиака или первичных аминов (синтез Пааля-Кнорра)
- 29. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 2. Из α-аминокарбонильных соединений
- 30. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ 3. Из α-галогенокарбонильных соединений
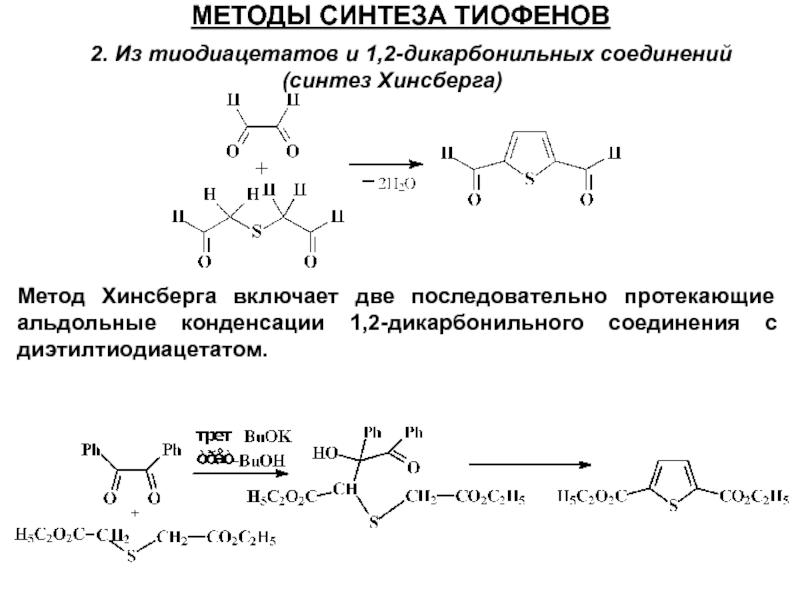
- 31. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 2. Из тиодиацетатов и 1,2-дикарбонильных соединений (синтез Хинсберга)
- 32. ТИОФЕН Тиофен и его простейшие алкилпроизводные
- 33. ХИМИЧЕСКИЕ СВОЙСТВА 1. Присоединение по атому серы
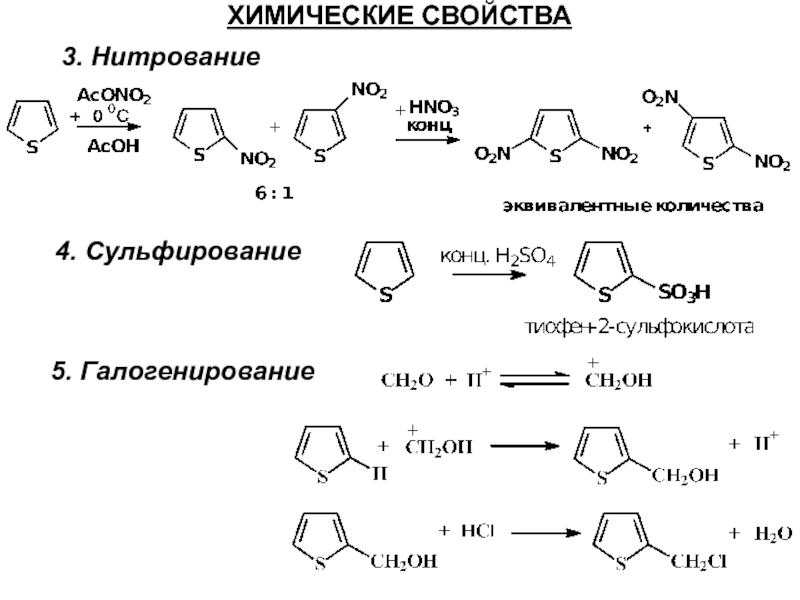
- 34. ХИМИЧЕСКИЕ СВОЙСТВА 3. Нитрование 4. Сульфирование 5. Галогенирование
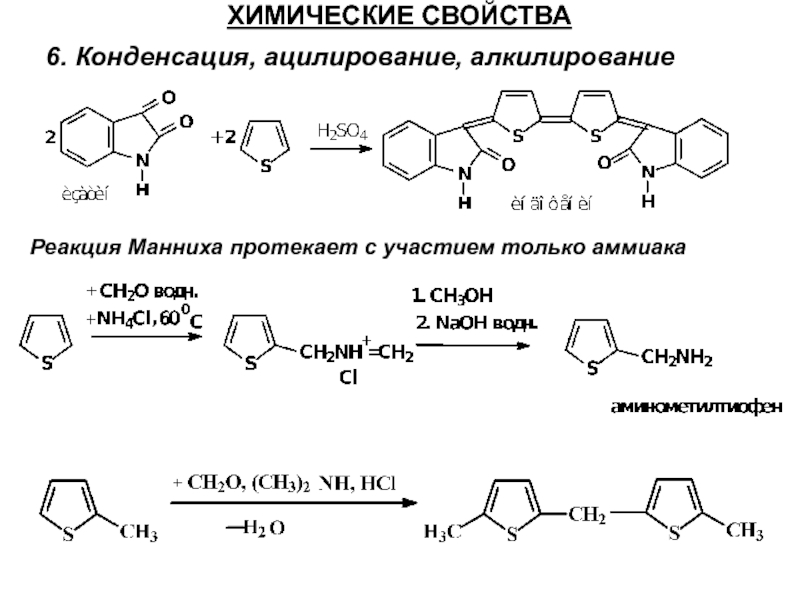
- 35. ХИМИЧЕСКИЕ СВОЙСТВА 6. Конденсация, ацилирование, алкилирование
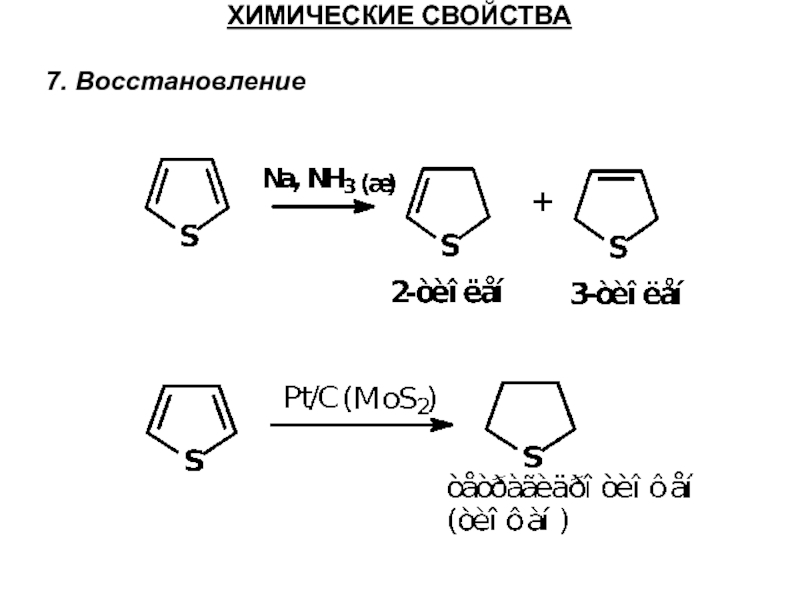
- 36. ХИМИЧЕСКИЕ СВОЙСТВА 7. Восстановление
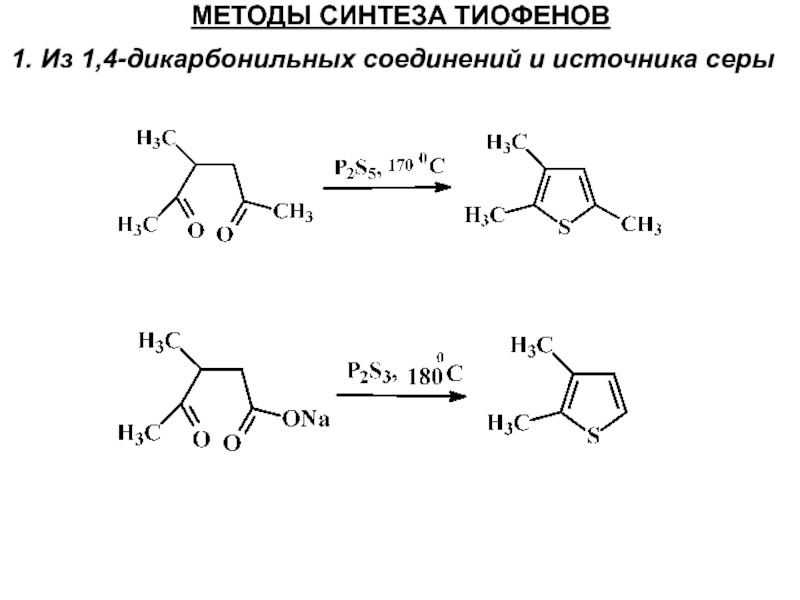
- 37. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 1. Из 1,4-дикарбонильных соединений и источника серы
- 38. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 2. Из тиодиацетатов и
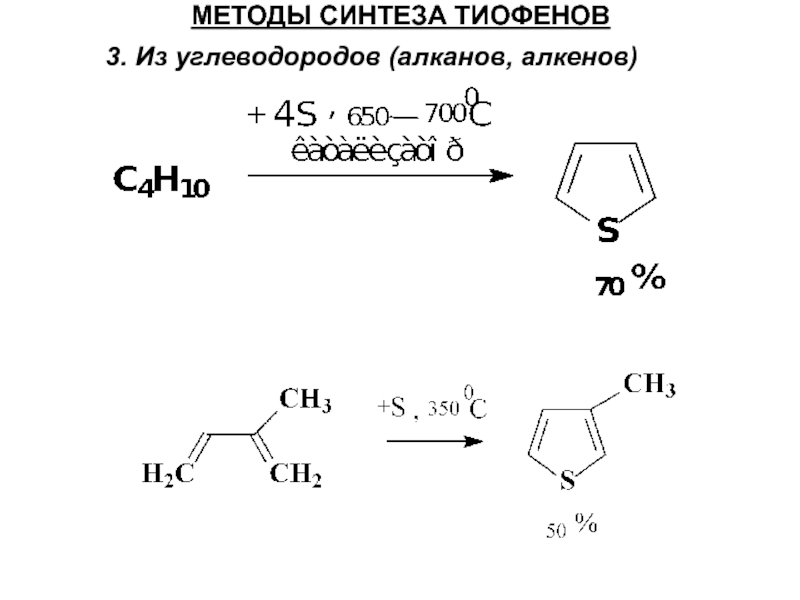
- 39. МЕТОДЫ СИНТЕЗА ТИОФЕНОВ 3. Из углеводородов (алканов, алкенов)
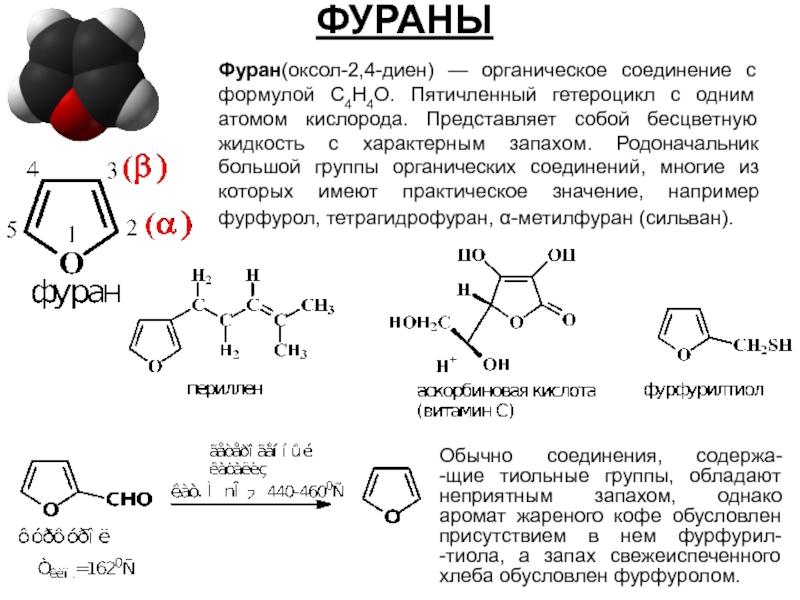
- 40. ФУРАНЫ Фуран(оксол-2,4-диен) — органическое соединение с формулой
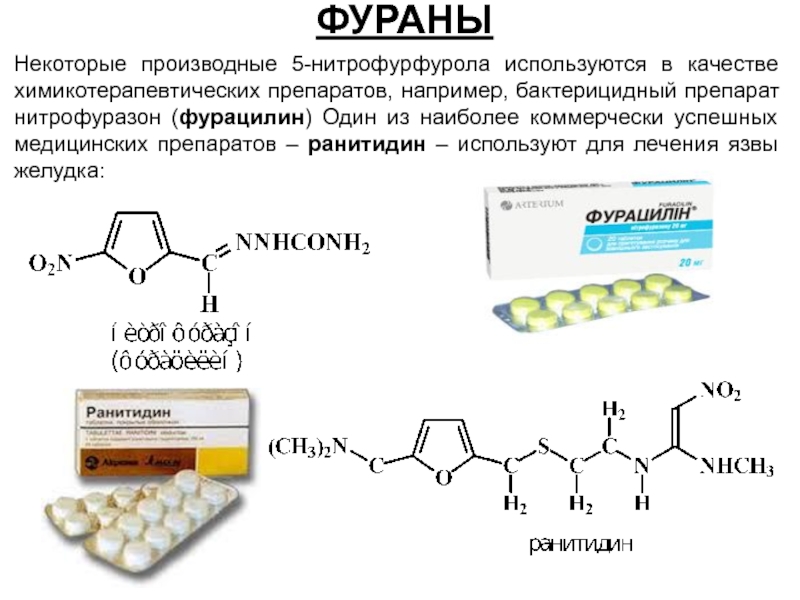
- 41. ФУРАНЫ Некоторые производные 5-нитрофурфурола используются в качестве
- 42. ХИМИЧЕСКИЕ СВОЙСТВА 1. Протонирование 2. Нитрование
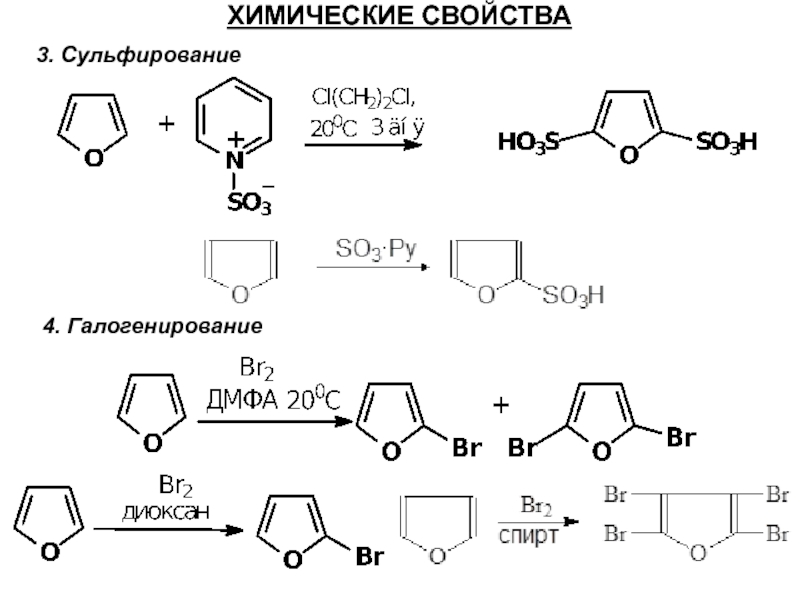
- 43. ХИМИЧЕСКИЕ СВОЙСТВА 3. Сульфирование 4. Галогенирование
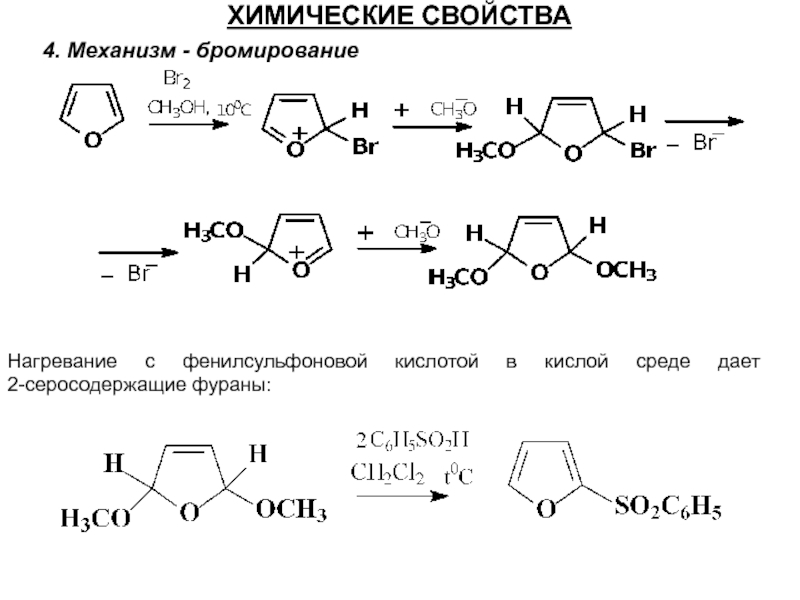
- 44. ХИМИЧЕСКИЕ СВОЙСТВА 4. Механизм - бромирование
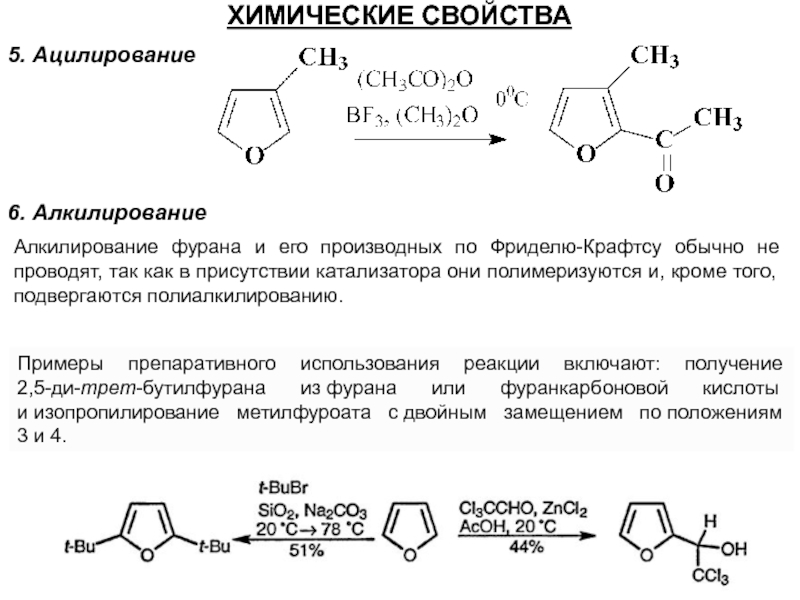
- 45. 5. Ацилирование ХИМИЧЕСКИЕ СВОЙСТВА 6.
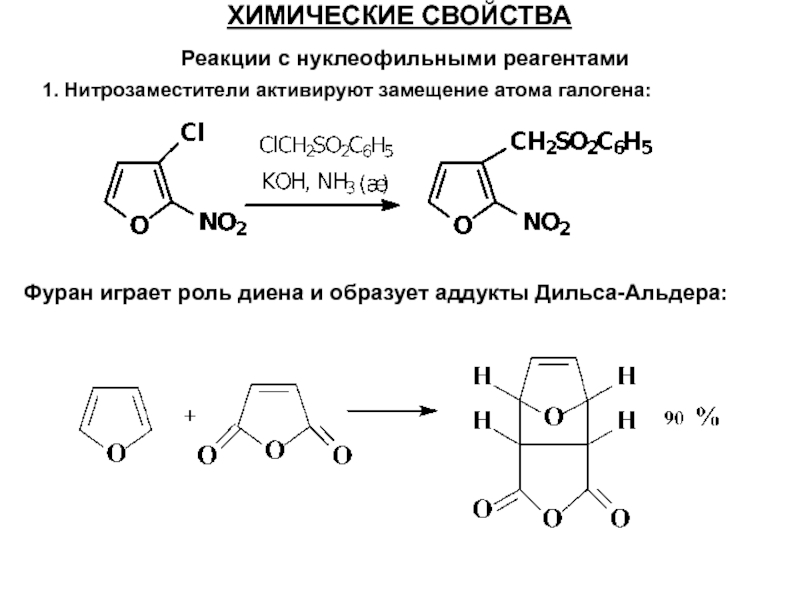
- 46. Реакции с нуклеофильными реагентами ХИМИЧЕСКИЕ СВОЙСТВА
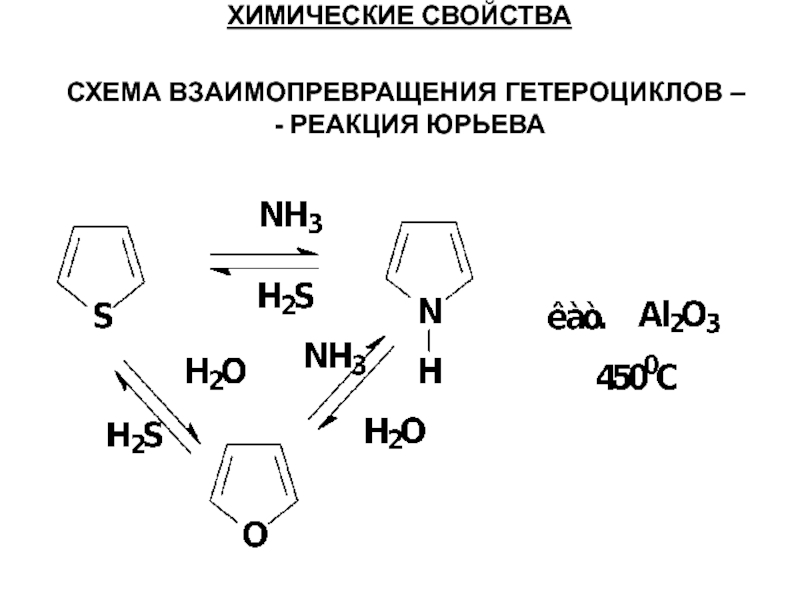
- 47. ХИМИЧЕСКИЕ СВОЙСТВА СХЕМА ВЗАИМОПРЕВРАЩЕНИЯ ГЕТЕРОЦИКЛОВ – - РЕАКЦИЯ ЮРЬЕВА
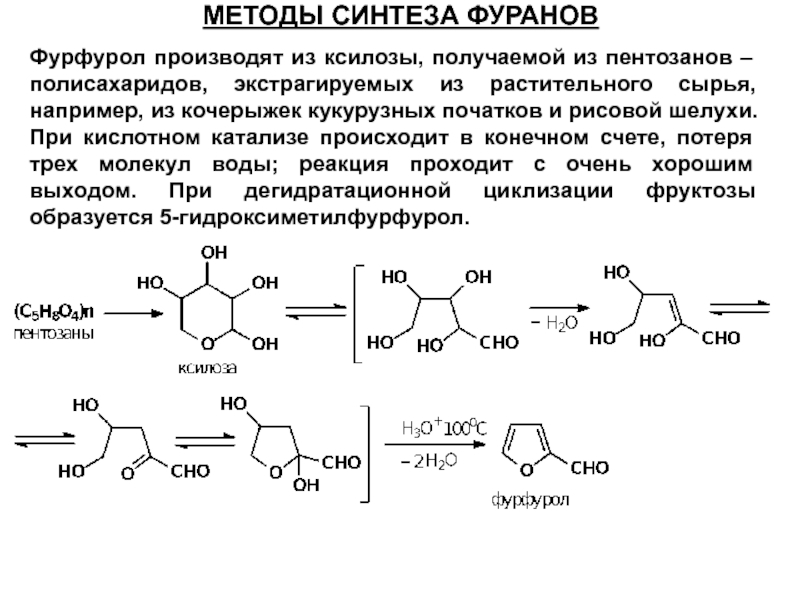
- 48. МЕТОДЫ СИНТЕЗА ФУРАНОВ Фурфурол производят из
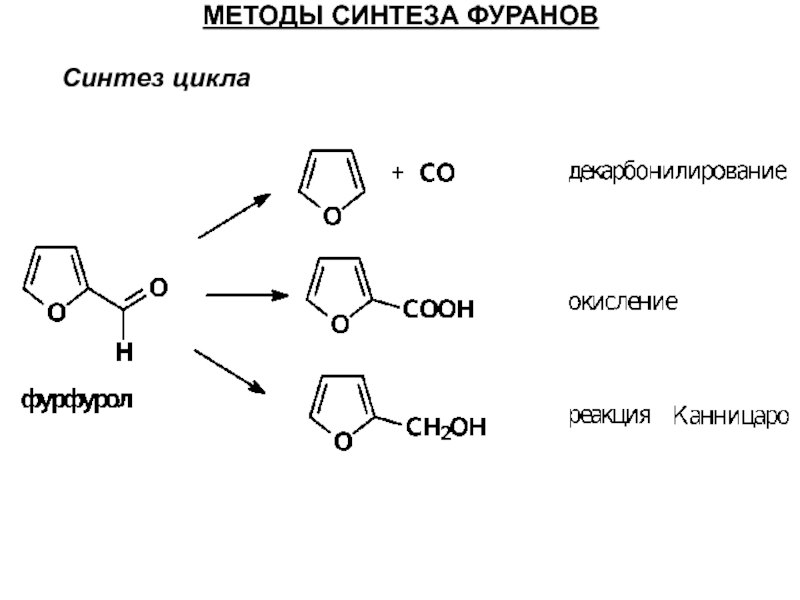
- 49. Синтез цикла МЕТОДЫ СИНТЕЗА ФУРАНОВ
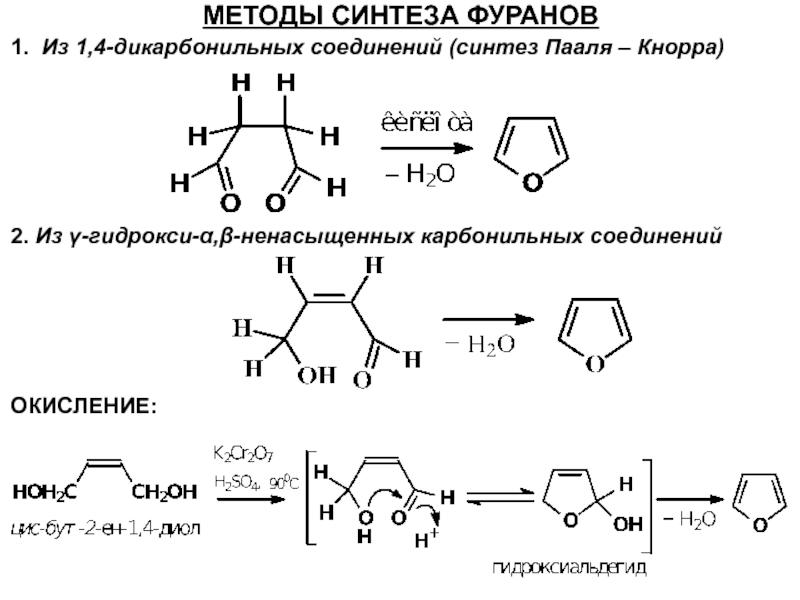
- 50. МЕТОДЫ СИНТЕЗА ФУРАНОВ 1. Из 1,4-дикарбонильных соединений
- 51. МЕТОДЫ СИНТЕЗА ФУРАНОВ 3. Из α-галогенокарбонильных и
- 52. ХИНОЛИНЫ И ИЗОХИНОЛИНЫ
- 53. ХИНОЛИНЫ И ИЗОХИНОЛИНЫ Хинолиновый фрагмент содержится в
- 54. Производные хинолина были использованы в качестве первых
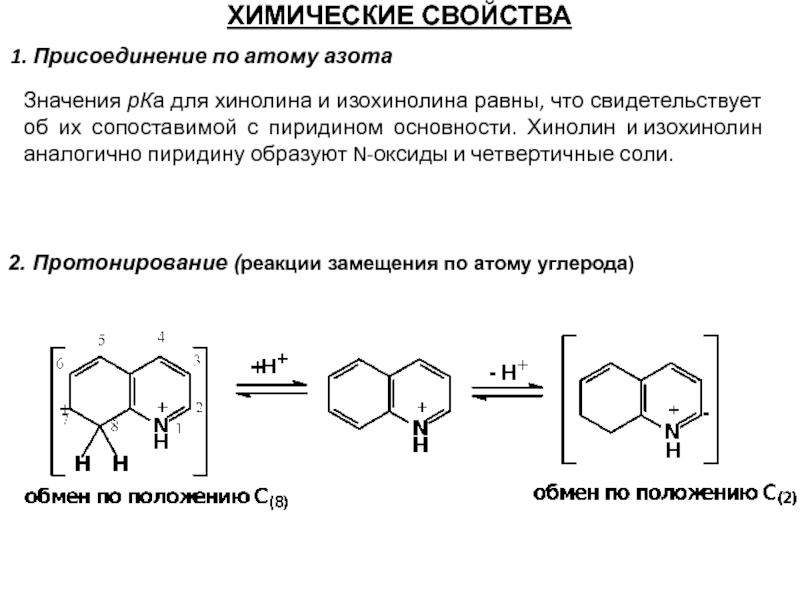
- 55. ХИМИЧЕСКИЕ СВОЙСТВА 1. Присоединение по атому азота
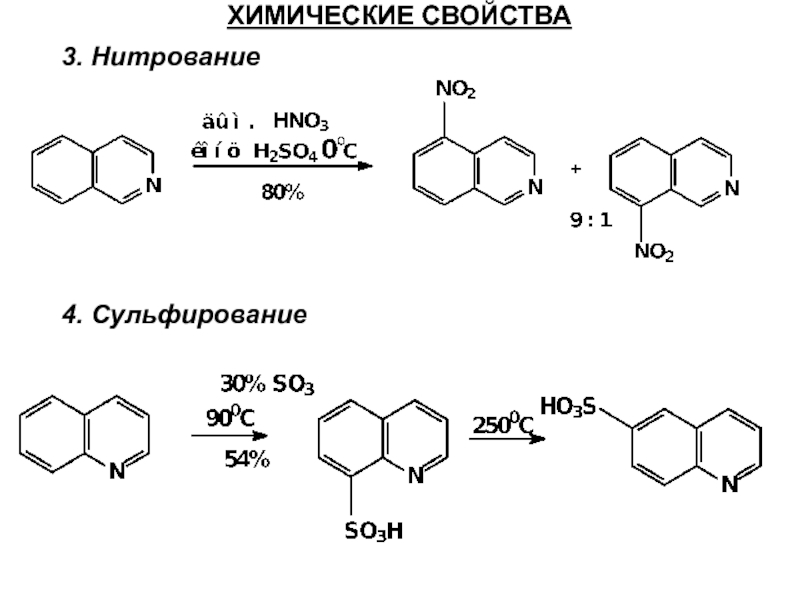
- 56. ХИМИЧЕСКИЕ СВОЙСТВА 3. Нитрование 4. Сульфирование
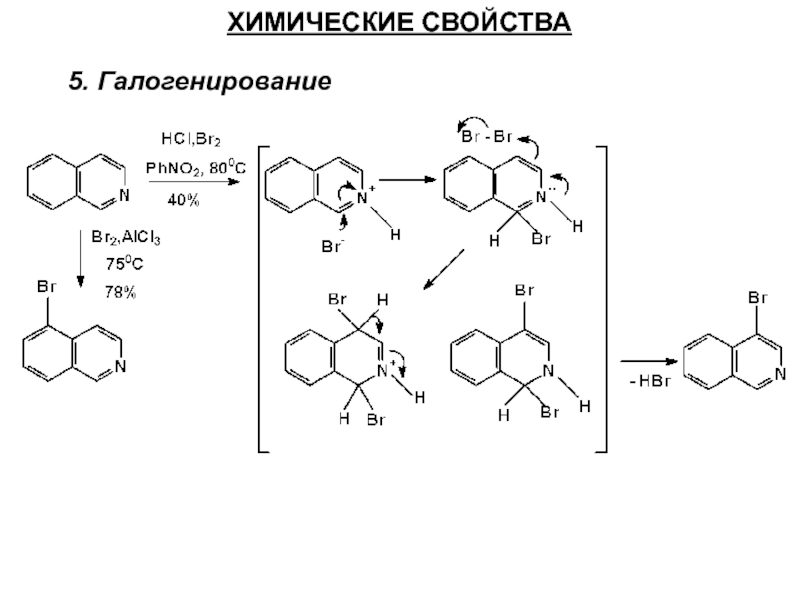
- 57. ХИМИЧЕСКИЕ СВОЙСТВА 5. Галогенирование
- 58. ХИМИЧЕСКИЕ СВОЙСТВА 6. Арилирование и алкилирование 7. Аминирование и нитрование
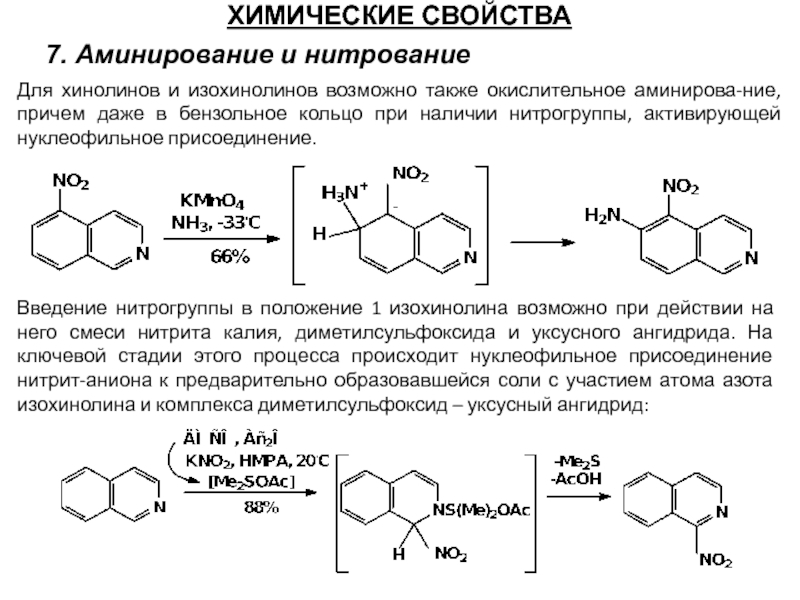
- 59. ХИМИЧЕСКИЕ СВОЙСТВА 7. Аминирование и
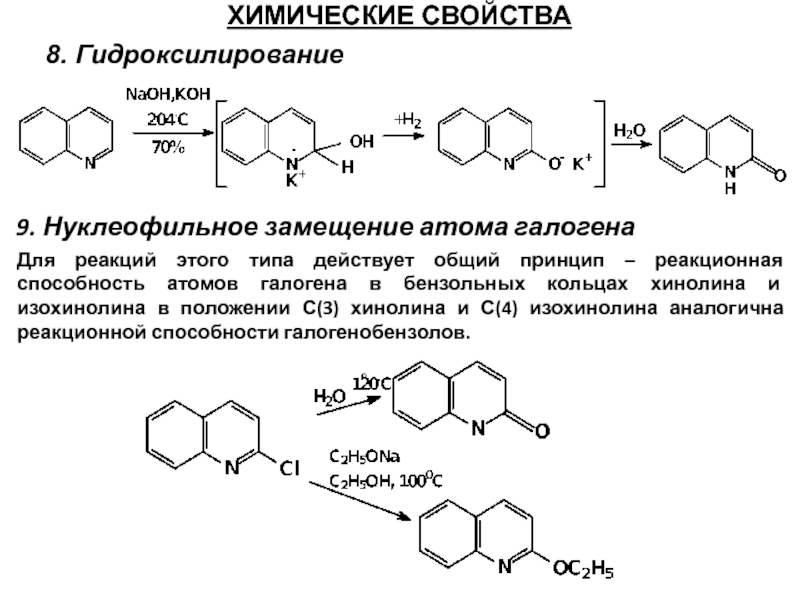
- 60. ХИМИЧЕСКИЕ СВОЙСТВА 8. Гидроксилирование 9. Нуклеофильное
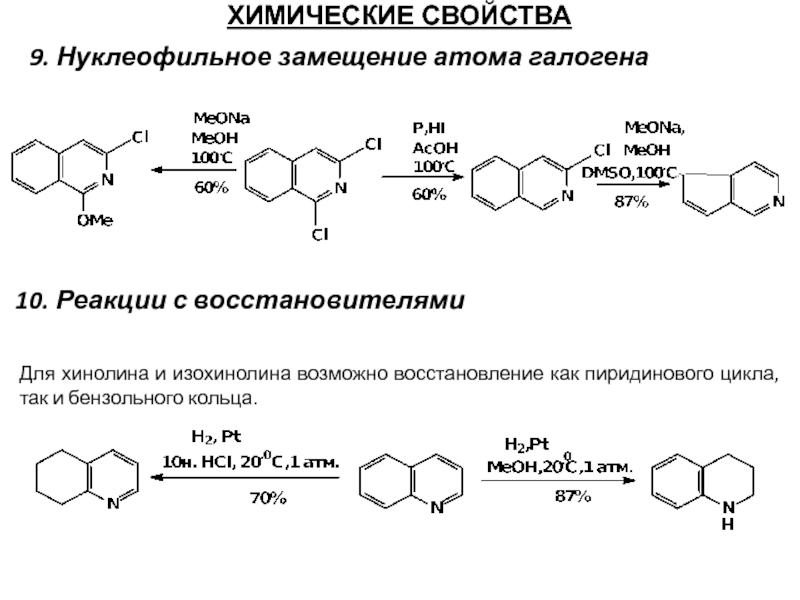
- 61. ХИМИЧЕСКИЕ СВОЙСТВА 9. Нуклеофильное замещение атома
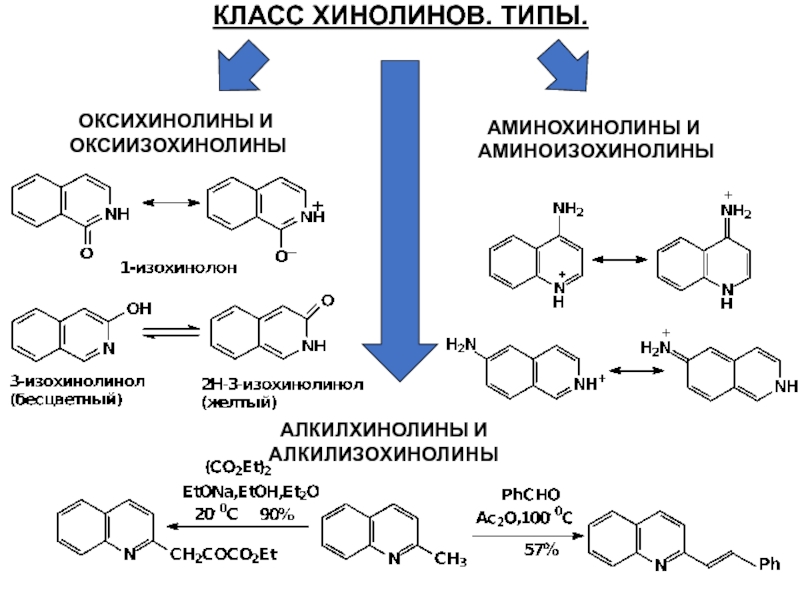
- 62. КЛАСС ХИНОЛИНОВ. ТИПЫ. ОКСИХИНОЛИНЫ И ОКСИИЗОХИНОЛИНЫ
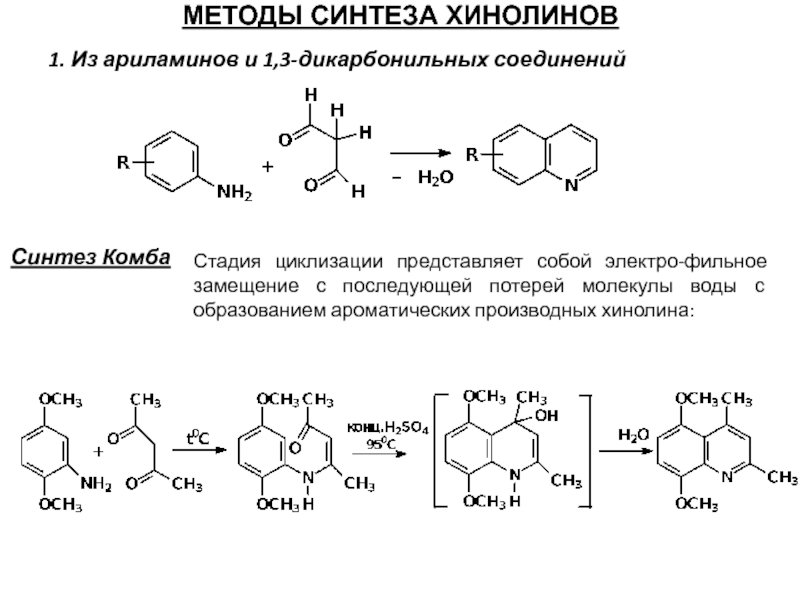
- 63. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 1. Из ариламинов и
- 64. Синтез Конрада-Лимпаха-Кнорра МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ
- 65. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 2. Из ариламинов и
- 66. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ 3. Из орто-ацилариламинов и
- 67. МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ 1. Из арилальдегидов и
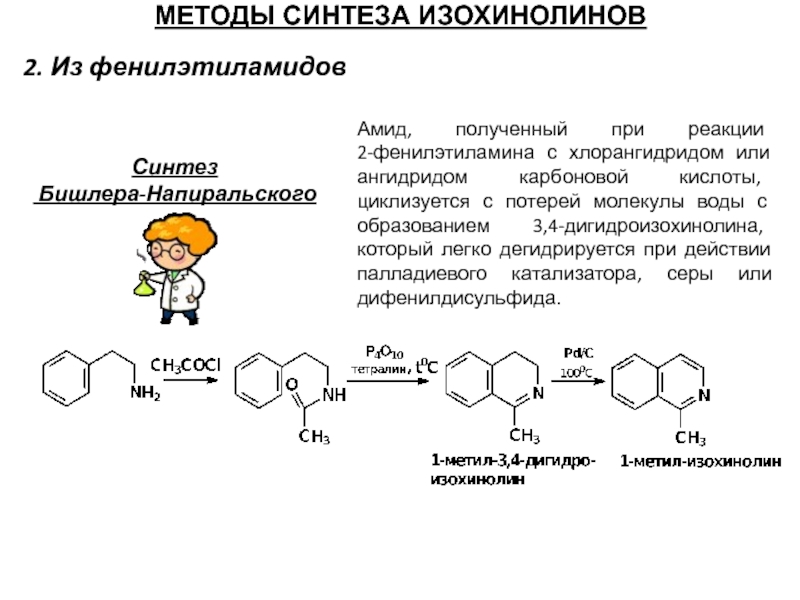
- 68. 2. Из фенилэтиламидов МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ Синтез
Слайд 1Введение в химию
гетероциклических соединений
ФГБОУ ВО «Ивановский государственный
химико-технологический университет»
Кафедра Технологии
органического синтеза
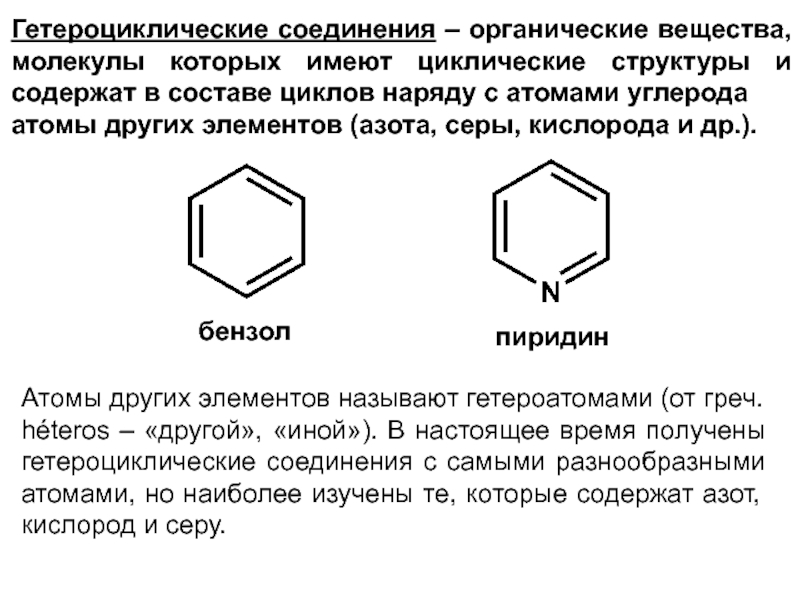
Слайд 2Гетероциклические соединения – органические вещества, молекулы которых имеют циклические структуры и
атомы других элементов (азота, серы, кислорода и др.).
бензол
пиридин
Атомы других элементов называют гетероатомами (от греч. héteros – «другой», «иной»). В настоящее время получены гетероциклические соединения с самыми разнообразными атомами, но наиболее изучены те, которые содержат азот, кислород и серу.
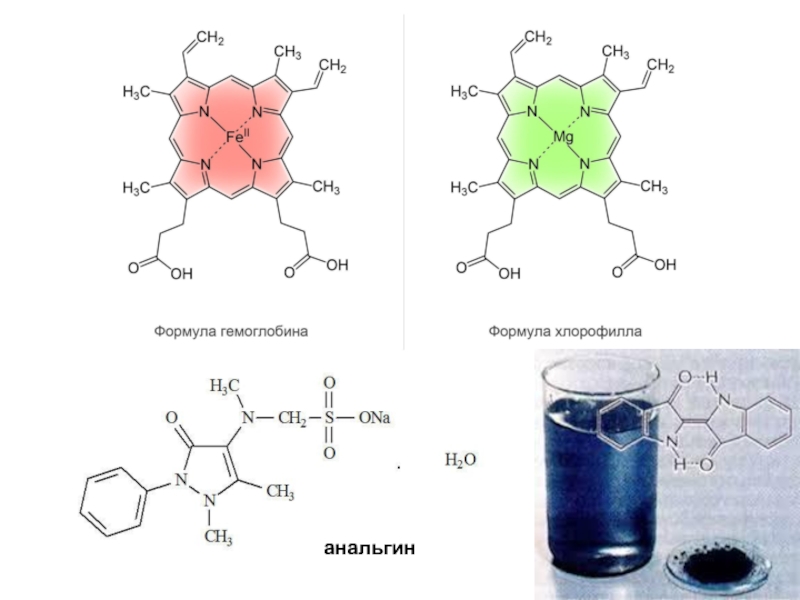
Слайд 3Применение и роль гетероциклических соединений
Многочисленные гетероциклические соединения играют важную роль в
Слайд 5В зависимости от числа атомов, образующих гетероциклы, различают трех-, четырех-, пяти-,
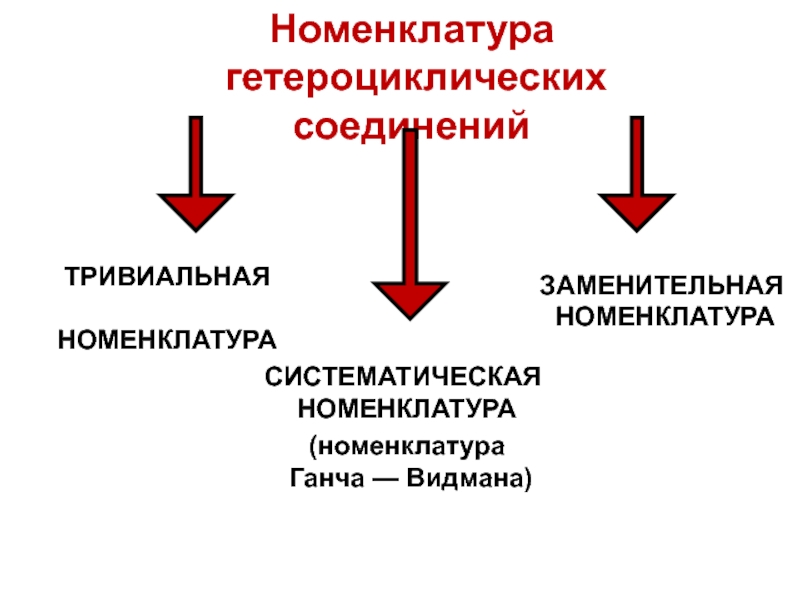
Слайд 6
Номенклатура
гетероциклических соединений
ТРИВИАЛЬНАЯ
НОМЕНКЛАТУРА
СИСТЕМАТИЧЕСКАЯ
НОМЕНКЛАТУРА
ЗАМЕНИТЕЛЬНАЯ
НОМЕНКЛАТУРА
(номенклатура
Ганча — Видмана)
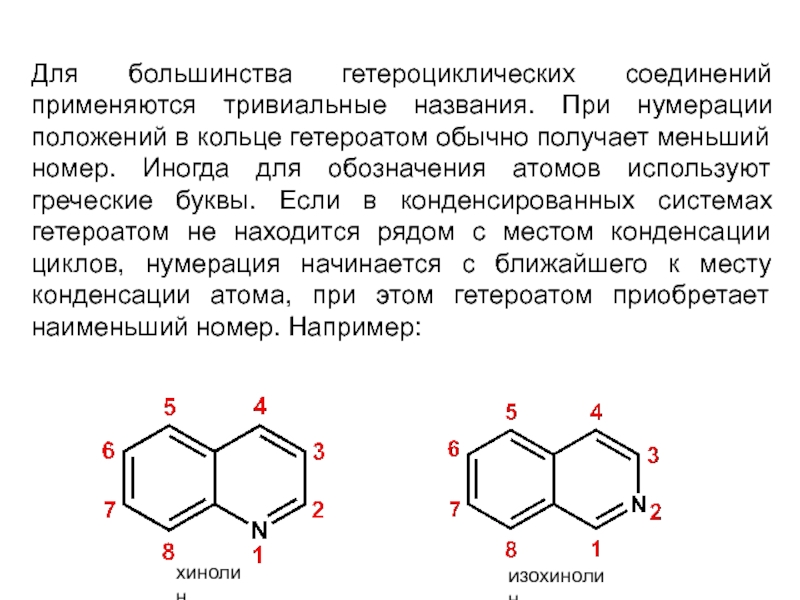
Слайд 7Для большинства гетероциклических соединений применяются тривиальные названия. При нумерации положений в
хинолин
изохинолин
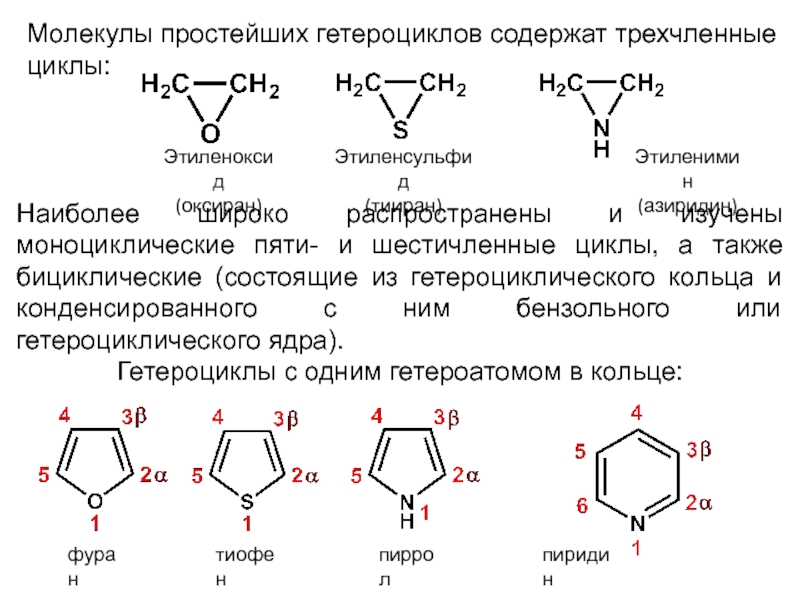
Слайд 8Молекулы простейших гетероциклов содержат трехчленные циклы:
Наиболее широко распространены и изучены моноциклические
Гетероциклы с одним гетероатомом в кольце:
Этиленоксид
(оксиран)
Этиленсульфид
(тииран)
Этиленимин
(азиридин)
фуран
тиофен
пиррол
пиридин
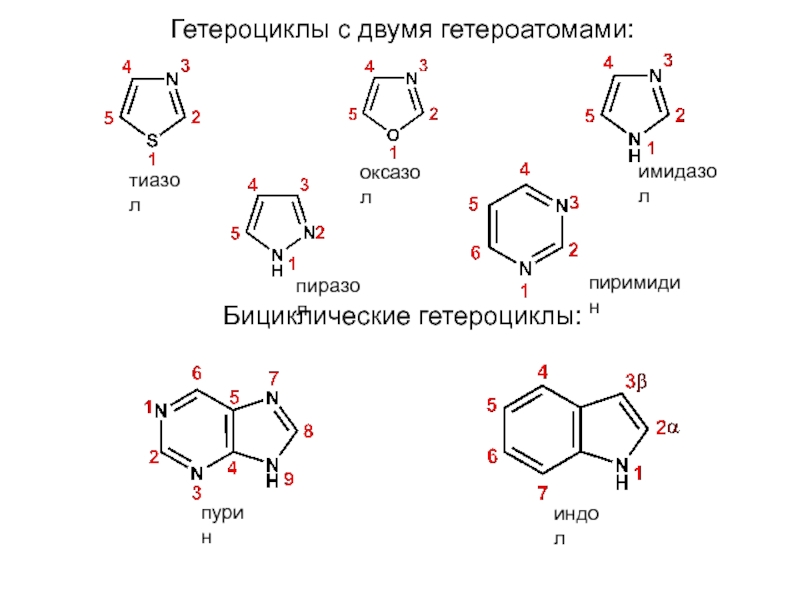
Слайд 9Гетероциклы с двумя гетероатомами:
Бициклические гетероциклы:
оксазол
тиазол
имидазол
пиразол
пиримидин
пурин
индол
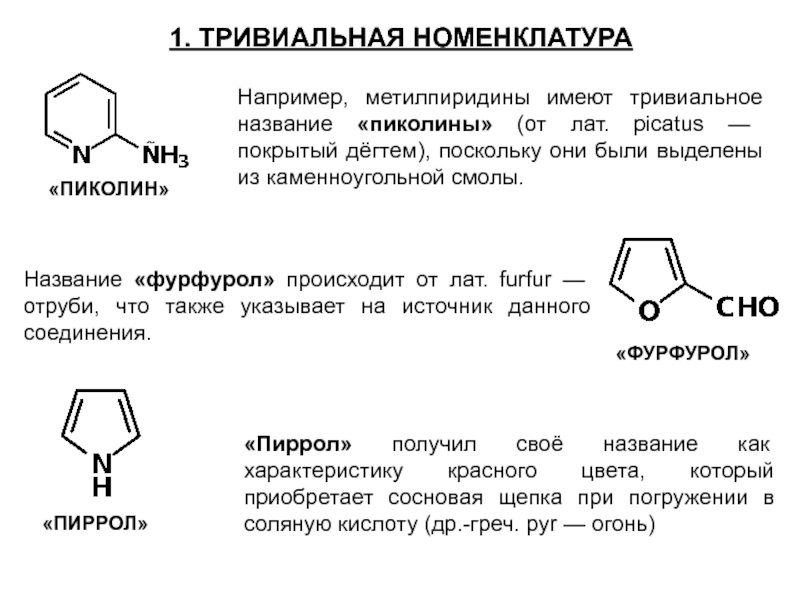
Слайд 101. ТРИВИАЛЬНАЯ НОМЕНКЛАТУРА
«ПИКОЛИН»
Например, метилпиридины имеют тривиальное название «пиколины» (от лат. picatus
Название «фурфурол» происходит от лат. furfur — отруби, что также указывает на источник данного соединения.
«ФУРФУРОЛ»
«Пиррол» получил своё название как характеристику красного цвета, который приобретает сосновая щепка при погружении в соляную кислоту (др.-греч. pyr — огонь)
«ПИРРОЛ»
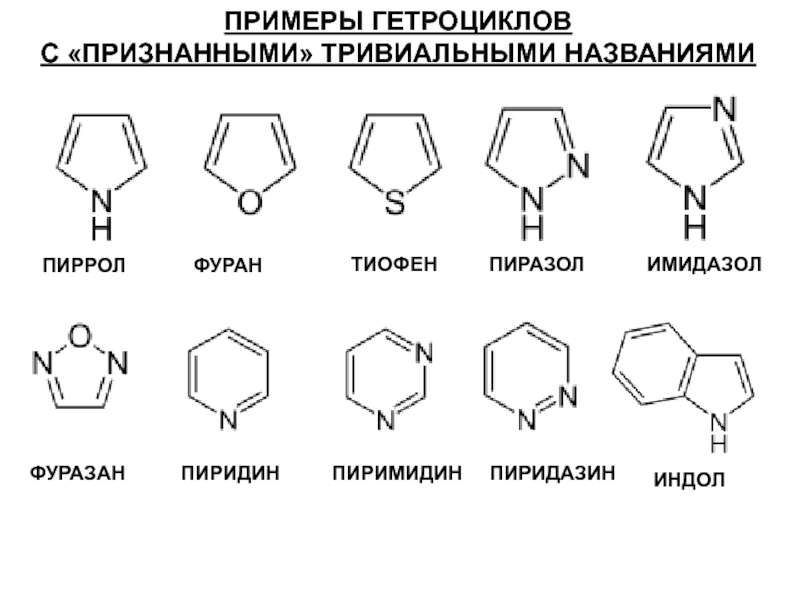
Слайд 11ПРИМЕРЫ ГЕТРОЦИКЛОВ
С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ПИРРОЛ
ФУРАН
ТИОФЕН
ПИРАЗОЛ
ИМИДАЗОЛ
ФУРАЗАН
ПИРИДИН
ПИРИМИДИН
ПИРИДАЗИН
ИНДОЛ
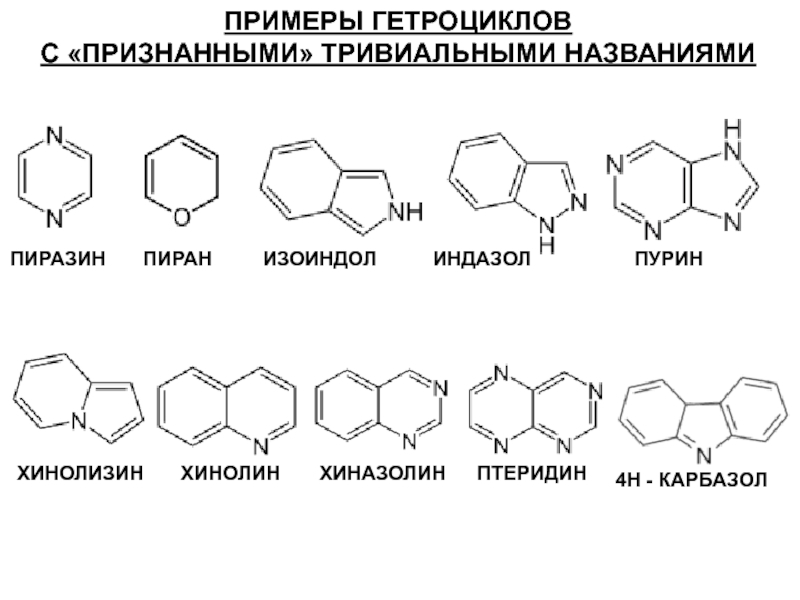
Слайд 12ПРИМЕРЫ ГЕТРОЦИКЛОВ
С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ПИРАЗИН
ПИРАН
ИЗОИНДОЛ
ИНДАЗОЛ
ПУРИН
ХИНОЛИЗИН
ХИНОЛИН
ХИНАЗОЛИН
ПТЕРИДИН
4Н - КАРБАЗОЛ
Слайд 13ПРИМЕРЫ ГЕТРОЦИКЛОВ
С «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ФЕНАНТРИДИН
АКРИДИН
ПЕРИМИДИН
ФЕНАЗИН
ФЕНОТИАЗИН
ФЕНОКСАЗИН
Слайд 163. ЗАМЕНИТЕЛЬНАЯ НОМЕНКЛАТУРА
Заменительная номенклатура рассматривает гетероциклическое соединение как соответствующее карбоциклическое, в
Данный тип номенклатуры также используется для составления названий гетероциклов с положительно заряженными гетероатомами. Отличие состоит в том, что приставки типа окса-, аза-, тиа- заменяются на оксониа-, азониа-, тиониа- и т. д. В названии эти приставки следуют непосредственно за приставками, обозначающими незаряженные гетероатомы (оксониа- после окса-, тиониа- после тиа- и т. д.)
Слайд 18Название цикла, который выбран основным, становится корнем нового названия, а название
изохинолин → изохино-;
имидазол → имидазо-;
пиридин → пиридо-;
тиофен → тиено-;
фуран → фуро-;
хинолин → хино-
НАЗВАНИЕ КОНДЕНСИРОВАННЫХ СИСТЕМ
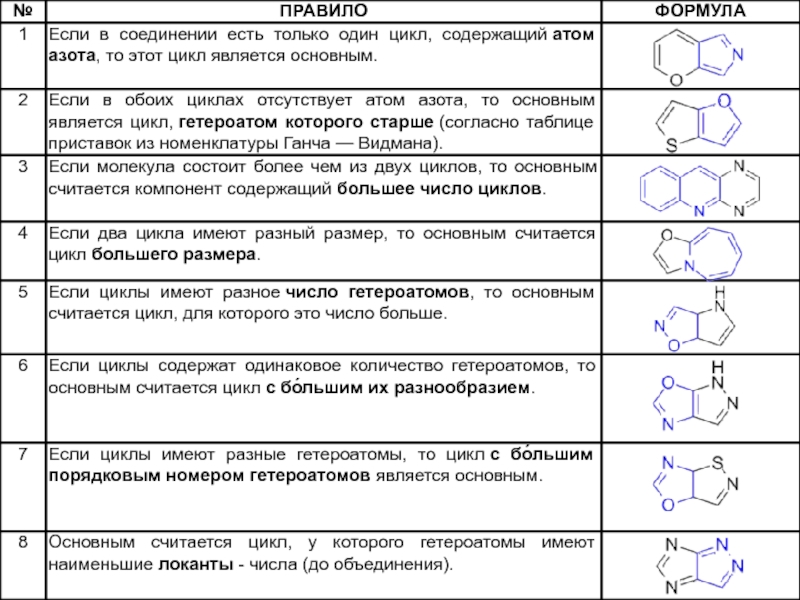
Слайд 19названия пери-конденсированных
гетероциклических систем
После составления названия конденсированный гетероцикл нумеруется заново как целое
Нумерация в молекуле
4H-фуро[2,3-e]-1,2-оксазина
Слайд 21ПИРРОЛ
Пиррол и простые алкилпирролы представ-
-ляют собой бесцветные жидкости с относительно слабым
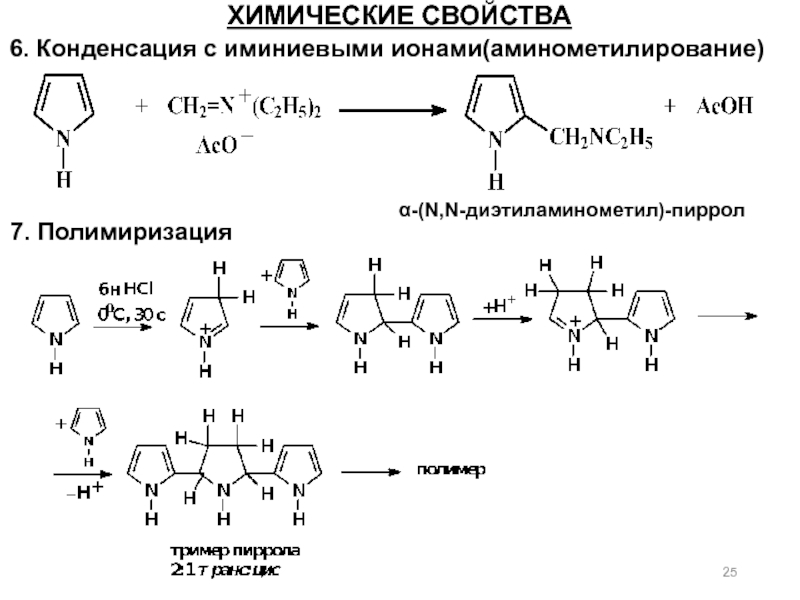
Слайд 256. Конденсация с иминиевыми ионами(аминометилирование)
ХИМИЧЕСКИЕ СВОЙСТВА
α-(N,N-диэтиламинометил)-пиррол
7. Полимиризация
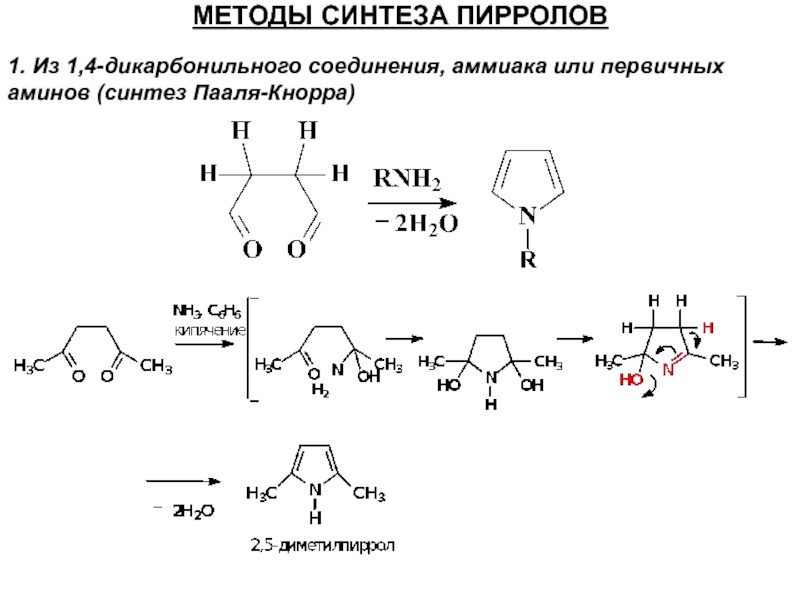
Слайд 28МЕТОДЫ СИНТЕЗА ПИРРОЛОВ
1. Из 1,4-дикарбонильного соединения, аммиака или первичных аминов (синтез
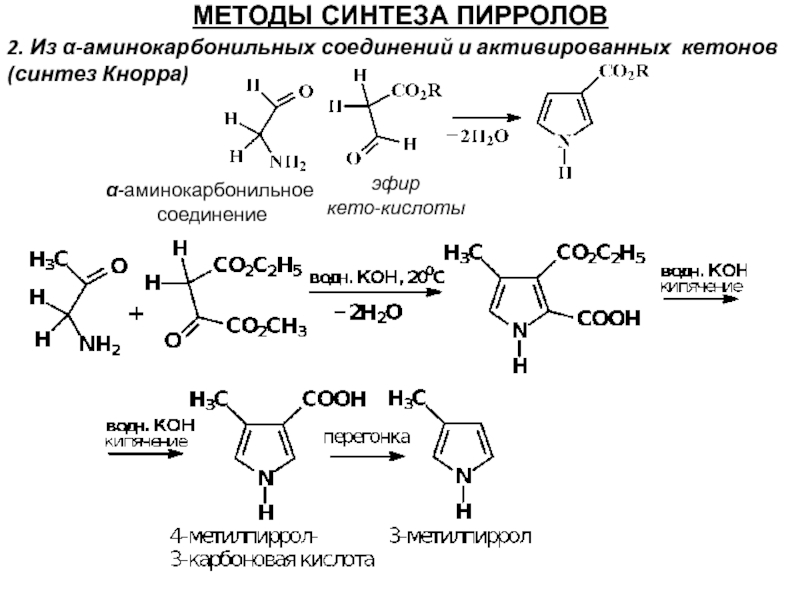
Слайд 29МЕТОДЫ СИНТЕЗА ПИРРОЛОВ
2. Из α-аминокарбонильных соединений и активированных кетонов (синтез Кнорра)
α-аминокарбонильное
эфир
кето-кислоты
Слайд 30МЕТОДЫ СИНТЕЗА ПИРРОЛОВ
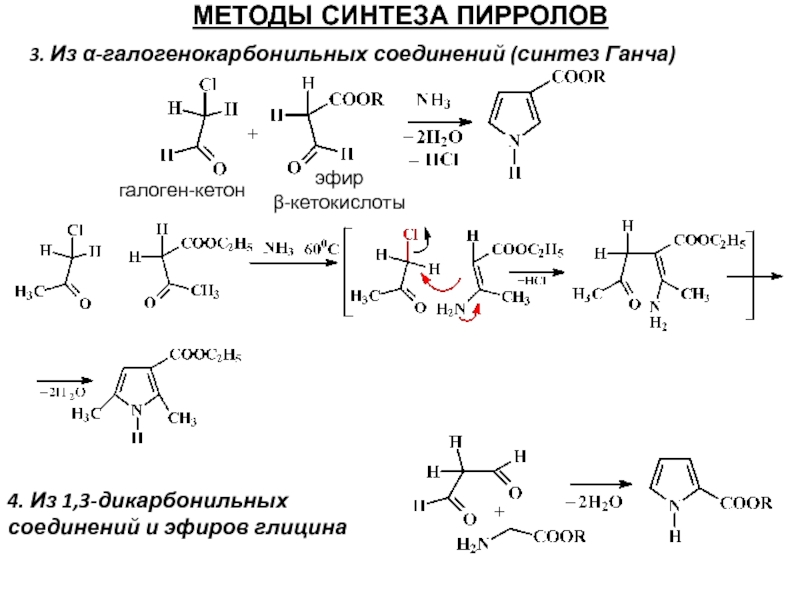
3. Из α-галогенокарбонильных соединений (синтез Ганча)
эфир
β-кетокислоты
галоген-кетон
4. Из 1,3-дикарбонильных
соединений и эфиров глицина
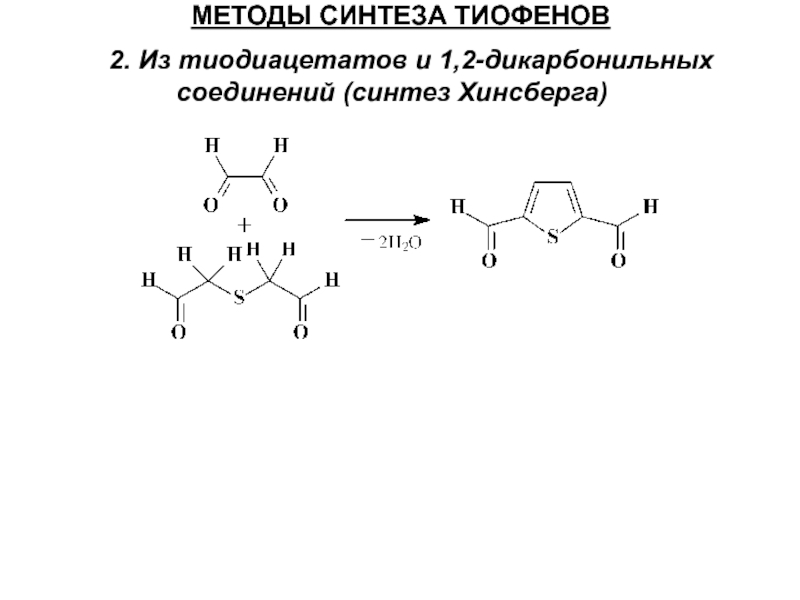
Слайд 31МЕТОДЫ СИНТЕЗА ТИОФЕНОВ
2. Из тиодиацетатов и 1,2-дикарбонильных соединений (синтез Хинсберга)
Слайд 32
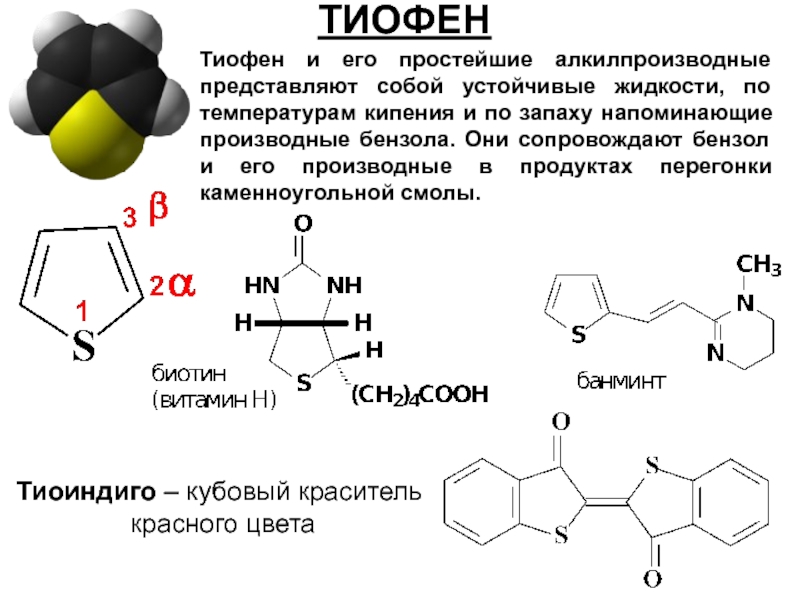
ТИОФЕН
Тиофен и его простейшие алкилпроизводные представляют собой устойчивые жидкости, по температурам
Тиоиндиго – кубовый краситель
красного цвета
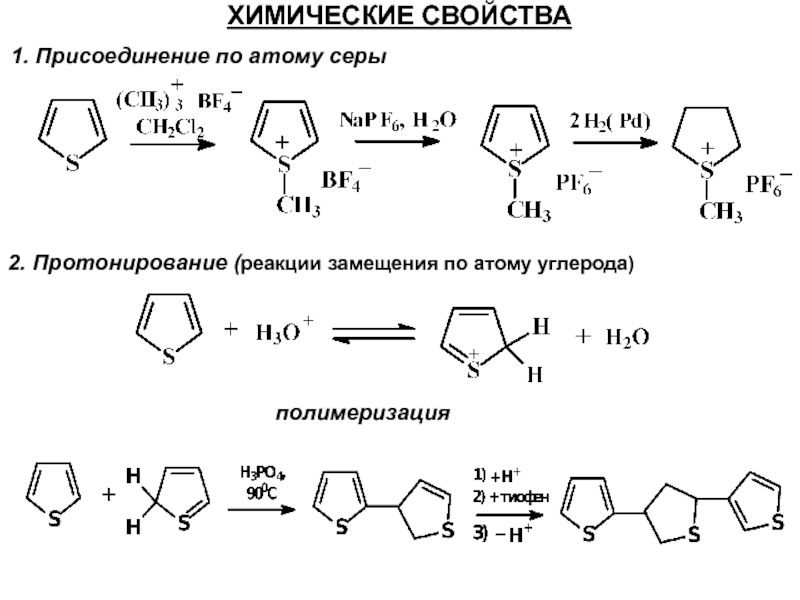
Слайд 33ХИМИЧЕСКИЕ СВОЙСТВА
1. Присоединение по атому серы
2. Протонирование (реакции замещения по атому
полимеризация
Слайд 35ХИМИЧЕСКИЕ СВОЙСТВА
6. Конденсация, ацилирование, алкилирование
Реакция Манниха протекает с участием только аммиака
Слайд 38МЕТОДЫ СИНТЕЗА ТИОФЕНОВ
2. Из тиодиацетатов и 1,2-дикарбонильных соединений (синтез Хинсберга)
Метод Хинсберга
Слайд 40ФУРАНЫ
Фуран(оксол-2,4-диен) — органическое соединение с формулой C4H4O. Пятичленный гетероцикл с одним
Обычно соединения, содержа-
-щие тиольные группы, обладают неприятным запахом, однако аромат жареного кофе обусловлен присутствием в нем фурфурил-
-тиола, а запах свежеиспеченного хлеба обусловлен фурфуролом.
Слайд 41ФУРАНЫ
Некоторые производные 5-нитрофурфурола используются в качестве химикотерапевтических препаратов, например, бактерицидный препарат
Слайд 42ХИМИЧЕСКИЕ СВОЙСТВА
1. Протонирование
2. Нитрование
Фуран является ароматическим соединением с шестью p-электронами
σ
Реакции с электрофильными реагентами
Слайд 44ХИМИЧЕСКИЕ СВОЙСТВА
4. Механизм - бромирование
Нагревание с фенилсульфоновой кислотой в кислой среде
Слайд 455. Ацилирование
ХИМИЧЕСКИЕ СВОЙСТВА
6. Алкилирование
Алкилирование фурана и его производных по Фриделю-Крафтсу обычно
Примеры препаративного использования реакции включают: получение
2,5-ди-трет-бутилфурана из фурана или фуранкарбоновой кислоты и изопропилирование метилфуроата с двойным замещением по положениям 3 и 4.
Слайд 46Реакции с нуклеофильными реагентами
ХИМИЧЕСКИЕ СВОЙСТВА
1. Нитрозаместители активируют замещение атома галогена:
Фуран играет роль диена и образует аддукты Дильса-Альдера:
Слайд 48МЕТОДЫ СИНТЕЗА ФУРАНОВ
Фурфурол производят из ксилозы, получаемой из пентозанов – полисахаридов,
Слайд 50МЕТОДЫ СИНТЕЗА ФУРАНОВ
1. Из 1,4-дикарбонильных соединений (синтез Пааля – Кнорра)
2. Из
ОКИСЛЕНИЕ:
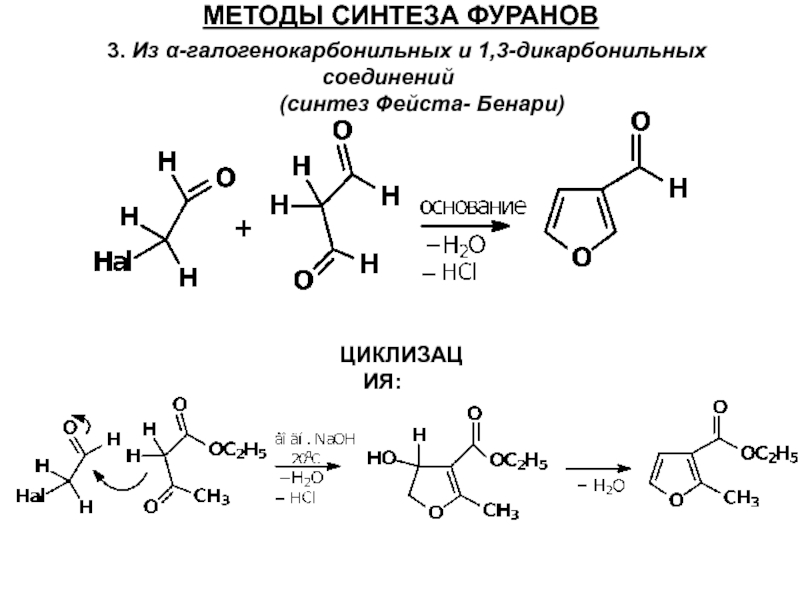
Слайд 51МЕТОДЫ СИНТЕЗА ФУРАНОВ
3. Из α-галогенокарбонильных и 1,3-дикарбонильных соединений
(синтез
ЦИКЛИЗАЦИЯ:
Слайд 52
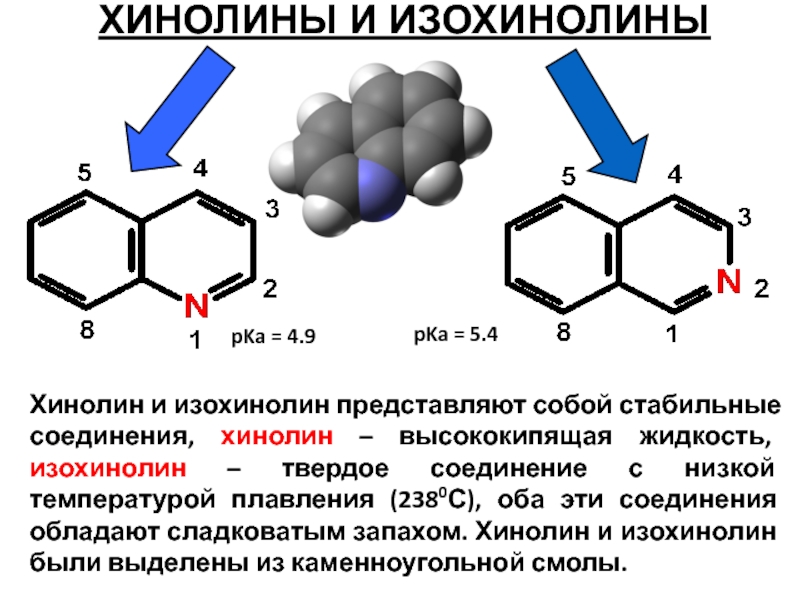
ХИНОЛИНЫ И ИЗОХИНОЛИНЫ
Хинолин и изохинолин представляют собой стабильные соединения, хинолин –
pKa = 4.9
pKa = 5.4
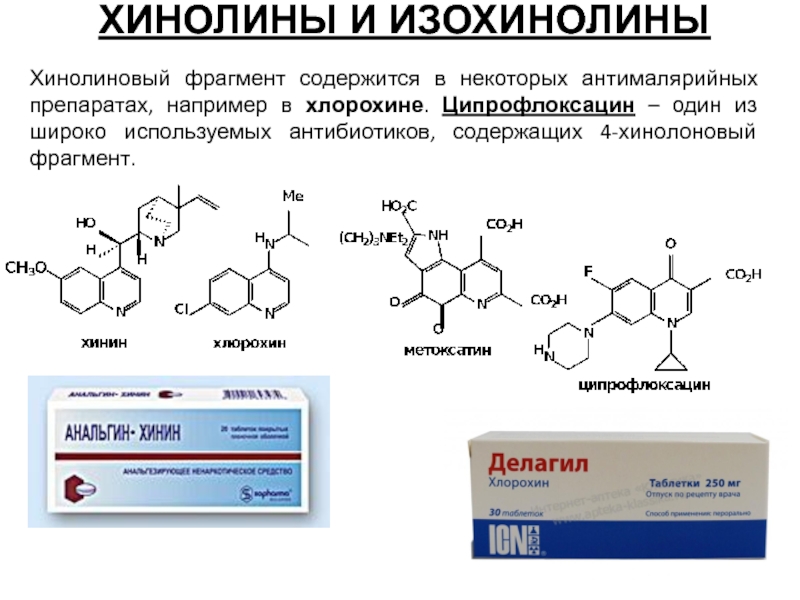
Слайд 53ХИНОЛИНЫ И ИЗОХИНОЛИНЫ
Хинолиновый фрагмент содержится в некоторых антималярийных препаратах, например в
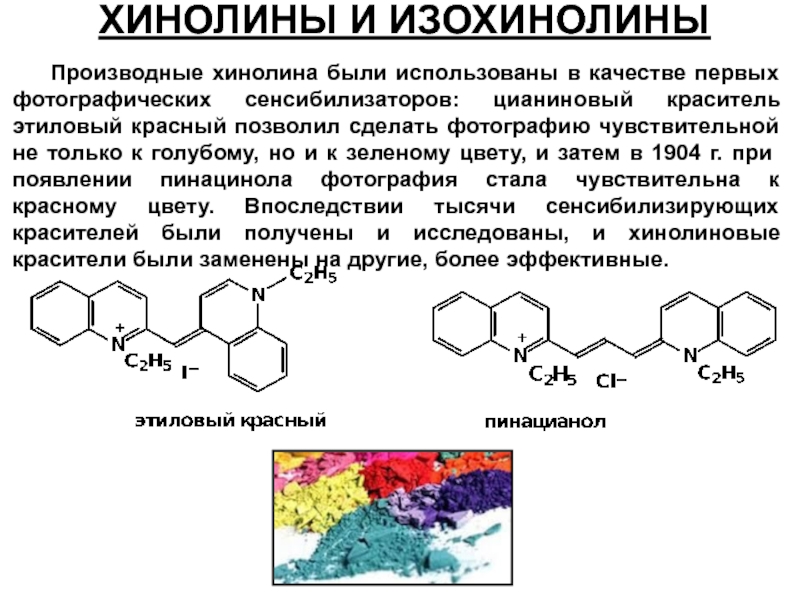
Слайд 54Производные хинолина были использованы в качестве первых фотографических сенсибилизаторов: цианиновый краситель
ХИНОЛИНЫ И ИЗОХИНОЛИНЫ
Слайд 55ХИМИЧЕСКИЕ СВОЙСТВА
1. Присоединение по атому азота
2. Протонирование (реакции замещения по атому
Значения рКа для хинолина и изохинолина равны, что свидетельствует об их сопоставимой с пиридином основности. Хинолин и изохинолин аналогично пиридину образуют N-оксиды и четвертичные соли.
Слайд 59ХИМИЧЕСКИЕ СВОЙСТВА
7. Аминирование и нитрование
Для хинолинов и изохинолинов возможно также окислительное
Введение нитрогруппы в положение 1 изохинолина возможно при действии на него смеси нитрита калия, диметилсульфоксида и уксусного ангидрида. На ключевой стадии этого процесса происходит нуклеофильное присоединение нитрит-аниона к предварительно образовавшейся соли с участием атома азота изохинолина и комплекса диметилсульфоксид – уксусный ангидрид:
Слайд 60ХИМИЧЕСКИЕ СВОЙСТВА
8. Гидроксилирование
9. Нуклеофильное замещение атома галогена
Для реакций этого типа действует
Слайд 61ХИМИЧЕСКИЕ СВОЙСТВА
9. Нуклеофильное замещение атома галогена
10. Реакции с восстановителями
Для хинолина
Слайд 62КЛАСС ХИНОЛИНОВ. ТИПЫ.
ОКСИХИНОЛИНЫ И
ОКСИИЗОХИНОЛИНЫ
АМИНОХИНОЛИНЫ И
АМИНОИЗОХИНОЛИНЫ
АЛКИЛХИНОЛИНЫ И
АЛКИЛИЗОХИНОЛИНЫ
Слайд 63МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ
1. Из ариламинов и 1,3-дикарбонильных соединений
Синтез Комба
Стадия циклизации
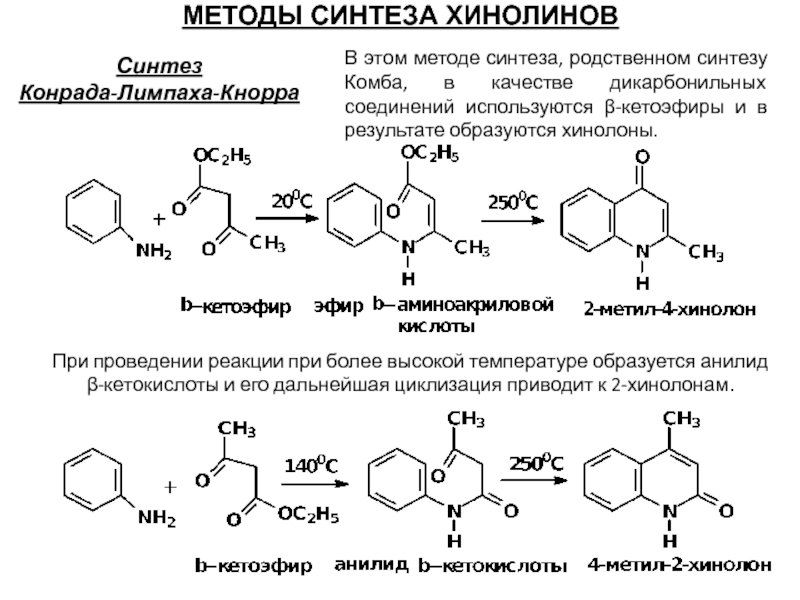
Слайд 64Синтез
Конрада-Лимпаха-Кнорра
МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ
В этом методе синтеза, родственном синтезу Комба, в
При проведении реакции при более высокой температуре образуется анилид
β-кетокислоты и его дальнейшая циклизация приводит к 2-хинолонам.
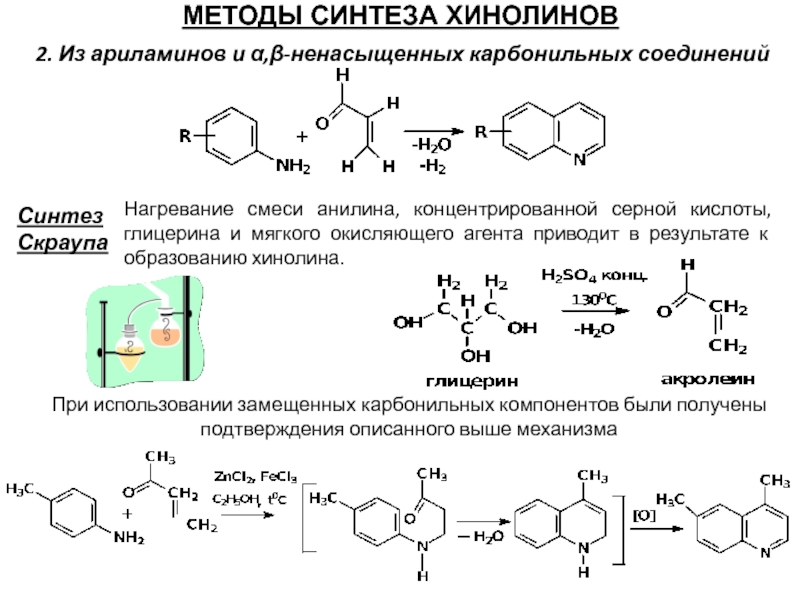
Слайд 65МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ
2. Из ариламинов и α,β-ненасыщенных карбонильных соединений
Синтез
Скраупа
Нагревание смеси анилина, концентрированной серной кислоты, глицерина и мягкого окисляющего агента приводит в результате к образованию хинолина.
При использовании замещенных карбонильных компонентов были получены
подтверждения описанного выше механизма
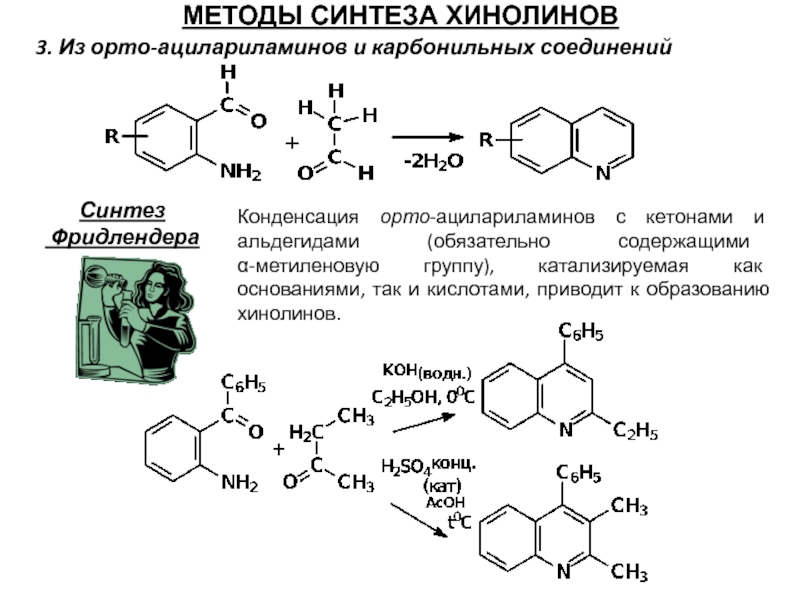
Слайд 66МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ
3. Из орто-ацилариламинов и карбонильных соединений
Синтез
Фридлендера
Конденсация орто-ацилариламинов
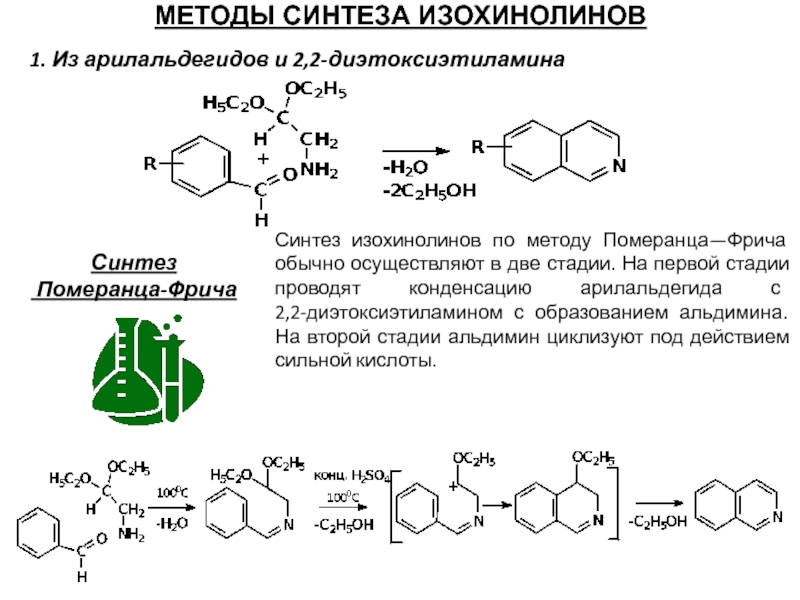
Слайд 67МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ
1. Из арилальдегидов и 2,2-диэтоксиэтиламина
Синтез
Померанца-Фрича
Синтез изохинолинов по







![названия пери-конденсированных гетероциклических системПосле составления названия конденсированный гетероцикл нумеруется заново как целое соединение.Нумерация в молекуле 4H-фуро[2,3-e]-1,2-оксазина](/img/tmb/4/316932/2f1fb93d19d56a4b5e7fe5d41b6e44f2-800x.jpg)