- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Введение в биоорганическую химию. Пространственное и электронное строение органических соединений презентация
Содержание
- 1. Введение в биоорганическую химию. Пространственное и электронное строение органических соединений
- 2. Биоорганическая химия изучает строение и
- 3. Уникальность углерода Способность к катенированию – образованию
- 4. Классификация органических соединений Основные классификационные признаки:
- 5. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Линейные Циклические
- 6. II. В зависимости от природы функциональной группы
- 7. III. В зависимости от количества и разнообразия
- 8. Пространственное строение органических
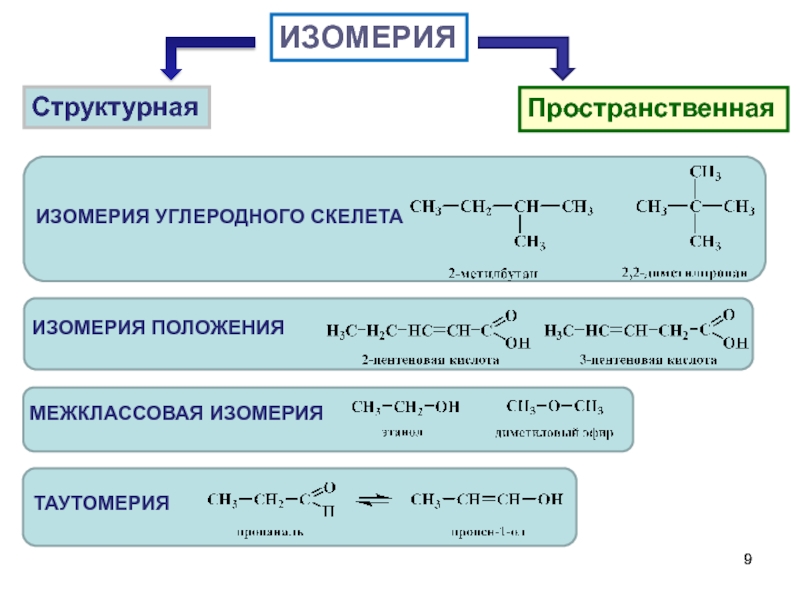
- 9. ИЗОМЕРИЯ Структурная Пространственная
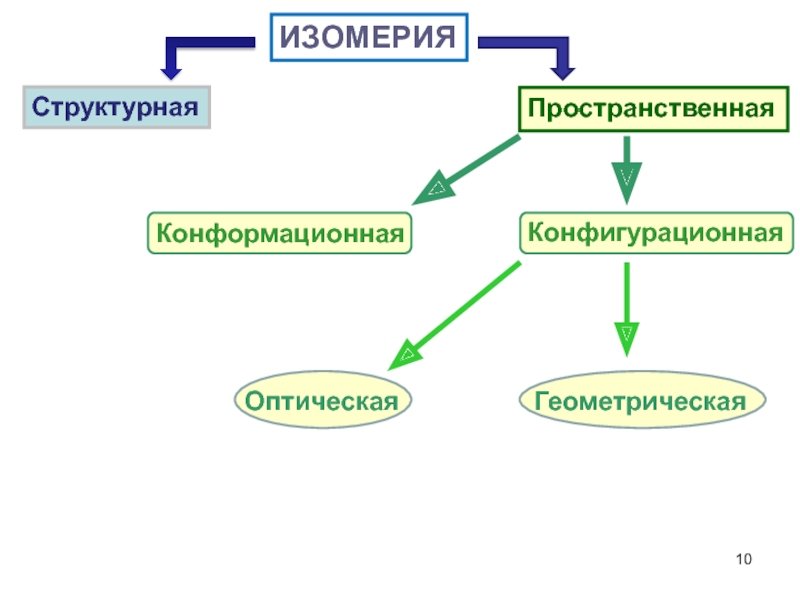
- 10. Конфигурационная ИЗОМЕРИЯ Структурная Пространственная
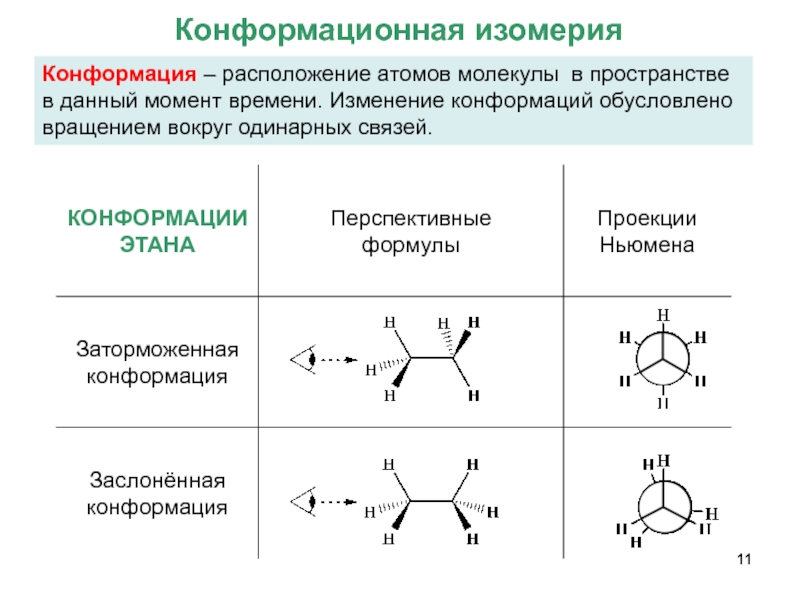
- 11. Конформация – расположение атомов молекулы в пространстве
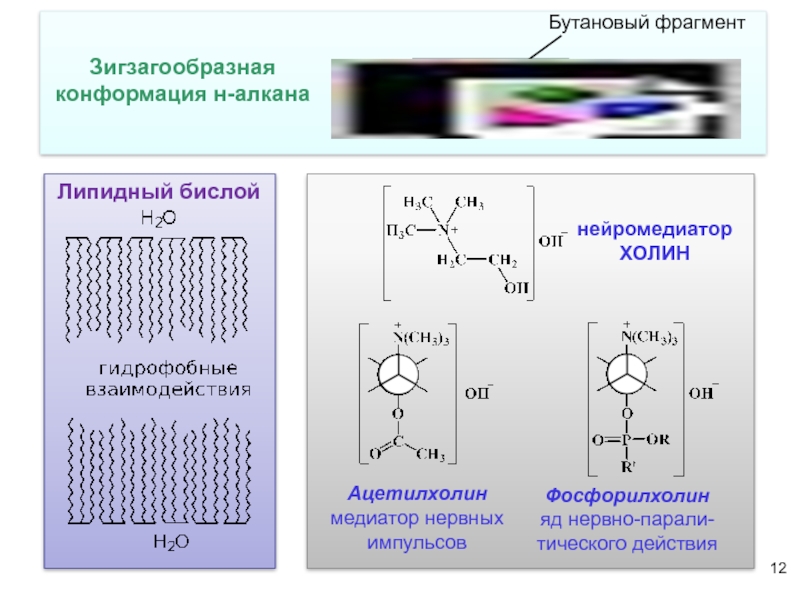
- 12. Бутановый фрагмент Зигзагообразная
- 13. Конфигурационная изомерия Оптическая изомерия Геометрическая
- 14. Причина – отсутствие свободного вращения
- 15. Энантиомеры – стереоизомеры, молекулы которых относятся друг
- 16. Простейший случай хиральности в молекулах органических соединений
- 17. Свойства энантиомеров 1) Химические Энантиомеры идентичны
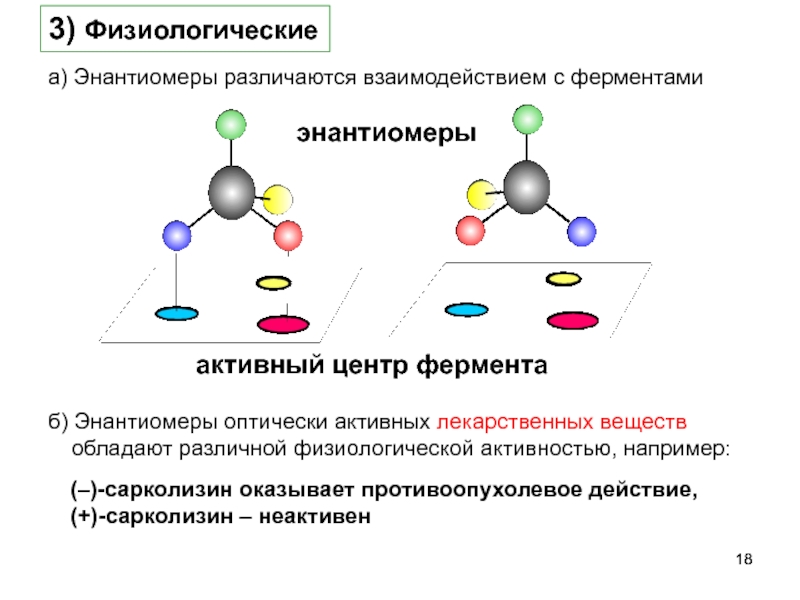
- 18. энантиомеры активный центр фермента а) Энантиомеры различаются
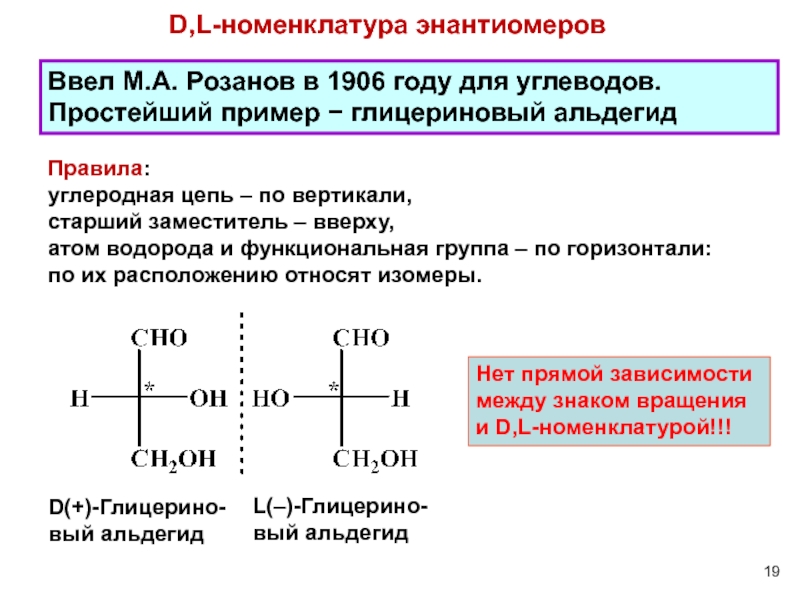
- 19. D,L-номенклатура энантиомеров L(–)-Глицерино- вый альдегид
- 20. Диастереомеры – такие оптические изомеры, которые не
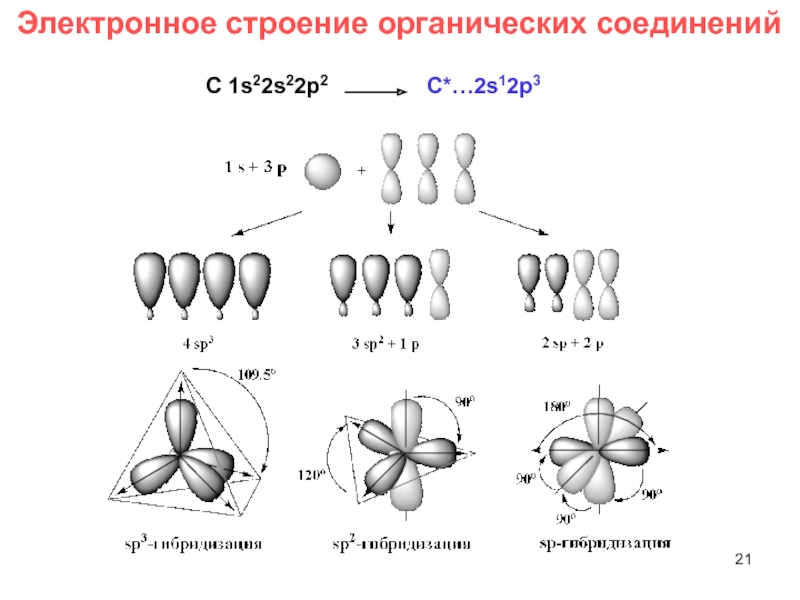
- 21. Электронное строение органических соединений С 1s22s22p2
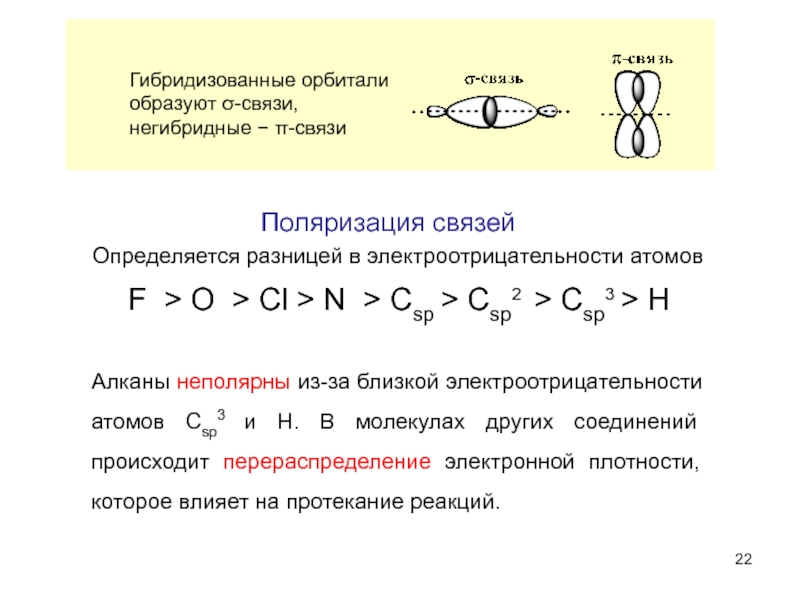
- 22. Алканы неполярны из-за близкой электроотрицательности атомов Csp3
- 23. Индуктивный эффект (I-эффект) – влияние заместителя на
- 24.
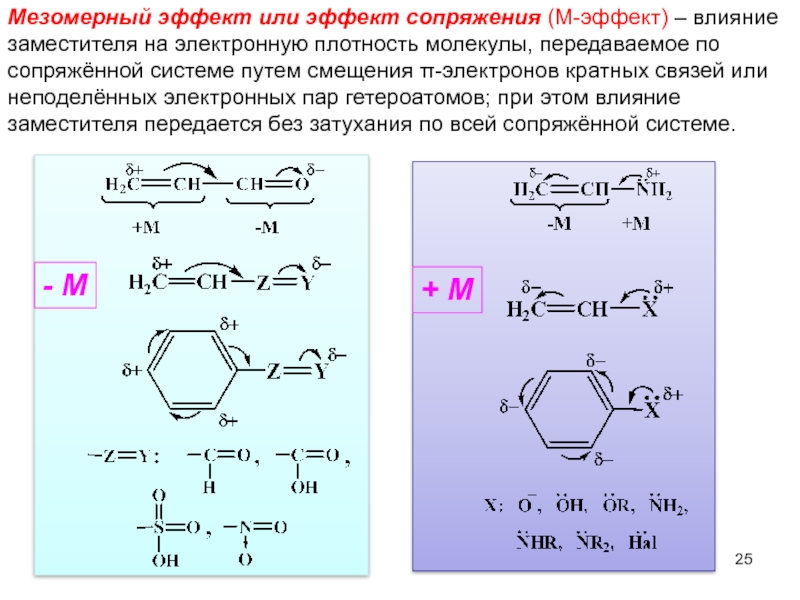
- 25. Мезомерный эффект или эффект сопряжения (М-эффект) –
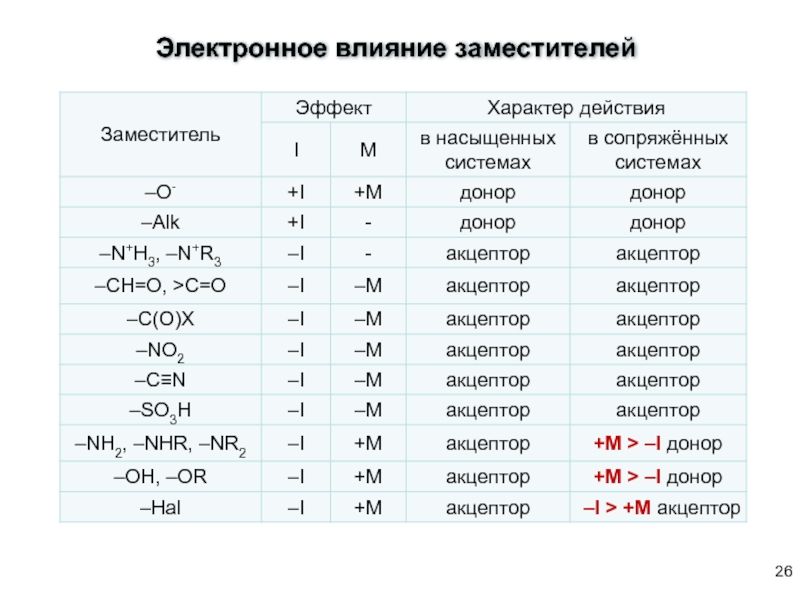
- 26. Электронное влияние заместителей
Слайд 1Кафедра химии
Тема лекции:
Введение в биоорганическую химию.
Пространственное и электронное строение органических соединений
Слайд 2 Биоорганическая химия изучает строение и свойства
веществ, участвующих в процессах
в непосредственной связи с познанием их биологичес-
ких функций.
Предмет и задачи биоорганической химии
«Органическая химия – химия соединений углерода с другими элементами» Август Кекуле
«Органическая химия – химия углеводородов и их функциональных производных»
Карл Шорлеммер
Слайд 3Уникальность углерода
Способность к катенированию – образованию исключительно прочных связей с самим
2. Многообразие структур на основе углерода:
- неограниченная длина цепочек,
- способность к разветвлениям,
- образование циклов,
- образование кратных связей.
3. Возможность одновременного образования связей как с более, так и с менее электроотрицательными атомами (водородом, кислородом, азотом и др.).
Слайд 4
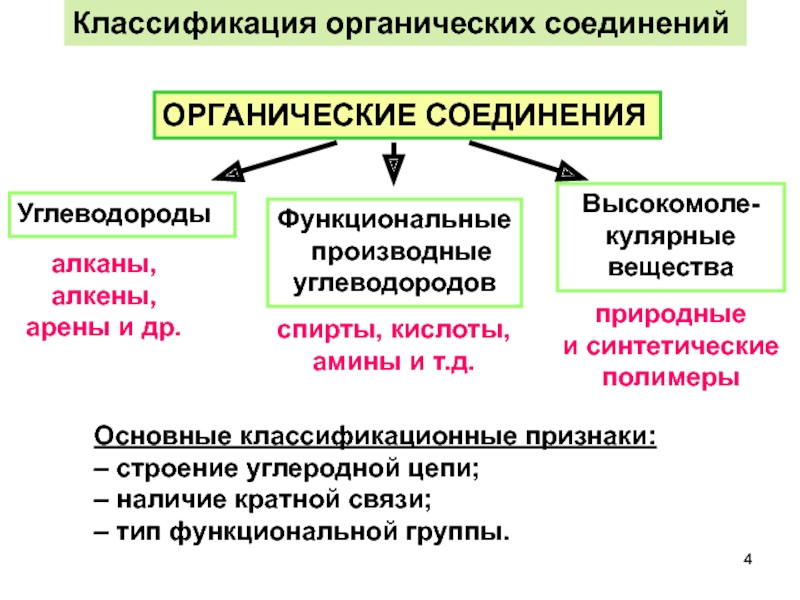
Классификация органических соединений
Основные классификационные признаки:
– строение углеродной цепи;
– наличие кратной связи;
–
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Углеводороды
Функциональные
производные
углеводородов
Высокомоле-кулярные вещества
алканы,
алкены, арены и др.
спирты, кислоты,
амины и т.д.
природные
и синтетические полимеры
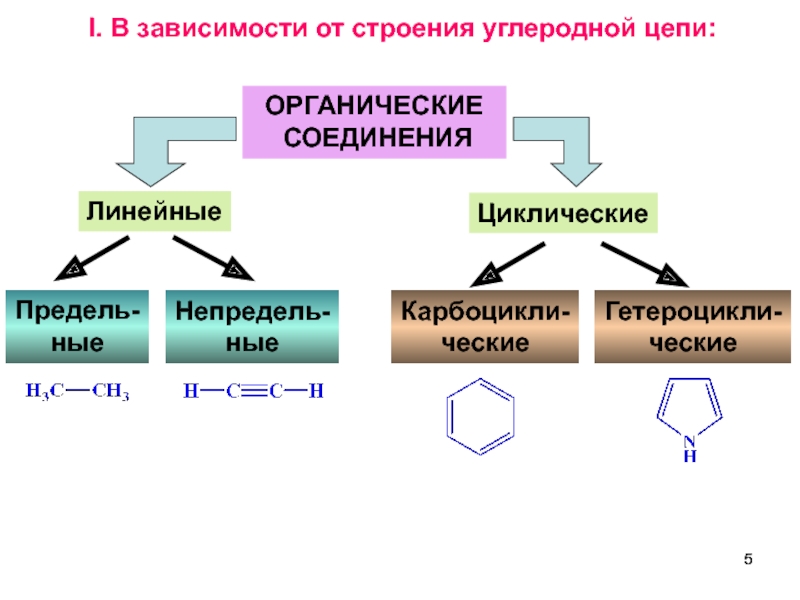
Слайд 5ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Линейные
Циклические
Непредель-
ные
Карбоцикли-
ческие
Гетероцикли-
ческие
I. В зависимости от строения углеродной цепи:
Предель-
ные
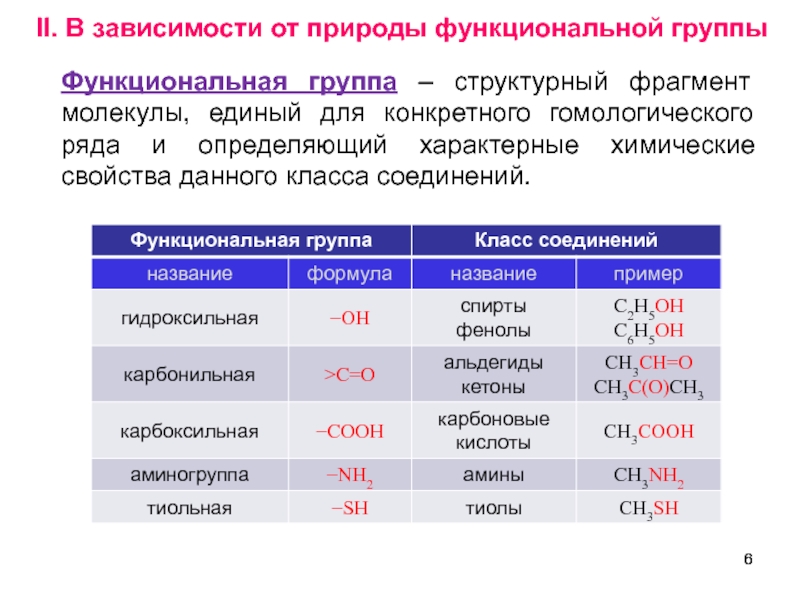
Слайд 6II. В зависимости от природы функциональной группы
Функциональная группа – структурный фрагмент
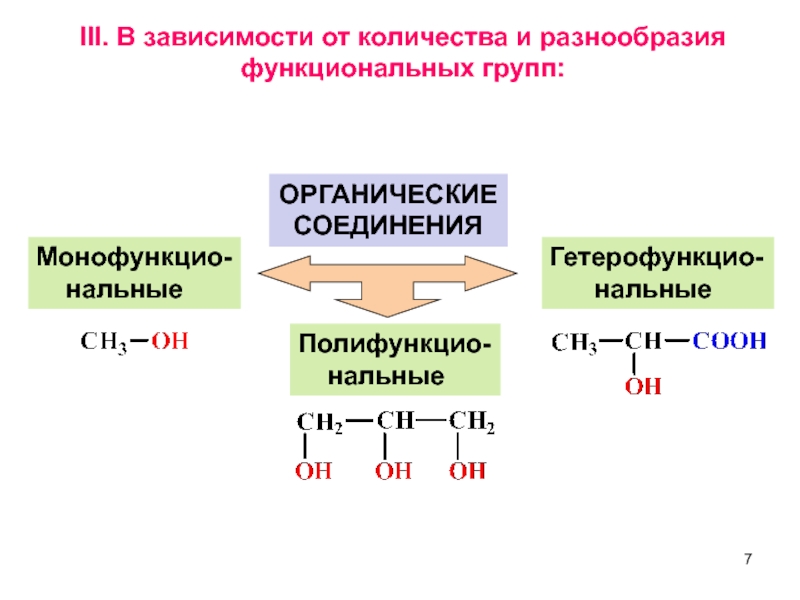
Слайд 7III. В зависимости от количества и разнообразия функциональных групп:
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Монофункцио-
Полифункцио-
нальные
Гетерофункцио-
нальные
Слайд 8Пространственное строение органических
соединений.
Явление существования индивидуальных химических
соединений, одинаковых по молярной массе и составу,
но различающихся по строению и расположению атомов
в пространстве, а вследствие этого – и по свойствам,
называется ИЗОМЕРИЕЙ, а соединения – изомерами.
В молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связей атомов называется ХИМИЧЕСКИМ СТРОЕНИЕМ.
А.М. Бутлеров
Слайд 11Конформация – расположение атомов молекулы в пространстве в данный момент времени.
Конформационная изомерия
Слайд 12
Бутановый фрагмент
Зигзагообразная конформация н-алкана
Липидный бислой
нейромедиатор
ХОЛИН
Ацетилхолин
медиатор нервных импульсов
Фосфорилхолин
яд нервно-парали-
тического действия
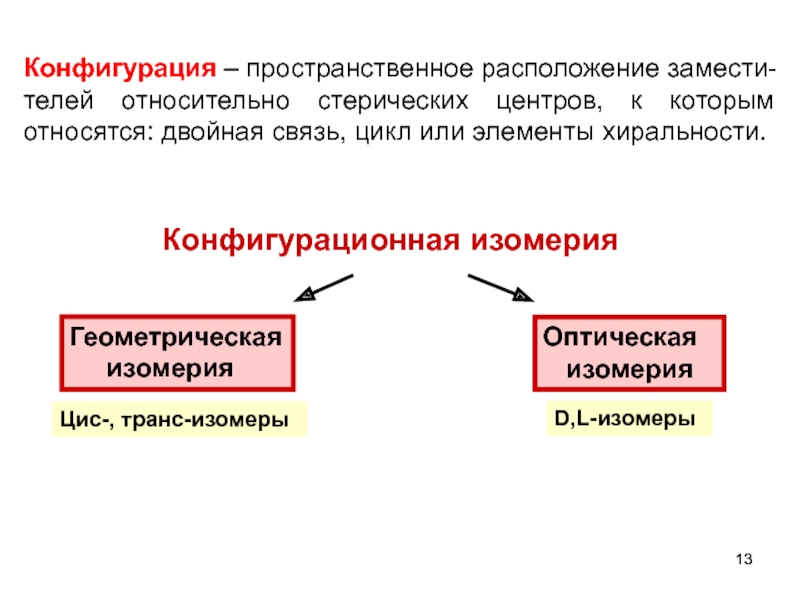
Слайд 13Конфигурационная изомерия
Оптическая
изомерия
Геометрическая
изомерия
D,L-изомеры
Цис-, транс-изомеры
Конфигурация – пространственное расположение замести-
телей относительно
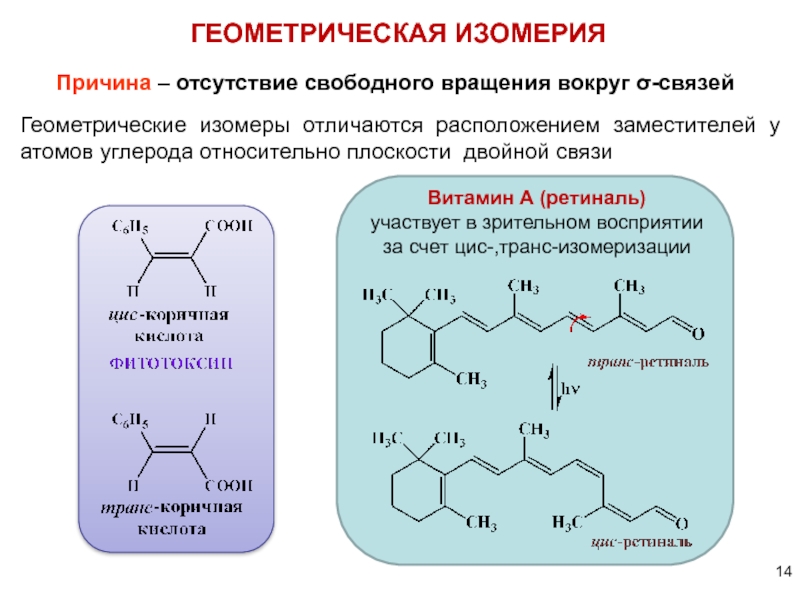
Слайд 14
Причина – отсутствие свободного вращения вокруг σ-связей
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Геометрические изомеры отличаются расположением
Витамин А (ретиналь)
участвует в зрительном восприятии
за счет цис-,транс-изомеризации
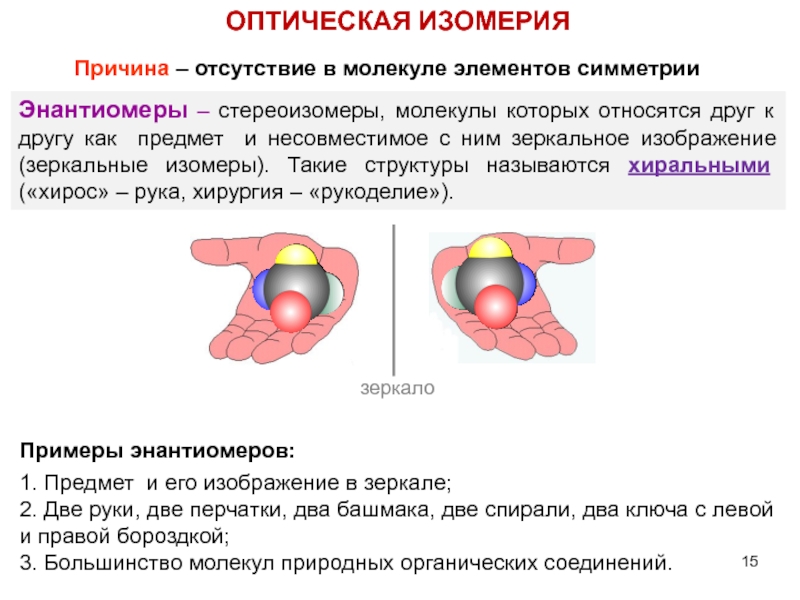
Слайд 15Энантиомеры – стереоизомеры, молекулы которых относятся друг к другу как предмет
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Причина – отсутствие в молекуле элементов симметрии
зеркало
Примеры энантиомеров:
1. Предмет и его изображение в зеркале;
2. Две руки, две перчатки, два башмака, две спирали, два ключа с левой и правой бороздкой;
3. Большинство молекул природных органических соединений.
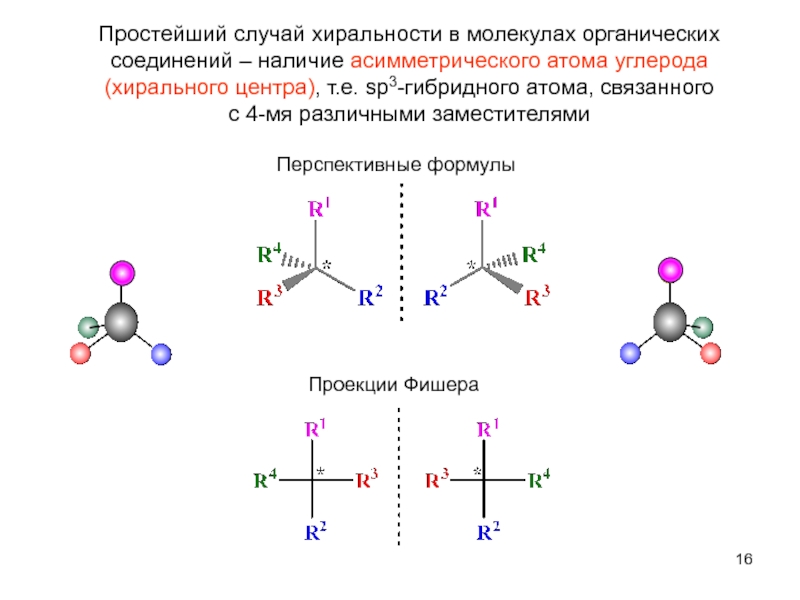
Слайд 16Простейший случай хиральности в молекулах органических соединений – наличие асимметрического атома
с 4-мя различными заместителями
Проекции Фишера
Перспективные формулы
Слайд 17
Свойства энантиомеров
1) Химические
Энантиомеры идентичны в большинстве свойств, исключая те, что проявляются
2) Физические
Поляризованный свет асимметричен, поэтому все физические свойства одинаковы, кроме одного – способности вращать в разные стороны, но на одинаковый угол плоскость поляризованного света.
Это свойство – оптическая активность.
Измеряется с помощью приборов – поляриметров
Левовращающий изомер – (–)
Правовращающий изомер – (+)
Эквимолярная смесь двух энантиомеров – рацемат – оптически не активна!!!
Энантиомеры – оптические изомеры
Слайд 18энантиомеры
активный центр фермента
а) Энантиомеры различаются взаимодействием с ферментами
3) Физиологические
(–)-сарколизин оказывает противоопухолевое
(+)-сарколизин – неактивен
б) Энантиомеры оптически активных лекарственных веществ обладают различной физиологической активностью, например:
Слайд 19D,L-номенклатура энантиомеров
L(–)-Глицерино-
вый альдегид
D(+)-Глицерино-
вый альдегид
Ввел М.А. Розанов в 1906 году для
Нет прямой зависимости между знаком вращения и D,L-номенклатурой!!!
Правила:
углеродная цепь – по вертикали,
старший заместитель – вверху,
атом водорода и функциональная группа – по горизонтали:
по их расположению относят изомеры.
Слайд 20Диастереомеры – такие оптические изомеры, которые не являются энантиомерами (у них
У диастереомеров все физические и химические свойства различны (на этом основан химический способ разделения рацемических смесей на антиподы)
Формула для расчета количества оптических изомеров: N = 2n,
где n – число асимметрических атомов углерода
Слайд 22Алканы неполярны из-за близкой электроотрицательности атомов Csp3 и H. В молекулах
Слайд 23Индуктивный эффект (I-эффект) – влияние заместителя на электронную плотность молекулы путем
σ-связей, вызванное разницей в электроотрицательности атомов, образующих связи.
Знак эффекта определяется зарядом, который приобретает заместитель.
Влияние заместителя быстро затухает и вызывает поляризацию всего двух-трех σ-связей.
Индуктивный эффект проявляется во всех соединениях, в которых разные по электроотрицательности атомы связаны ковалентными σ-связями.
Слайд 25Мезомерный эффект или эффект сопряжения (М-эффект) – влияние заместителя на электронную