- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С презентация
Содержание
- 1. Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С
- 2. Витамины — группа низкомолекулярных органических соединений относительно
- 3. Химическая класификация витаминов: 1. Алифатического ряда: С,
- 4. Витамины алифатического ряда
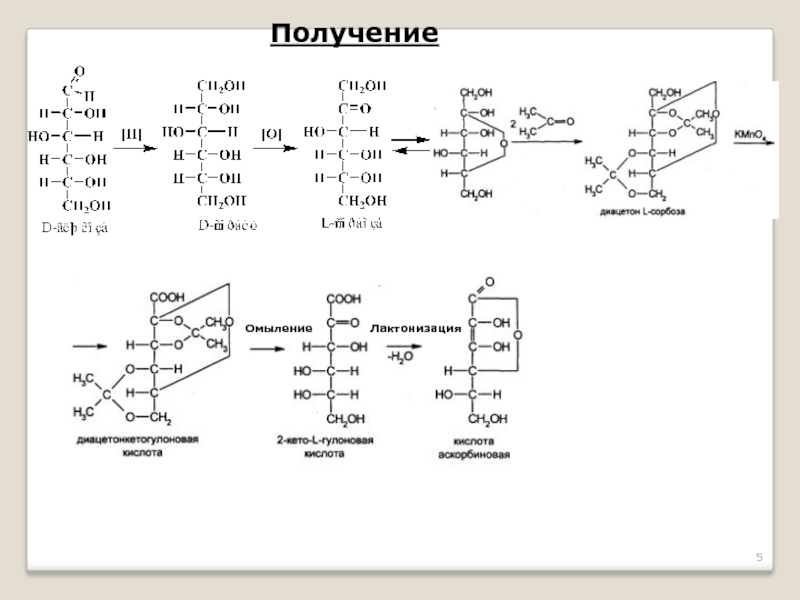
- 5. Получение Лактонизация Омыление
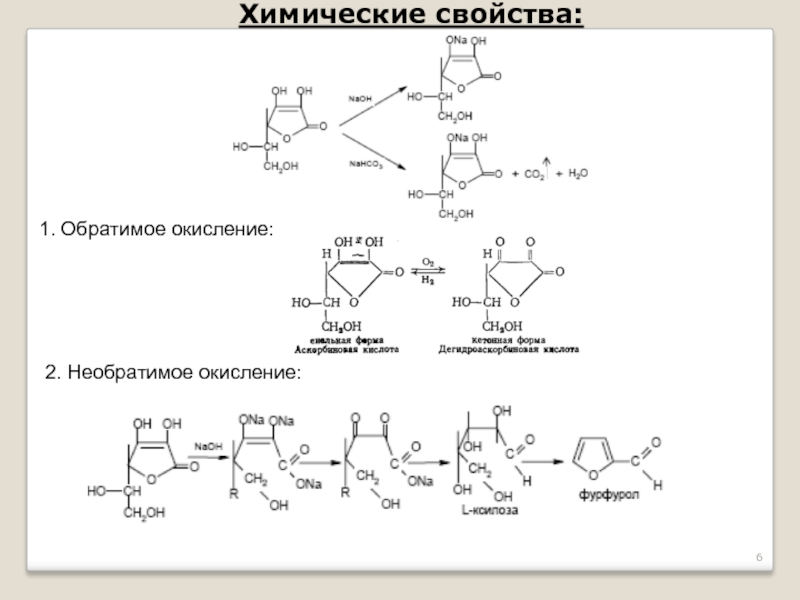
- 6. Химические свойства: 1. Обратимое окисление: 2. Необратимое окисление:
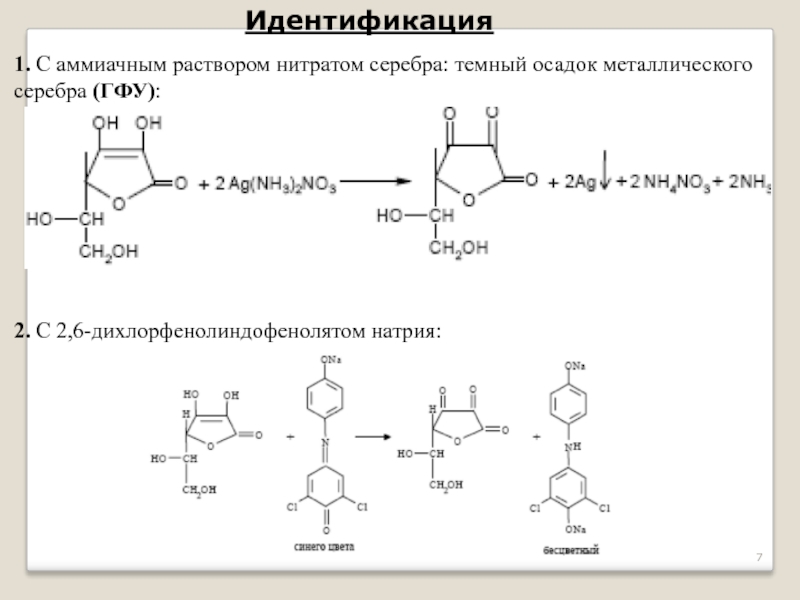
- 7. Идентификация 1. С аммиачным раствором нитратом серебра:
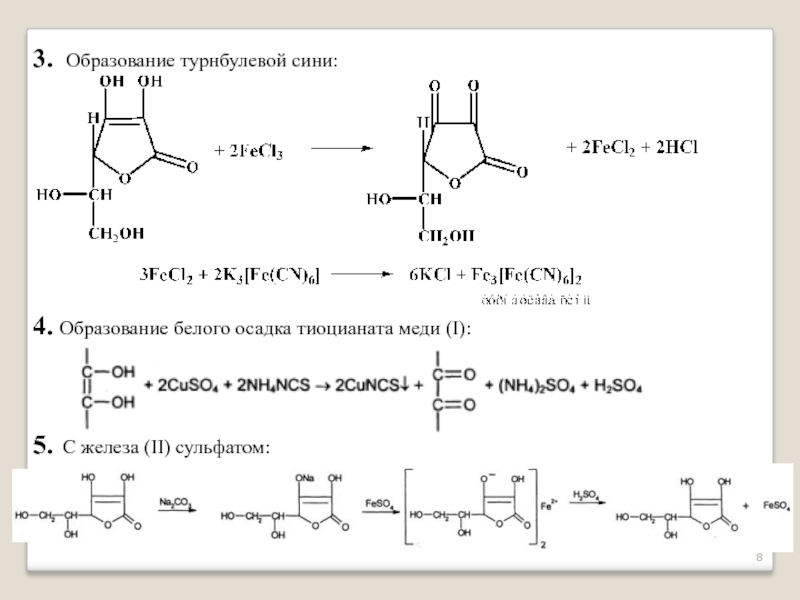
- 8. 3. Образование турнбулевой сини:
- 9. ОПРЕДЕЛЕНИЕ ЧИСТОТЫ (ГФУ) Прозрачность, цветность; Удельное вращение
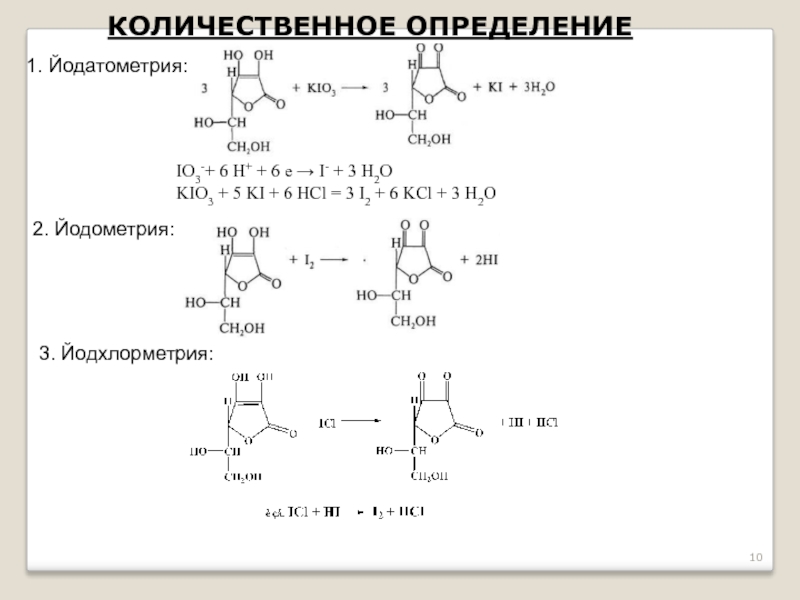
- 10. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ 1. Йодатометрия: IO3-+ 6 H+
Слайд 1Министерство здравоохранения Украины
Запорожский государственный медицинский университет
Кафедра фармацевтической химии
Витамины. Общая характеристика. Классификация.
Витамины
Слайд 2Витамины — группа низкомолекулярных органических соединений относительно простого строения и разнообразной
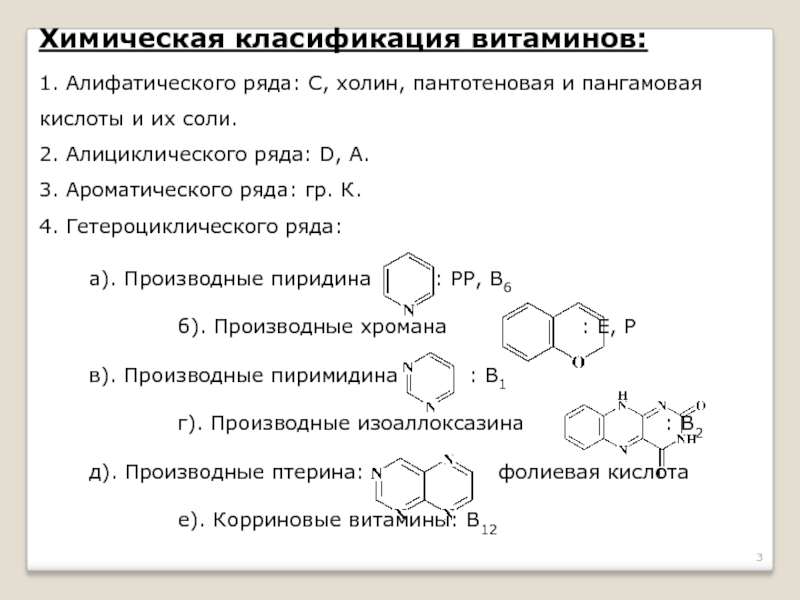
Слайд 3Химическая класификация витаминов:
1. Алифатического ряда: С, холин, пантотеновая и пангамовая кислоты
2. Алициклического ряда: D, А.
3. Ароматического ряда: гр. К.
4. Гетероциклического ряда:
а). Производные пиридина : РР, В6
б). Производные хромана : Е, Р
в). Производные пиримидина : В1
г). Производные изоаллоксазина : В2
д). Производные птерина: фолиевая кислота
е). Корриновые витамины: В12
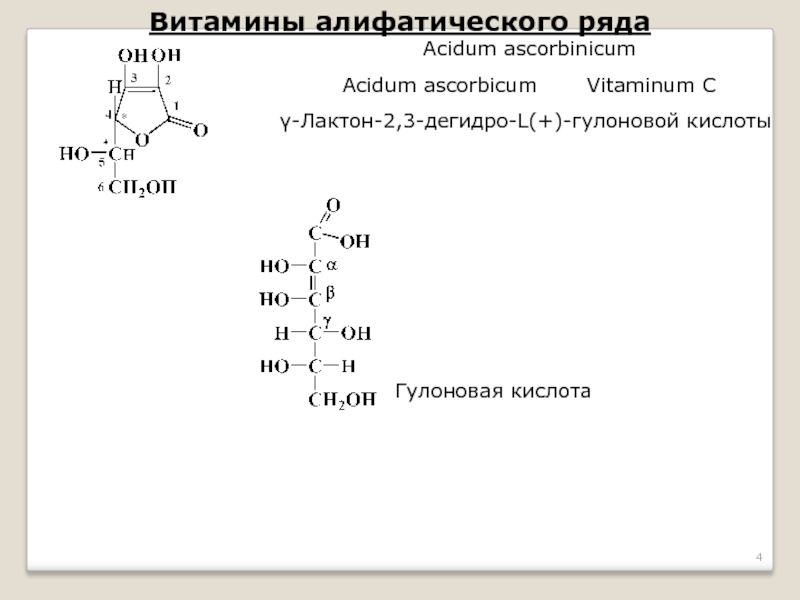
Слайд 4Витамины алифатического ряда
Acidum ascorbicum Vitaminum C
γ-Лактон-2,3-дегидро-L(+)-гулоновой кислоты
Гулоновая кислота
Слайд 7Идентификация
1. С аммиачным раствором нитратом серебра: темный осадок металлического серебра (ГФУ):
2. С 2,6-дихлорфенолиндофенолятом натрия:
Слайд 83. Образование турнбулевой сини:
4. Образование белого осадка тиоцианата меди (I):
5. С
Слайд 9ОПРЕДЕЛЕНИЕ ЧИСТОТЫ (ГФУ)
Прозрачность, цветность;
Удельное вращение от +20,5 до +21,5;
Щавелевая кислота -
Медь, железо - методом атомно-адсорбционной спектроскопии;
Тяжелые металлы;
Сульфатная зола;
Национальная часть: Остаточные количества органических растворителей.
Слайд 10КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
1. Йодатометрия:
IO3-+ 6 H+ + 6 е → I- +
KIO3 + 5 KI + 6 HCl = 3 I2 + 6 KCl + 3 H2O
2. Йодометрия:
3. Йодхлорметрия: