- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Игра-квест на уроке химии презентация
Содержание
- 1. Игра-квест на уроке химии
- 2. Проектная деятельность Учитель постоянно в поиске методов,
- 3. И вот опять урок! Чем бы мне заинтересовать ученика сегодня?
- 4. Хочется чтобы было все ново, интересно, современно.
- 5. МЫ ЛЮБИМ КВЕСТЫ Что сейчас модно и актуально ?
- 6. ИДЕЯ
- 7. Игровой квест на уроке химии Учитель химии МОУ «ООШ №39»г.Саратова Бубнова Е.В.
- 8. Квест в реальности — это развлекательная игра
- 9. Сюжеты Квестов в реальности могут быть самыми
- 10. По ходу действия от игроков чаще всего
- 11. В зависимости от сложности квеста выбираются временные
- 12. Цель: - вызвать интерес к предмету; -развивать чувство самостоятельности, дисциплинированности, поиска;
- 13. КВЕСТ ХИМИЧЕСКИЕ ЗАПИСИ Петра I
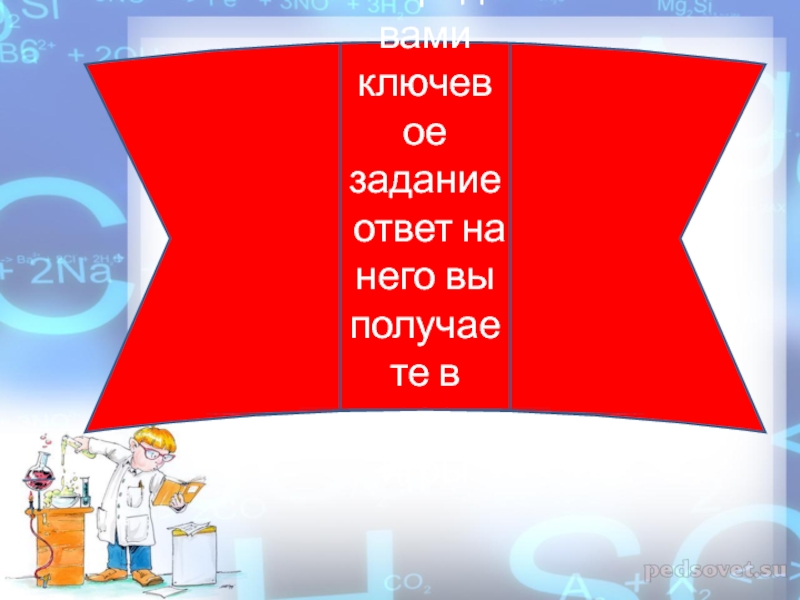
- 14. Перед вами ключевое задание ответ на него вы получаете в конце игры
- 16. ЗАДАНИЕ I «ЛАБИРИНТ» ____________посчитайте их количество
- 17. ЗАДАНИЕ I «ЛАБИРИНТ»
- 18. ЗАДАНИЕ I I «КРОССВОРД»
- 20. ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА»
- 21. Установите соответствие между двумя веществами, взятыми в
- 22. Установите соответствие между двумя веществами, взятыми в
- 23. ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА» С
- 24. ЗАДАНИЕ I V «неожиданный взрыв» Студенту
- 25. Соли хлорной кислоты « перхлораты» например КClO4
- 26. КОД ЗАМКА
- 27. Карбонат калия, медь, азот, мочевина, вода
- 28. Литература: «Книга по химии для домашнего
- 29. Спасибо за внимание!
Слайд 1Игра-квест на уроке химии автор Бубнова Елена Владимировна учитель химии МОУ «ООШ
Слайд 2Проектная деятельность
Учитель постоянно в поиске методов, приёмов позволяющих заинтересовать ученика, активизировать
Кружковая работа
Внеклассные мероприятия
ИКТ на уроках химии
Практические работы
Слайд 4Хочется чтобы было все ново, интересно, современно.
Интернет технологии, видеоролики уже не
Слайд 8Квест в реальности — это развлекательная игра для команды из нескольких
Слайд 9Сюжеты Квестов в реальности могут быть самыми разными, от популярных фильмов
Слайд 10По ходу действия от игроков чаще всего потребуется работать в команде,
Слайд 11В зависимости от сложности квеста выбираются временные рамки
Квест на 1 урок
Квест
Слайд 12Цель:
- вызвать интерес к предмету;
-развивать чувство самостоятельности, дисциплинированности, поиска;
Слайд 16ЗАДАНИЕ I «ЛАБИРИНТ»
____________посчитайте их количество и запишите цифру_____
ЗАДАНИЕ II
_____________________________
ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА»
С помощью полученных выделенных цифр и букв ориентируясь по координатам, по очереди соедини точки
С помощью полученных выделенных цифр и букв ориентируясь по координатам, по очереди соедини точки
Что это? запиши название, посчитай буквы в данном слове и запиши цифру________________
ЗАДАНИЕ I V «неожиданный взрыв» коэффициент перед восстановителем __________
Код – это полученная последовательность цифр____________
Журнал записей
Слайд 17 ЗАДАНИЕ I «ЛАБИРИНТ» Вам необходимо найти выход из лабиринта. Следуя по
Слайд 18
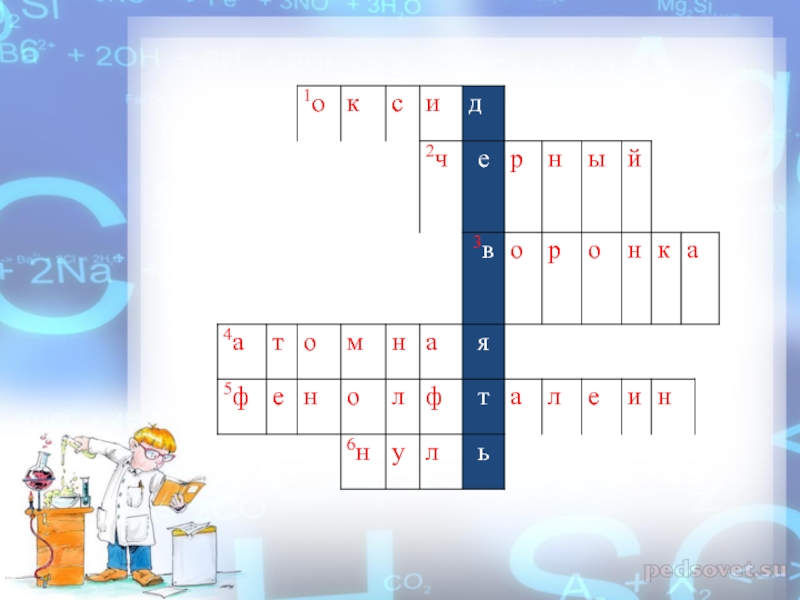
ЗАДАНИЕ I I «КРОССВОРД»
1)Бинарное соединение химического элемента с кислородом в
2)Цвет оксида меди ( II )?
3)Используется для переливания жидкостей и для фильтрования?
4)Тип кристаллической решетки алмаза?
5)Индикатор, который изменяет свой цвет в щелочной среде на малиновый?
7)Степень окисления у простых веществ?
Слайд 21Установите соответствие между двумя веществами, взятыми в виде водных растворов, и
Г) CuCl2 и CuSO4 1)Н2
Д) Nа 2СО 3 и Na2SiO3 2) FeCl2
Е) ВаCl2 и Zn(NO3)2 3) NaОН
4) O2
5) Ва(NO3)2
6) H2SO4 (р-р)
7) Cu
8) ВаCl2
9) НCl (р-р)
№ 2
Слайд 22Установите соответствие между двумя веществами, взятыми в виде водных растворов, и
Ж) Al2 (SO4) 3 и К 2SO4 1) Nа 3PO4
З) Ва(NO3)2 и ZnCl2 2) AgNO3
И) FeCl2 и CuCl2 3) Cu
Б) NaCl и Na2SO4 4) Fe
( ЗАПИШИТЕ ВЫДЕЛЕННЫЕ БУКВЫ И ЦИФРЫ В СВОЙ ЖУРНАЛ ЗАПИСЕЙ !!!)
Слайд 23ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА»
С помощью полученных выделенных цифр и
ВОРОНКА
Слайд 24ЗАДАНИЕ I V «неожиданный взрыв»
Студенту было дано задание изучить реакцию
Студент допустил грубейшую ошибку, не зная номенклатуры неорганических веществ. Соли хлорной кислоты носят название «перхлоратов», а не «хлоратов»
Хлорат (точнее триоксохлорат калия) КClO3 - сильный окислитель и в присутствии горючих веществ очень опасен в обращении. При растирании его с серой ( а тем более при нагреве) может произойти взрыв:
КClO3 + S = SO2 + KCl
Используя метод электронного баланса, составьте уравнение реакции (определите окислитель и восстановитель)
( ЗАПИШИТЕ коэффициент перед восстановителем В СВОЙ ЖУРНАЛ ЗАПИСЕЙ)
Слайд 25Соли хлорной кислоты « перхлораты» например КClO4 - это совсем другие
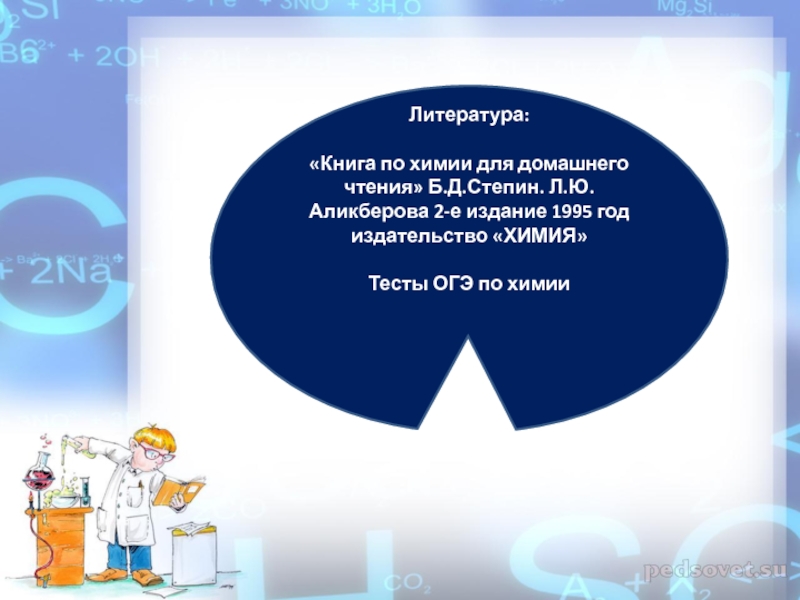
Слайд 28Литература:
«Книга по химии для домашнего чтения» Б.Д.Степин. Л.Ю. Аликберова 2-е издание
Тесты ОГЭ по химии