Углерод и кремний
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод и кремний презентация
Содержание
- 1. Углерод и кремний
- 2. Углерод и кремний являются химическими элементами IVA-группы
- 3. У углерода на внешнем энергетическом уровне 4
- 4. История открытия C В 1791 году английский
- 5. Происхождение названия C В начале XIX
- 6. Физические свойства простых веществ углерода и кремния.
- 7. Алмаз –бесцветное (иногда желтоватое, коричневатое, зеленое, черное,
- 8. Карбин –синтетическая модификация углерода. Черный мелкокристаллический порошок. Плотность 1,9–2 г/см3. Полупроводник.
- 9. Фуллерены представляют собой шарообразные молекулы, образованные пяти-
- 10. Кремний. Кристаллический кремний – вещество темно-серого
- 11. С Взаимодействие с неметаллами С + 2S
- 12. Si Взаимодействие с неметаллами Si + 2F2
- 13. Нахождение в природе В виде углекислого газа
- 14. Древесный уголь Кокс Природные неорганические
- 15. Кремний в природе Он широко распространен
- 16. Применение углерода Графит используется в карандашной промышленности.
- 17. Кремний находит применение в полупроводниковой технике и
Слайд 1Углерод обозначается символом C (лат. Carbonium). Кремний обозначается символом Si (лат. Silicium,
Слайд 2Углерод и кремний являются химическими элементами IVA-группы периодической системы. Находятся во
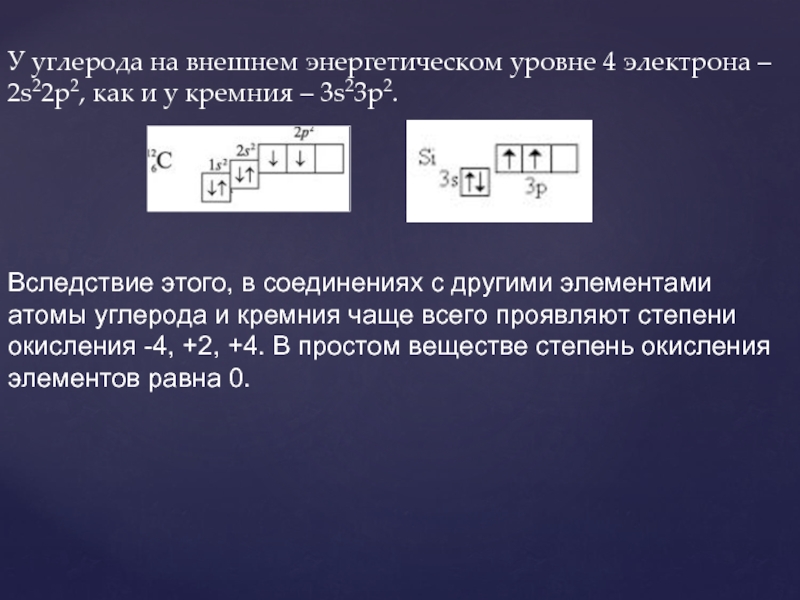
Слайд 3У углерода на внешнем энергетическом уровне 4 электрона – 2s22p2, как
Вследствие этого, в соединениях с другими элементами атомы углерода и кремния чаще всего проявляют степени окисления -4, +2, +4. В простом веществе степень окисления элементов равна 0.
Слайд 4История открытия
C
В 1791 году английский химик Теннант первым получил свободный углерод;
Si
В чистом виде он был впервые выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Слайд 5Происхождение названия
C
В начале XIX века в русской химической литературе иногда
Si
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. κρημνός — «утёс, гора».
Слайд 6Физические свойства простых веществ углерода и кремния.
Углерод существует во множестве аллотропных
Известны следующие аллотропные модификации углерода: графит, алмаз, карбин и фуллерены.
a) алмаз
b) графит
c) лонсдейлит
d) фуллерен — бакибол C60
e) фуллерен C540
f) фуллерен C70
g) аморфный углерод
h) углеродная нанотрубка
Слайд 7Алмаз –бесцветное (иногда желтоватое, коричневатое, зеленое, черное, синее, красноватое) прозрачное вещество,
Графит –наиболее распространенная форма.
Это очень мягкое черное вещество с металлическим блеском, хорошо проводит электрический ток и тепло. Жирный на ощупь, при трении расслаивается на отдельные чешуйки.
tплавл = 3750 °С (плавится при давлении 10 МПа, при обычном давлении возгоняется).
Плотность 2,22 г/см3.
Структура графита образована параллельными слоями сеток, состоящих из шестиугольников с атомами углерода в вершинах. Атомы в каждом отдельно взятом слое связаны достаточно прочно, а между слоями связь слабая.
Слайд 8Карбин –синтетическая модификация углерода. Черный мелкокристаллический порошок. Плотность 1,9–2 г/см3. Полупроводник.
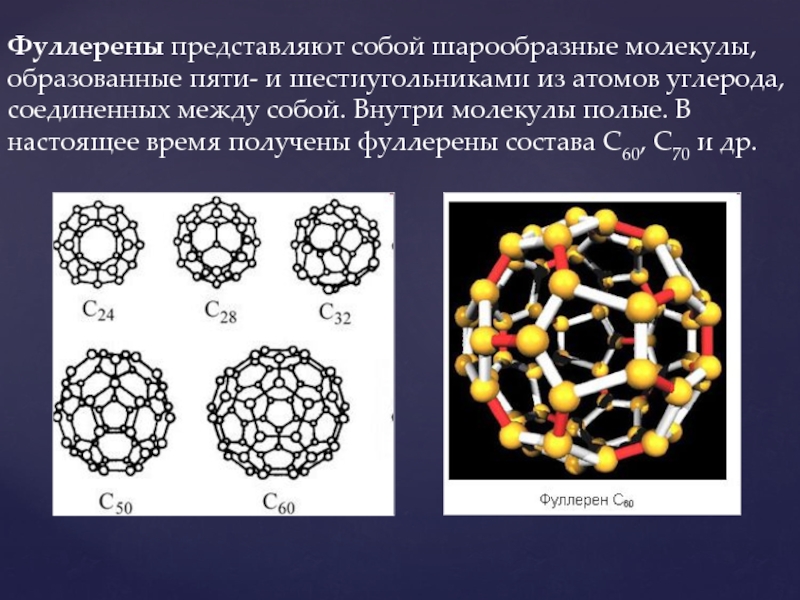
Слайд 9Фуллерены представляют собой шарообразные молекулы, образованные пяти- и шестиугольниками из атомов
Слайд 10Кремний. Кристаллический кремний – вещество темно-серого цвета с металлическим блеском, имеет
Слайд 11С
Взаимодействие с неметаллами
С + 2S = CS2. С + О2 =
не взаимодействует с азотом и фосфором.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
C + H2O = CO + H2.
Углерод способен восстанавливать многие металлы из их оксидов:
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
Химические свойства
Слайд 12Si
Взаимодействие с неметаллами
Si + 2F2 = SiF4. Si +
С водородом не взаимодействует.
Взаимодействие с галогеноводородами
Si + 4HF = SiF4 + 2H2,
Взаимодействие с металлами
2Ca + Si = Ca2Si.
Взаимодействие с кислотами
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O.
Взаимодействие со щелочами
Si + 2NaOH + H2O = Na2SiO3 + H2.
Слайд 13Нахождение в природе В виде углекислого газа углерод входит в состав атмосферы
Торф
Антрацит
Бурый уголь
Каменный уголь
Слайд 14Древесный уголь
Кокс
Природные неорганические соединения углерода – карбонаты. Минерал кальцит
Слайд 15 Кремний в природе
Он широко распространен в виде кремнезема SiO2 и
Например, гранит содержит более 60% кремнезема, а кристаллический кварц является самым чистым из природных соединений кремния с кислородом.
Гранит
Листья крапивы покрыты колючими волосками из чистого оксида кремния(IV), которые представляют собой полые трубочки длинной 1-2 мм. Трубочки заполнены жидкостью, содержащей муравьиную кислоту.
Слайд 16Применение углерода
Графит используется в карандашной промышленности. Также его используют в качестве
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем.
Стоматологические сверла
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот.
Карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов.
Слайд 17 Кремний находит применение в полупроводниковой технике и микроэлектронике, в металлургии в
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, применяемый в строительстве как сиккатив, а в пиротехнике и в быту для склеивания бумаги.
Применение кремния