- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома презентация
Содержание
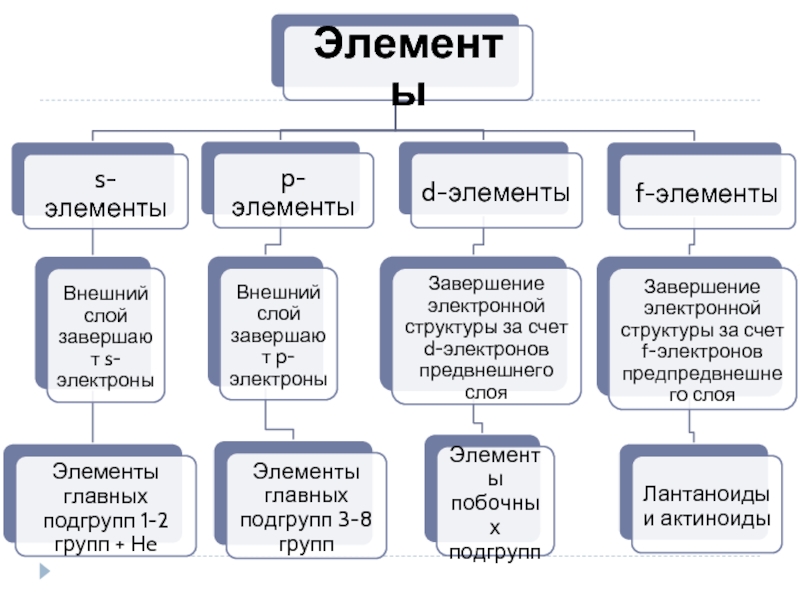
- 1. Строение атома
- 2. Электронная оболочка Электронная оболочка - область пространства
- 3. Электронная оболочка Электроны различаются своей энергией и
- 4. Электронный слой По мере удаления электрона от
- 5. Электронный слой Число заполняемых электронами слоев в
- 6. Распределение электронов по электронным уровням Н
- 7. Схема распределения электронов в атоме ₊₁H⁰)₁ ₊₂He⁰)₂
- 8. Внешние и валентные электроны Внешние
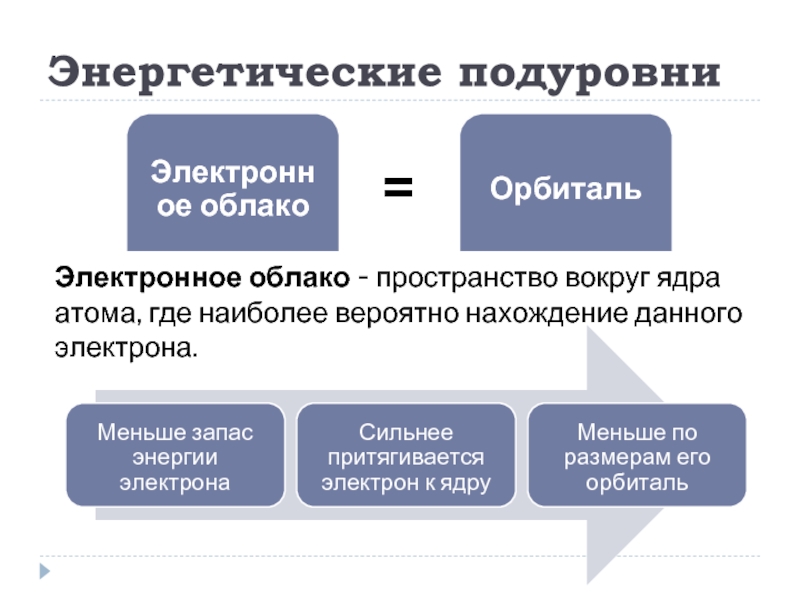
- 9. Энергетические подуровни Электронное облако - пространство вокруг
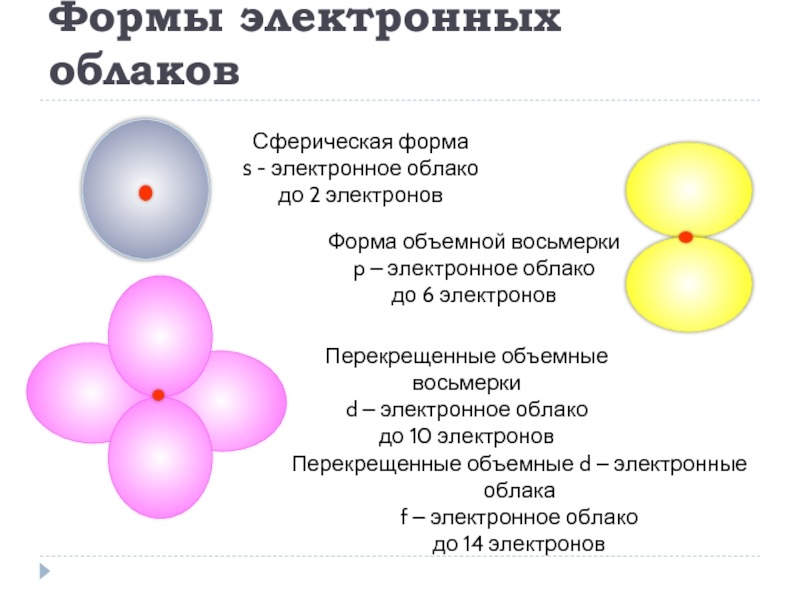
- 10. Формы электронных облаков Сферическая форма s -
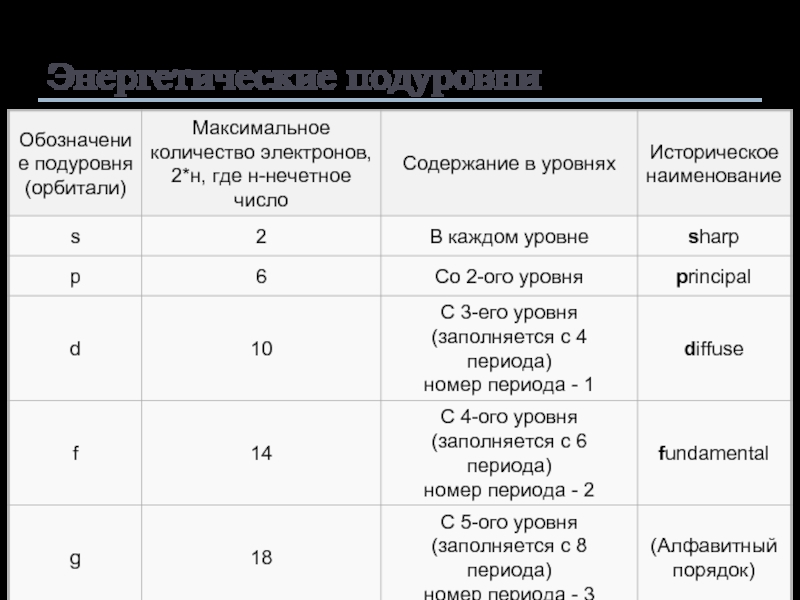
- 11. Энергетические подуровни
- 12. Принцип наименьшей энергии Электроны в атомах заполняют
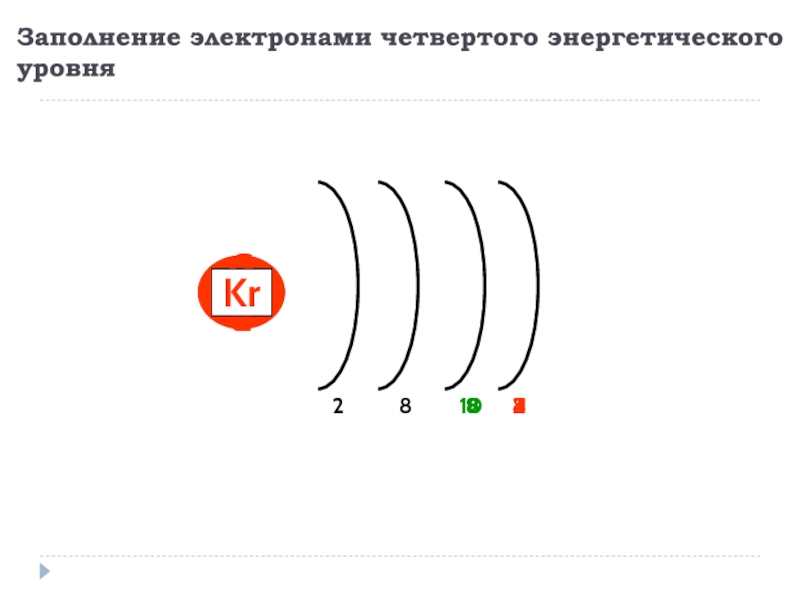
- 13. Заполнение электронами четвертого энергетического уровня
- 15. Электронная формула атома и ее графическое изображение
- 16. Элементы второго
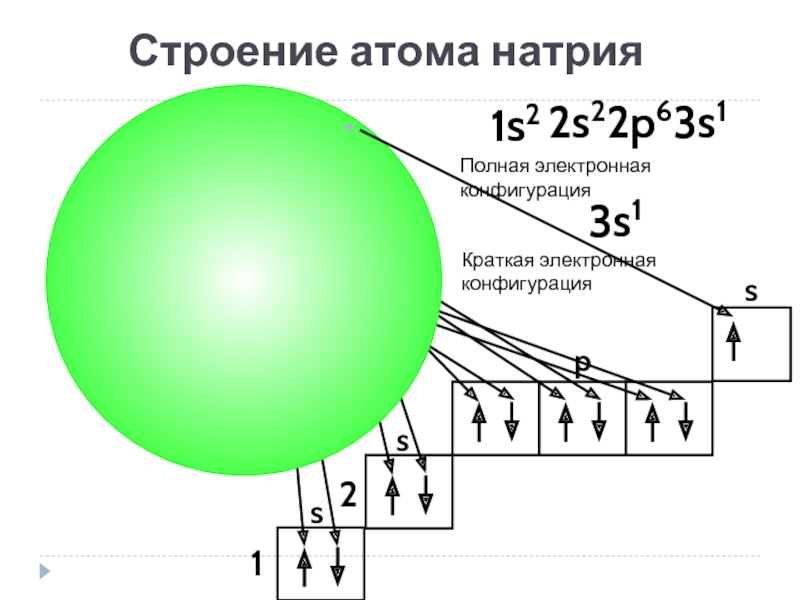
- 17. Na Строение атома натрия
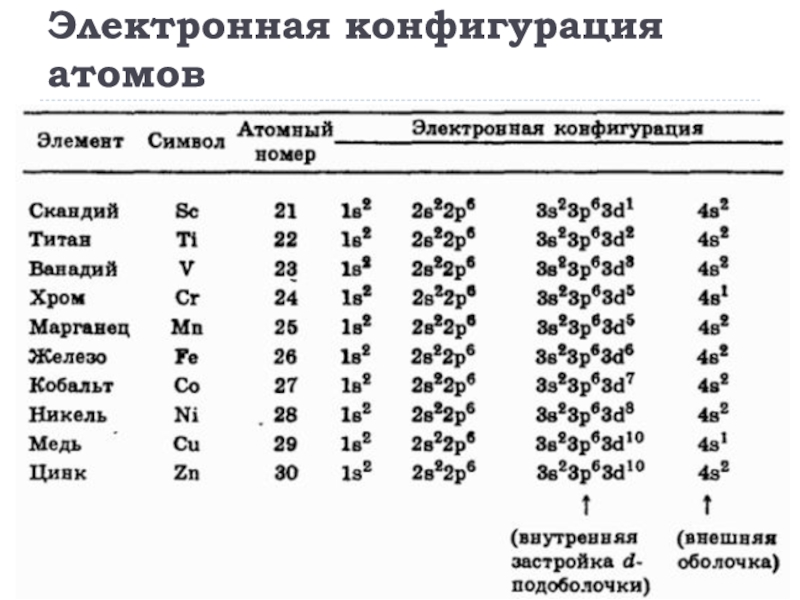
- 18. Электронная конфигурация атомов
- 19. Электронная конфигурация атомов
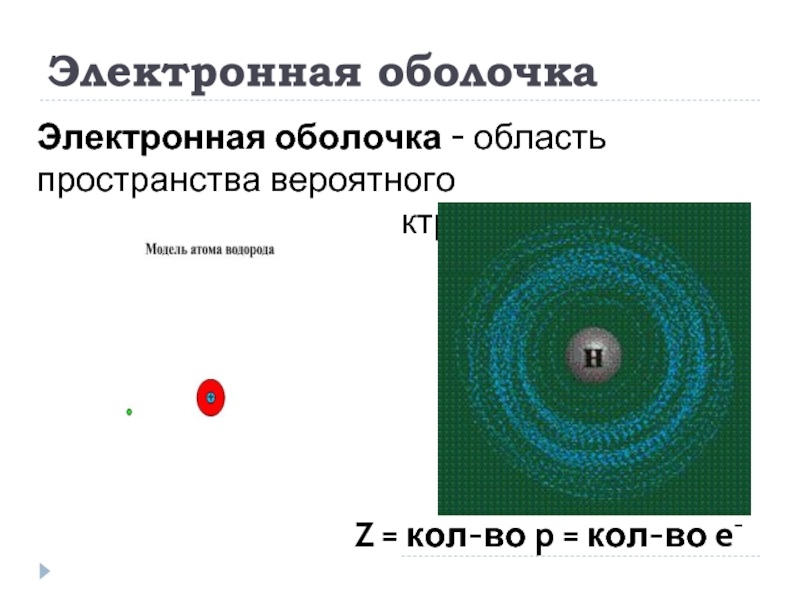
Слайд 2Электронная оболочка
Электронная оболочка - область пространства вероятного местонахождения электронов.
Z = кол-во
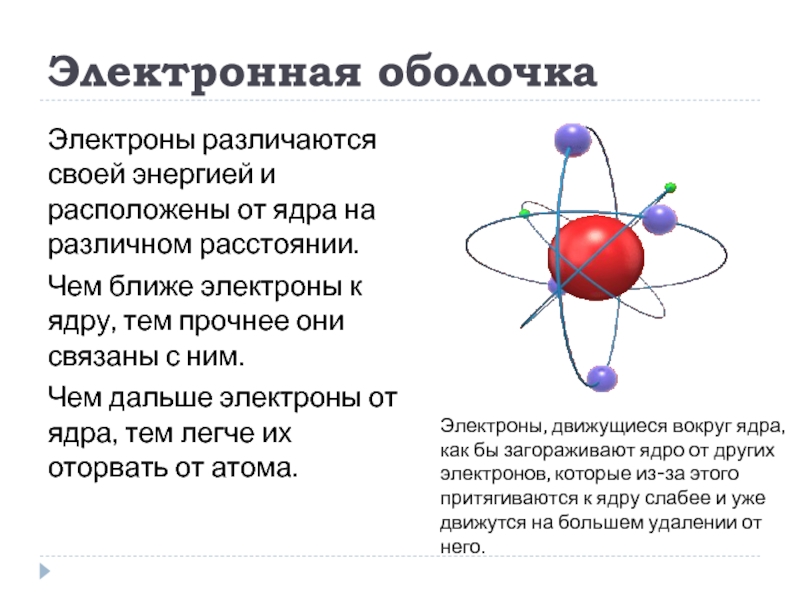
Слайд 3Электронная оболочка
Электроны различаются своей энергией и расположены от ядра на различном
Чем ближе электроны к ядру, тем прочнее они связаны с ним.
Чем дальше электроны от ядра, тем легче их оторвать от атома.
Электроны, движущиеся вокруг ядра, как бы загораживают ядро от других электронов, которые из-за этого притягиваются к ядру слабее и уже движутся на большем удалении от него.
Слайд 4Электронный слой
По мере удаления электрона от ядра атома запас энергии электрона
Электронный слой - это совокупность электронов, находящихся на одном энергетическом уровне.
электронный слой = энергетический уровень
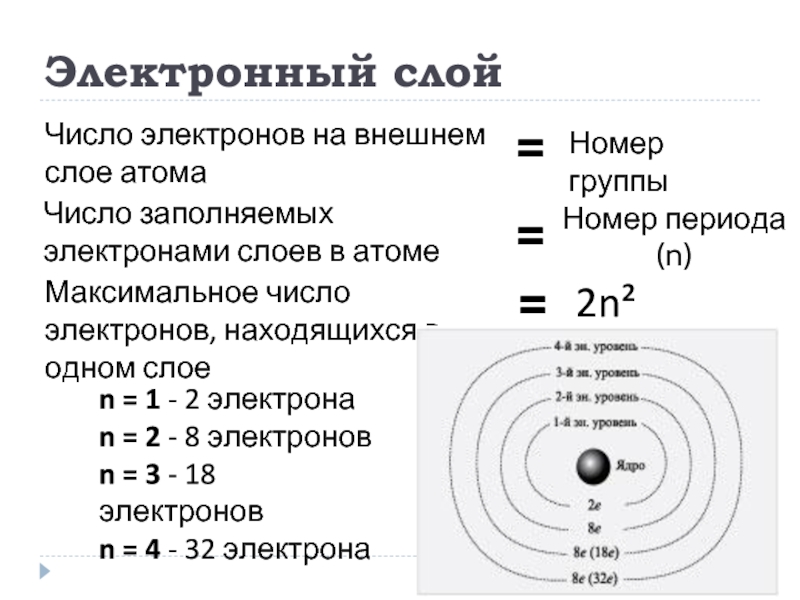
Слайд 5Электронный слой
Число заполняемых электронами слоев в атоме
Номер периода (n)
=
Максимальное число электронов,
=
2n²
n = 1 - 2 электрона
n = 2 - 8 электронов
n = 3 - 18 электронов
n = 4 - 32 электрона
Число электронов на внешнем слое атома
=
Номер группы
Слайд 6Распределение электронов по электронным уровням
Н
+ 1
Не
+ 2
Li
+ 3
+ 4
Be
B
+ 5
C
+ 6
N
+
O
+ 8
F
+ 9
Ne
+ 10
Naa
+ 11
Слайд 7Схема распределения электронов в атоме
₊₁H⁰)₁
₊₂He⁰)₂
₊₃Li⁰)₂)₁
₊₄Be⁰)₂)₂
₊₅B⁰)₂)₃
₊₆C⁰)₂)₄
₊₇N⁰)₂)₅
₊₈O⁰)₂)₆
₊₉F⁰)₂)₇
₊₁₀Ne⁰)₂)₈
₊₁₁Na⁰)₂)₈)₁
₊₁₂Mg⁰)₂)₈)₂
…
₊₁₇Cl⁰)₂)₈)₇
₊₁₈Ar⁰)₂)₈)₈
Слайд 8Внешние и валентные электроны
Внешние электроны принимают участие в образовании
Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни.
НЕ ПУТАТЬ
Слайд 9Энергетические подуровни
Электронное облако - пространство вокруг ядра атома, где наиболее вероятно
=
Слайд 10Формы электронных облаков
Сферическая форма
s - электронное облако
до 2 электронов
Форма объемной восьмерки
p – электронное облако
до 6 электронов
Перекрещенные объемные восьмерки
d – электронное облако
до 10 электронов
Перекрещенные объемные d – электронные облака
f – электронное облако
до 14 электронов
Слайд 12Принцип наименьшей энергии
Электроны в атомах заполняют уровни и подуровни в порядке
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
Номер электронного слоя
=
номер периода
Электронный подуровень
=
форма электронного облака
Число электронов в подуровне
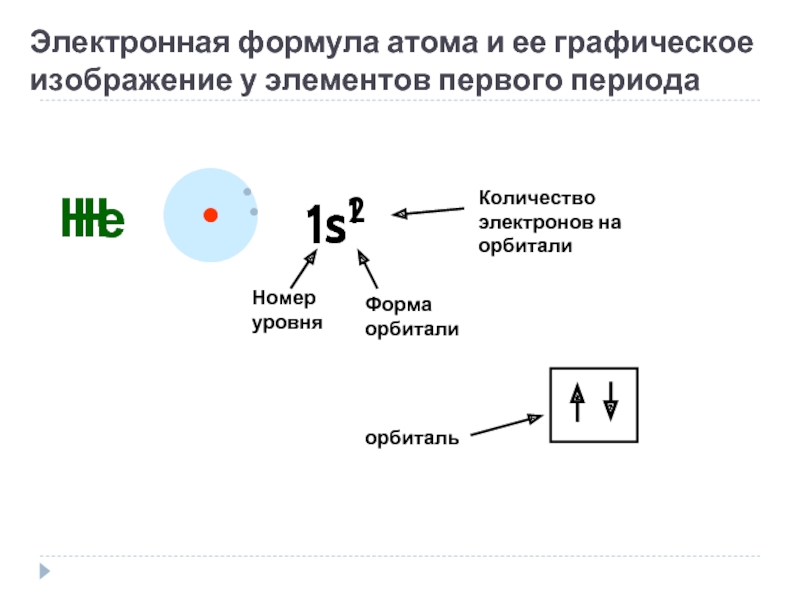
Слайд 15Электронная формула атома и ее графическое изображение у элементов первого периода
Н
1s1
Номер
Форма орбитали
Количество электронов на орбитали
Не
1s2
орбиталь
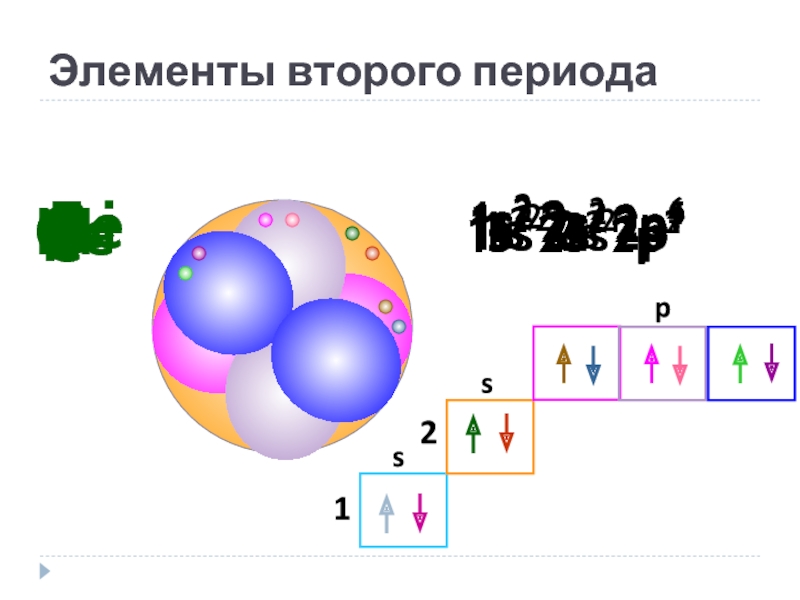
Слайд 16
Элементы второго периода
Li
1s2 2s1
Be
1s2 2s2
B
1s2 2s2 2p1
C
1s2 2s2 2p2
N
1s2 2s2 2p3
O
1s2
F
1s2 2s2 2p5
Ne
1s2 2s2 2p6
1
s
p
s
2