Полтава 2016
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Титрування. Хімічний посуд в титриметричному аналізі презентация
Содержание
- 1. Титрування. Хімічний посуд в титриметричному аналізі
- 2. ПЛАН
- 3. ОСНОВНІ ПОНЯТТЯ І ЇХ СУТЬ: Титриметричний метод
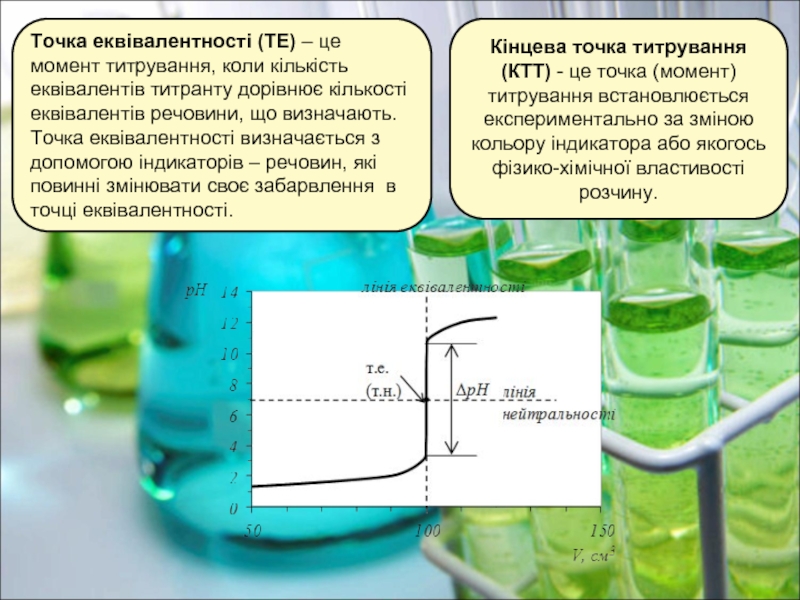
- 4. Точка еквівалентності (ТЕ) – це момент титрування, коли
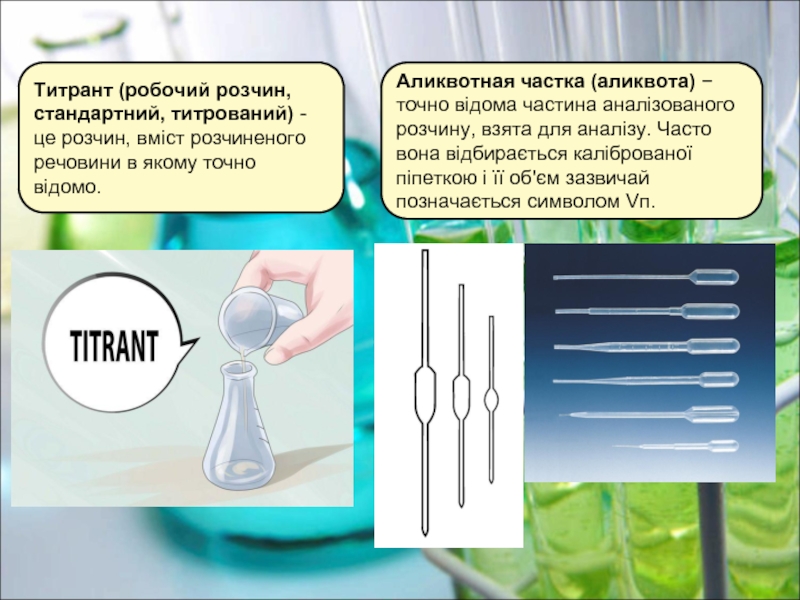
- 5. Титрант (робочий розчин, стандартний, титрований) - це
- 6. ХІМІЧНИЙ ПОСУД В ТИТРИМЕТРИЧНОМУ АНАЛІЗІ Виконання
- 7. З’єднання бюретки з бутлями із стандартними розчинами
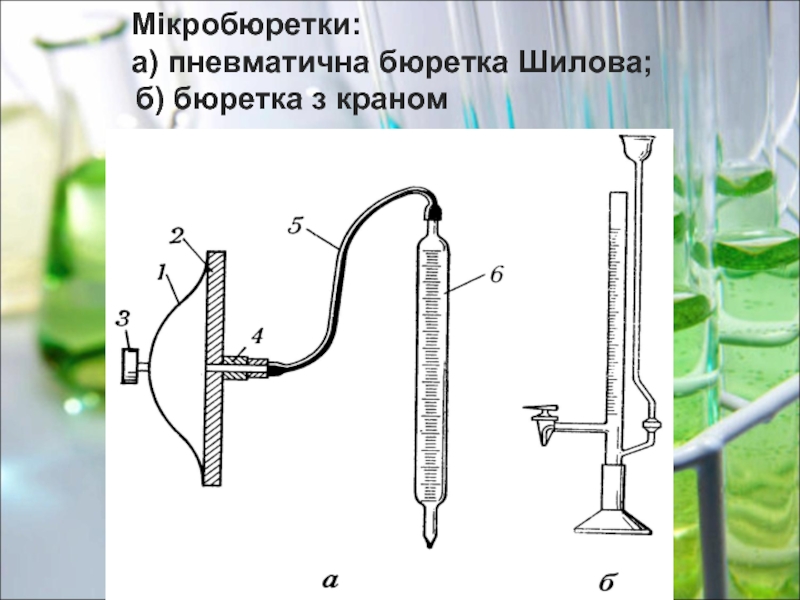
- 8. Мікробюретки: а) пневматична бюретка Шилова; б) бюретка з краном
- 9. СПОСОБИ ПРИГОТУВАННЯ ТИТРОВАНИХ РОЗЧИНІВ За первинним стандартом За вторинним стандартом
- 10. ПЕРВИННИЙ СТАНДАРТНИЙ РОЗЧИН Знаючи
- 11. ВТОРИННИЙ СТАНДАРТ АБО РОЗЧИН ІЗ ВСТАНОВЛЕНИМ ТИТРОМ
- 12. КЛАСИФІКАЦІЯ МЕТОДІВ ТИТРИМЕТРИЧНОГО АНАЛІЗУ Залежно від типу
- 13. ПРАВИЛА ПРИ ПРИГОТУВАННІ ТИТРОВАНИХ РОЗЧИНІВ І ВИЗНАЧЕННІ
- 14. РОЗРАХУНКИ В ТИТРИМЕТРІЇ В
- 15. Еквівалент елемента простої чи складної
- 16. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЙ РОЗЧИНІВ Молярна концентрація речовини у розчині С — це відношення кількості розчиненої речовини в молях, що міститься у розчині, до об'єму цього розчину. Молярна
- 17. ДЯКУЮ ЗА УВАГУ!
Слайд 1РЕФЕРАТ
НА ТЕМУ
“ТИТРУВАННЯ. ХІМІЧНИЙ ПОСУД В ТИТРИМЕТРИЧНОМУ АНАЛІЗІ”
ВИЩИЙ ДЕРЖАВНИЙ НАВЧАЛЬНИЙ ЗАКЛАД “УМСА”
Слайд 2
ПЛАН
Хімічний посуд в титриметричному аналізі. Способи приготування титрованих розчинів.
Класифікація методів титреметричного аналізу. Розрахунки в титриметрії.
Слайд 3ОСНОВНІ ПОНЯТТЯ І ЇХ СУТЬ:
Титриметричний метод аналізу – метод кількісного аналізу,
Титрування - повільне збільшення (невеликими порціями) титрованного (стандартного, титранта, робочого) розчину до аналізованому розчину до досягнення точки еквівалентності - кінця реакції.
Слайд 4Точка еквівалентності (ТЕ) – це момент титрування, коли кількість еквівалентів титранту дорівнює кількості еквівалентів
Кінцева точка титрування (КТТ) - це точка (момент) титрування встановлюється експериментально за зміною кольору індикатора або якогось фізико-хімічної властивості розчину.
Слайд 5Титрант (робочий розчин, стандартний, титрований) - це розчин, вміст розчиненого речовини
Аликвотная частка (аликвота) − точно відома частина аналізованого розчину, взята для аналізу. Часто вона відбирається каліброваної піпеткою і її об'єм зазвичай позначається символом Vп.
Слайд 6ХІМІЧНИЙ ПОСУД В ТИТРИМЕТРИЧНОМУ АНАЛІЗІ
Виконання титриметричного аналізу передбачає застосування спеціального мірного
Слайд 10
ПЕРВИННИЙ СТАНДАРТНИЙ РОЗЧИН
Знаючи масу (m) розчиненої у воді хімічно
Слайд 11ВТОРИННИЙ СТАНДАРТ АБО РОЗЧИН ІЗ ВСТАНОВЛЕНИМ ТИТРОМ
Готується розчин приблизно
Слайд 12КЛАСИФІКАЦІЯ МЕТОДІВ ТИТРИМЕТРИЧНОГО АНАЛІЗУ
Залежно від типу реакції між титрантом і визначаємою речовиною методи титриметричного аналізу поділяють на:
Метод
Метод комплексоутворення. В основі методу лежать реакції утворення комплексних сполук.
Метод окисно-відновного титрування (редоксметрія).
В основі методу лежать окисно-відновні реакції.
Метод осадження.
В основі методу лежать реакції утворення осадів.
Слайд 13ПРАВИЛА ПРИ ПРИГОТУВАННІ ТИТРОВАНИХ РОЗЧИНІВ І ВИЗНАЧЕННІ ЇХ ТИТРІВ.
Вихідна речовина повинна легко і швидко реагувати з титрованими речовинами.
Розчин вихідної речовини повинен зберігатися довший час без змін.
Реакції, які проходять між вихідною і визначуваною речовиною, повинні проводитись по можливості методами прямого титрування.
Процес титрування повинен закінчуватися швидко і чітко. Кінцева точка титрування повинна визначатися легко і точно.
Встановлювати титри бажано або методом окремих наважок або розчиненням наважки вихідної речовини у певному об’ємі.
Слайд 14 РОЗРАХУНКИ В ТИТРИМЕТРІЇ
В основі усіх розрахунків у титриметричному аналізі лежить закон
Хімічні елементи і речовини реагують між собою у масових кількостях, пропорційних їхнім еквівалентам.
Слайд 15 Еквівалент елемента простої чи складної речовини – це така
Масу одного еквівалента елемента або речовини називають молярною масою еквівалента або еквівалентною масою (одиниці вимірювання г/моль)
Еквівалентну масу оксиду розраховують за формулою:
солі:
кислоти: основи: