Санкт-Петербург
2017 г.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы химических связей презентация
Содержание
- 1. Типы химических связей
- 2. Задачи: познакомиться с типами химических связей ;
- 3. Что такое химическая связь?
- 4. Различают четыре типа химических связей: Ионная связь.
- 5. Ионная связь это связь, образовавшаяся за счёт
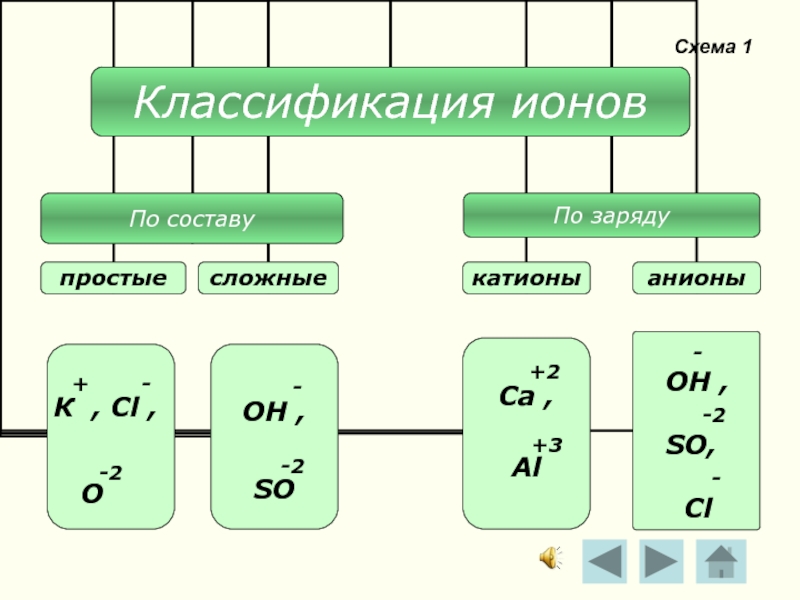
- 6. Схема 1 - ОН ,
- 7. Механизм образования ионной
- 8. Ковалентная связь это связь, возникает между атомами
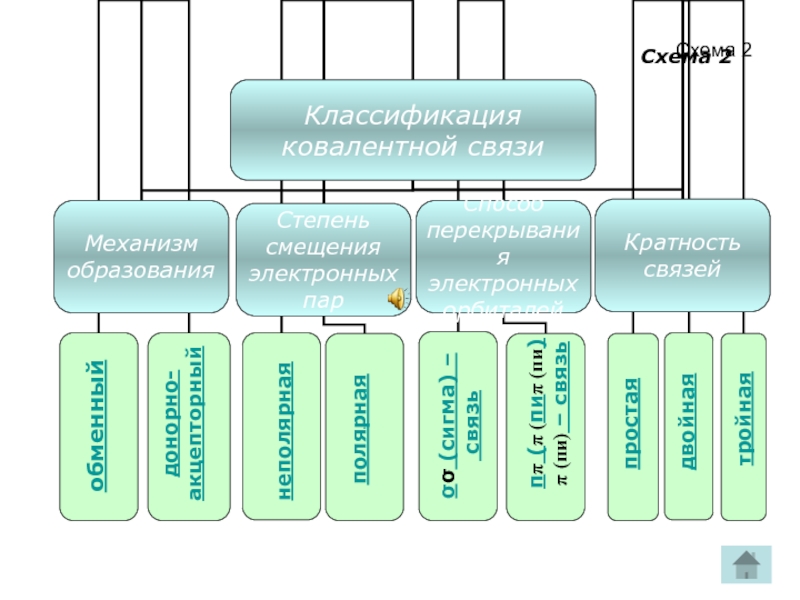
- 9. Схема 2 обменный донорно- акцепторный полярная
- 10. Обменный механизм образования ковалентной связи ☼
- 11. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
- 12. Кратность ковалентной связи ☼Зависит от числа общих
- 13. Металлическая связь это связь, которую осуществляют относительно
- 14. Механизм образования металлической связи:
- 15. Водородная связь Межмолекулярная водородная связь – это
- 16. Водородная связь Внутримолекулярная водородная связь –
- 17. Выполните упражнение №1 Из предложенного списка распределите
- 18. Выполните упражнение №2 Как меняется полярность связи в ряду: HCl – H2Se – AsH3
- 19. Выполните упражнение №3 Покажите образование ионной связи
- 20. Выполните упражнение №4 Покажите образование ковалентных связей
- 21. Источники: Литература: Учебник для общеобразовательных
Слайд 1Типы химических связей
Презентацию составил преподаватель по химии
Зинатулина Маргарита Римовна
Санкт-Петербургское государственное бюджетное
Слайд 2Задачи:
познакомиться с типами химических связей ;
научиться определять по молекулярной формуле соединения
научиться составлять механизм образования химической связи.
Слайд 3Что такое
химическая связь?
Это взаимодействие
атомов, которое связывает
их
радикалы, кристаллы.
Слайд 4Различают четыре типа химических связей:
Ионная связь.
Ковалентная связь.
Металлическая связь.
Водородная связь.
Рис.1
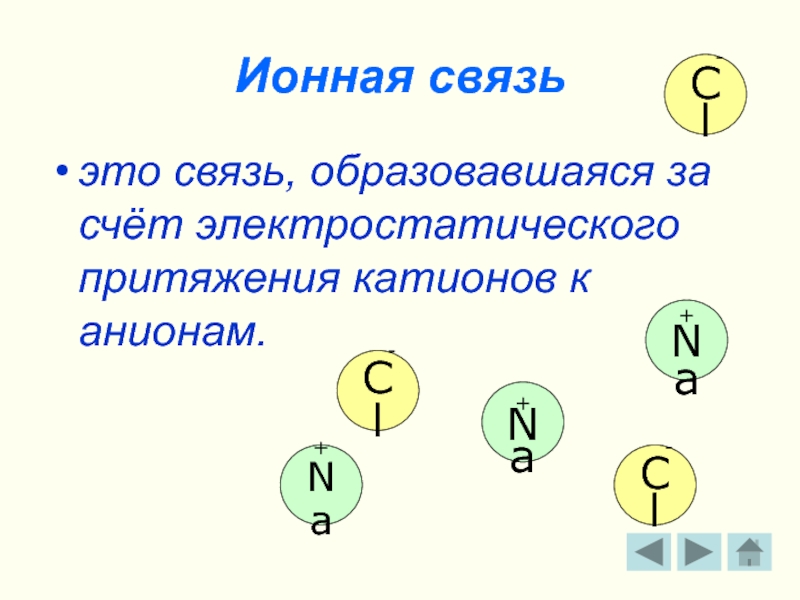
Слайд 5Ионная связь
это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
+
Na
-
Cl
+
Na
-
Cl
+
Na
-
Cl
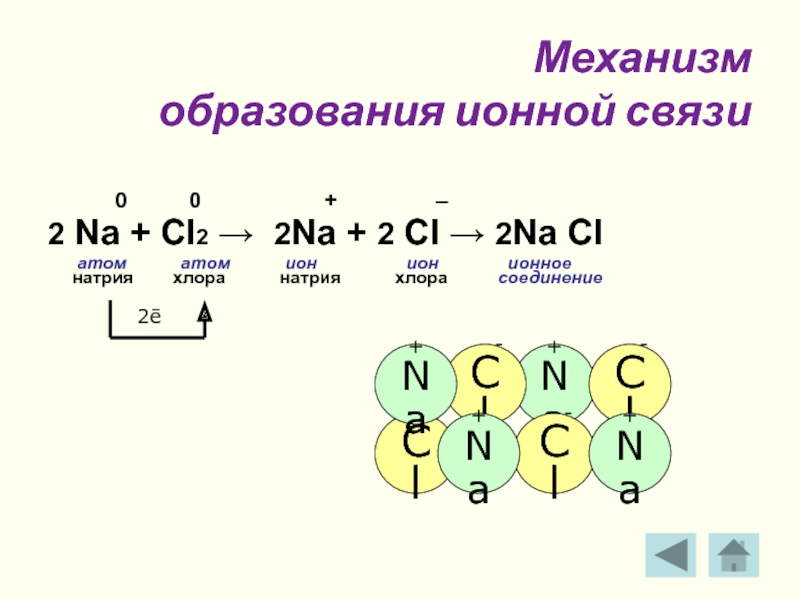
Слайд 7 Механизм
образования ионной связи
0 0 + –
2 Na + Cl2 → 2Na + 2 Cl → 2Na Cl
атом атом ион ион ионное
натрия хлора натрия хлора соединение
2ē
+
Na
-
Cl
-
Cl
-
Cl
-
Cl
+
Na
+
Na
+
Na
Слайд 8Ковалентная связь
это связь, возникает между атомами за счёт образования общих электронных
ē
ē
ē
ē
ē
ē
Слайд 9Схема 2
обменный
донорно-
акцепторный
полярная
неполярная
σσ (сигма) –
связь
ππ (π (пиπ (пи)π (пи) – связь
простая
двойная
тройная
Схема
Слайд 10Обменный механизм образования ковалентной связи
☼ Действует, когда атомы образуют общие
Например:
Н2 – водород Н• + •Н → Н ׃ Н или Н - Н ;
НCl – хлороводород или соляная кислота
Н• + • Cl → Н Cl или H – Cl ;
3. N2 – азот N • + • N → N N или N N.
••
••
••
••
••
••
••
••
••
•••
•
•
•
•
•••
••
••
Слайд 11Степень смещения электронных пар
☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов.
Ряд электроотрицательности: F, O,
НЕПОЛЯРНАЯ ковалентная связь – это связь, образованная
между атомами с одинаковой электроотрицательностью.
Например : H – H; Cl – Cl; N N.
ПОЛЯРНАЯ ковалентная связь – это связь, образованная между
атомами с разной электроотрицательностью.
Например: H – Cl; H – S – H.
ІІІ
Слайд 12Кратность ковалентной связи
☼Зависит от числа общих электронных пар, связывающих атомы.
Бывает:
ПРОСТАЯ
ДВОЙНАЯ « » - это одна σ-связь и одна
π-связь;
3. ТРОЙНАЯ « » - это одна σ-связь и две
π- связи.
ІІ
ІІІ
Слайд 13Металлическая связь
это связь, которую осуществляют относительно свободные электроны между ионами металлов
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
-
-
-
-
-
-
-
-
-
-
Слайд 14Механизм
образования металлической связи:
М - nē = М
Например:
для элементов (металлов) Ι группы главной
0 1+
подгруппы М - 1ē = М ;
для элементов (металлов) Ι Ι группы главной
0 2+
подгруппы М - 2ē = М .
Слайд 15Водородная связь
Межмолекулярная водородная связь – это
связь между атомами водорода одной
молекулы и
элементами(O, N, F) другой молекулы.
Н О - - - - Н О Н Н
Н Н - - - - О Н - - - - О Н
|
|
|
|
|
|
|
|
Слайд 16Водородная связь
Внутримолекулярная водородная связь –
эта связь возможна при наличии в
молекуле и электроноакцепторной
группы и электронодонорного атома.
Например в молекуле
ДНК: І І
А-Т
Г-Ц
Г-Ц
Т-А
І І
Рис.4
Слайд 17Выполните упражнение №1
Из предложенного списка распределите формулы веществ
в таблице по соответствующим
PCl 5, CH 4 , Fe, O2, P2O5, HF, CsF, Cu2O, KCl, N2, P4, FeO
Слайд 20Выполните упражнение №4
Покажите образование
ковалентных связей и укажите
их тип в соединениях:
PCl
Слайд 21Источники:
Литература: Учебник для общеобразовательных
Лысова Г. Г. М.: 2-е изд. Дрофа, 2002
2. Рисунки:
Рис.1 «Атом» - http://office.microsoft.com/ru-ru/clipart/results.aspx?qu=%D0%B0%D1%82%D0%BE%D0%BC%D1%8B&sc=20
Рис.2,3«σ- и π- связи» - http://www.chemistry.ssu.samara.ru/chem1/index1.htm
Рис.4«ДНК» - http://office.microsoft.com/ru-ru/clipart/results.aspx?qu=%D0%94%D0%9D%D0%9A&sc=20&AxInstalled=copy&DownloadAssetId=MCj01494830000&DownloadExtension=wmf&c=0