следствия.
Основные понятия термохимии.
Закон Гесса и его следствия.
Зависимость теплоты процесса от температуры, уравнение Кирхгоффа.
Лектор: доцент кафедры химии
Григорьева Марина Викторовна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термохимия. Закон Гесса и его следствия презентация
Содержание
- 1. Термохимия. Закон Гесса и его следствия
- 2. 1. Основные понятия термохимии Термохимия
- 3. 1. Основные понятия термохимии Химическая
- 4. 1. Основные понятия термохимии
- 5. 1. Основные понятия термохимии Для
- 6. 1. Основные понятия термохимии Фазовый
- 7. 1. Основные понятия термохимии
- 8. 1. Основные понятия термохимии Термохимия
- 9. 1. Основные понятия термохимии Тепловой
- 10. 1. Основные понятия термохимии Термохимическое
- 11. 1. Основные понятия термохимии Тепловой
- 12. 1. Основные понятия термохимии Стандартный
- 13. 1. Основные понятия термохимии К основным способам
- 14. 1. Основные понятия термохимии 2. Теплоту сгорания
- 15. 1. Основные понятия термохимии 3. Теплоту нейтрализации
- 16. 1. Основные понятия термохимии 4. Теплоту фазовых
- 17. 1. Основные понятия термохимии 5. Теплоту растворения.
- 18. 1. Основные понятия термохимии Предельная интегральная теплота
- 19. 1. Основные понятия термохимии
- 20. 1. Основные понятия термохимии 6. Энергия связи
- 21. 2. Закон Гесса и его следствия
- 22. 2. Закон Гесса и его следствия Закон
- 23. 2. Закон Гесса и его следствия 1-е
- 24. 2. Закон Гесса и его следствия 2
- 25. 2. Закон Гесса и его следствия
- 26. 2. Закон Гесса и его следствия 3
- 27. 2. Закон Гесса и его следствия 4
- 28. 2. Закон Гесса и его следствия 5
- 29. 3. Зависимость теплоты процесса от темп. З-н
- 30. 3. Зависимость теплоты процесса от темп. З-н
- 31. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа
- 32. 3. Зависимость теплоты процесса от темп. З-н
- 33. 3. Зависимость теплоты процесса от темп. З-н
- 34. 3. Зависимость теплоты процесса от темп. З-н
- 35. 3. Зависимость теплоты процесса от темп. З-н
- 36. 3. Зависимость теплоты процесса от темп. З-н
- 37. 3. Зависимость теплоты процесса от темп. З-н
- 38. 3. Зависимость теплоты процесса от темп. З-н
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 2. Термохимия. Закон Гесса и его
Слайд 21. Основные понятия термохимии
Термохимия - раздел физической химии изучающий
тепловые эффекты, сопровождающие химические и физико-химические процессы (химические реакции, фазовые переходы, образование и разбавление растворов, диссоциация молекул простых газообразных веществ на отдельные атомы, диссоциация ионных кристаллов на газообразные ионы, ионизация атомов в результате отрыва или присоединения к ним электронов.).
Слайд 31. Основные понятия термохимии
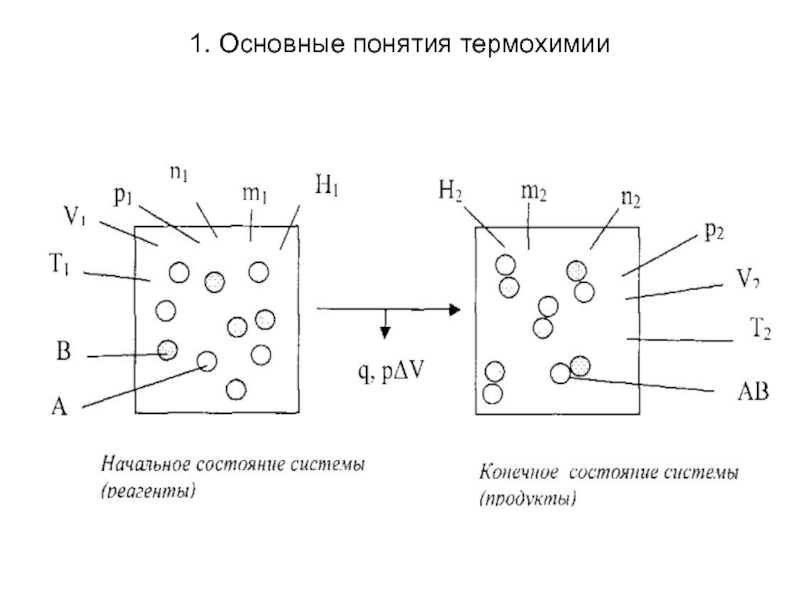
Химическая реакция как термодинамический процесс, заключается
в превращении одних веществ в другие, за счет изменения состава и (или) строения. Пусть в системе протекает реакция А +В = АВ, тогда химическую реакцию как термодинамический процесс можно представить следующим образом:
Слайд 51. Основные понятия термохимии
Для физико-химических процессов действует закон сохранения
массы, установленный М.В. Ломоносовым (m1 = m2).
Химические реакции могут быть как экзотермическими, если система выделяет теплоту во внешнюю среду, так и эндотермическими, если система поглощает теплоту из среды.
Химические реакции могут быть как экзотермическими, если система выделяет теплоту во внешнюю среду, так и эндотермическими, если система поглощает теплоту из среды.
Слайд 61. Основные понятия термохимии
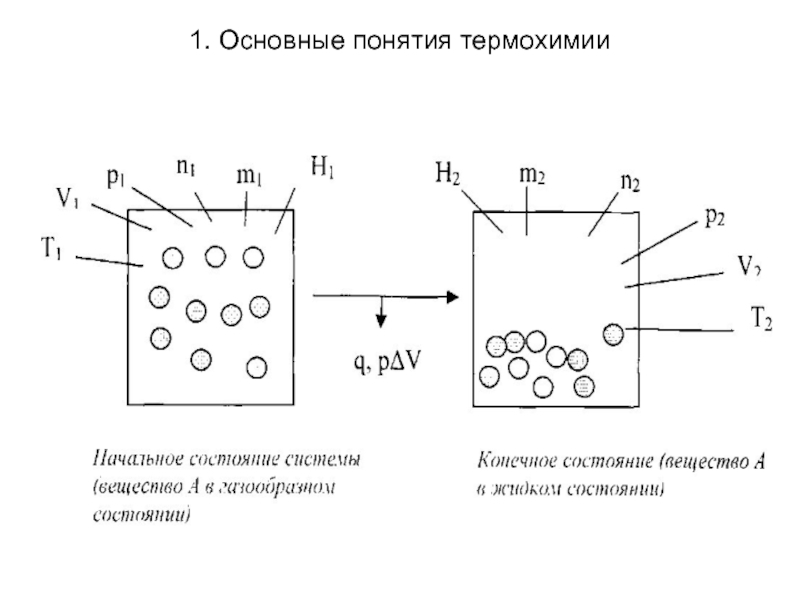
Фазовый переход - переход вещества из
одной фазы в другую, связанный с качественными изменениями свойств вещества. Примерами фазовых переходов является изменение агрегатного состояния вещества, переход кристаллического вещества из одной модификации в другую.
Фазовые переходы также могут быть как экзо-, так и эндотермическими.
Пусть вещество А переходит из газообразного состояния в жидкое, то фазовый переход можно с точки зрения термодинамики представить следующим образом:
Пусть вещество А переходит из газообразного состояния в жидкое, то фазовый переход можно с точки зрения термодинамики представить следующим образом:
Слайд 81. Основные понятия термохимии
Термохимия рассматривает процессы превращения частиц вещества:
диссоциацию молекул простых газообразных веществ на отдельные атомы, диссоциацию ионных кристаллов на газообразные ионы, ионизацию атомов в результате отрыва или присоединения к ним электронов.
Слайд 91. Основные понятия термохимии
Тепловой эффект этих процессов позволяет определить
важнейшие физические величины, характеризующие свойства вещества: энергию связи (мера прочности молекулы), энергию ионизации и сродство к электрону (мера окислительной и восстановительной способности простых веществ), энергию кристаллической решетки (мера прочности кристаллической решетки).
Слайд 101. Основные понятия термохимии
Термохимическое уравнение - условное изображение физико-химического
процесса, в котором помимо формул и агрегатных состояний вещества, указывается тепловой эффект:
химическая реакция: А(г) +В(кр) —> С(ж) - Q или А(г) +В(кр) —> С(ж); ΔН
фазовый переход: А(г) —> А(ж) +Q или
А(г) —>А(ж); -ΔН
растворение вещества:
А(тв) —> A(р) +Q или А(тв) —> А(p) ; -ΔН
химическая реакция: А(г) +В(кр) —> С(ж) - Q или А(г) +В(кр) —> С(ж); ΔН
фазовый переход: А(г) —> А(ж) +Q или
А(г) —>А(ж); -ΔН
растворение вещества:
А(тв) —> A(р) +Q или А(тв) —> А(p) ; -ΔН
Слайд 111. Основные понятия термохимии
Тепловой эффект (Q, kДж/моль) - энергия,
которая выделяется или поглощается в форме теплоты, при необратимом протекании физико-химического процесса при условии: Т, р = const или р, V = const, система совершает только работу расширения (А' = 0 ).
Если процесс проводится в автоклаве: V=const тепловой эффект равен внутренней энергии Qv = - ΔU.
Eсли процесс проводится в открытой системе (что наиболее часто) при р = const тепловой эффект равен энтальпии: Qp = - ΔН.
Если процесс проводится в автоклаве: V=const тепловой эффект равен внутренней энергии Qv = - ΔU.
Eсли процесс проводится в открытой системе (что наиболее часто) при р = const тепловой эффект равен энтальпии: Qp = - ΔН.
Слайд 121. Основные понятия термохимии
Стандартный тепловой эффект - теплота физико-химического
процесса, протекающего в стандартных условиях: Т=298К, р=101,3 кПа. При этом твердые и жидкие вещества находятся в устойчивой модификации, газы близки к состоянию идеального газа. Стандартные тепловые эффекты экспериментально определены и приводятся в специальных справочниках.
Слайд 131. Основные понятия термохимии
К основным способам выражения тепловых эффектов физико-химических процессов
относят:
Теплоту образования ΔНобр - тепловой эффект химической реакции образования 1 моль соединения из простых веществ. Из определения энтальпии следует, что энтальпия образования простых веществ (элементов) равна нулю. Теплоты образования веществ обычно составляют порядка 80-800 кДж/моль.
Теплоту образования ΔНобр - тепловой эффект химической реакции образования 1 моль соединения из простых веществ. Из определения энтальпии следует, что энтальпия образования простых веществ (элементов) равна нулю. Теплоты образования веществ обычно составляют порядка 80-800 кДж/моль.
Слайд 141. Основные понятия термохимии
2. Теплоту сгорания ΔНсгор - тепловой эффект химической
реакции окисления 1 моль соединения кислородом с образованием высших оксидов или соединений этих оксидов;
Слайд 151. Основные понятия термохимии
3. Теплоту нейтрализации ΔНнейт - тепловой эффект взаимодействия
1 эквивалента кислоты и щелочи. Она складывается из теплоты диссоциации и собственно нейтрализации. Опыт показывает, что при нейтрализации достаточно разбавленных водных растворов сильных кислот щелочами, независимо от природы наблюдается один и тот же тепловой эффект: ΔН°нейт = - 56 кДж/моль Если в реакцию вступает слабая кислота или слабое основание, то теплота нейтрализации будет меньше, так как диссоциация кислоты (основания) потребует затрат энергии;
Слайд 161. Основные понятия термохимии
4. Теплоту фазовых переходов ΔН°ф.п. - тепловой эффект
перехода 1 моль вещества из одной фазы в другую. Принята следующая форма записи этих величин: ΔsН°, ΔvН°, ΔmН°. Буквы s, v и т являются первыми буквами английских слов sublimation — «сублимация (возгонка)», vaporization — «испарение» и melting — «плавление». Теплоты парообразования имеют значения порядка 40 кДж/моль, теплоты плавления - порядка 4-20 кДж/моль ;
Слайд 171. Основные понятия термохимии
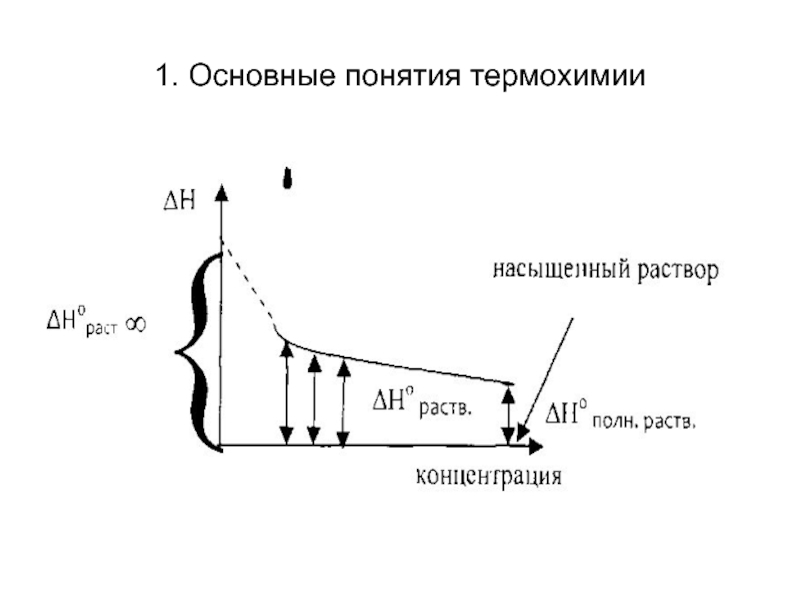
5. Теплоту растворения. Поскольку тепловой эффект при растворении
зависит от концентрации раствора, то при термохимическом исследовании растворов используют несколько величин, описывающих процесс. Интегральной теплотой растворения называют изменение энтальпии при растворении 1 моль вещества в некотором количестве растворителя, в результате которой получается раствор с заданной концентрацией. Она равна сумме поглощенной теплоты при разрушении кристаллической решетки и теплоты сольватации (гидратации) ионов. Часто эту величину называют просто теплотой растворения.
Слайд 181. Основные понятия термохимии
Предельная интегральная теплота растворения ΔН°раст ∞ - изменение
энтальпии при растворении 1 моль вещества с образованием бесконечно разбавленного раствора. Полная интегральная теплота растворения ΔН°полн.раств. - изменение энтальпии при растворении 1 моль вещества с образованием насыщенного раствора.
Слайд 201. Основные понятия термохимии
6. Энергия связи - теплота, выделяющаяся в процессе
образования связи между двумя атомами, взятыми в газообразном состоянии, энергия диссоциации молекулы - теплота, которая затрачивается в процессе распада молекулы на атомы;
7. Энергия кристаллической решетки - теплота, которая затрачивается на диссоциацию ионных кристаллов на газообразные ионы;
8. Энергия ионизации и сродства к электрону атомов - тепловые эффекты ионизации атомов, за счет отрыва или присоединения электронов.
7. Энергия кристаллической решетки - теплота, которая затрачивается на диссоциацию ионных кристаллов на газообразные ионы;
8. Энергия ионизации и сродства к электрону атомов - тепловые эффекты ионизации атомов, за счет отрыва или присоединения электронов.
Слайд 212. Закон Гесса и его следствия
В 1836 г. профессор Петербургского горного
института Герман Иванович Гесс установил основной закон термохимии, который является по сути следствием 1-го закона термодинамики.
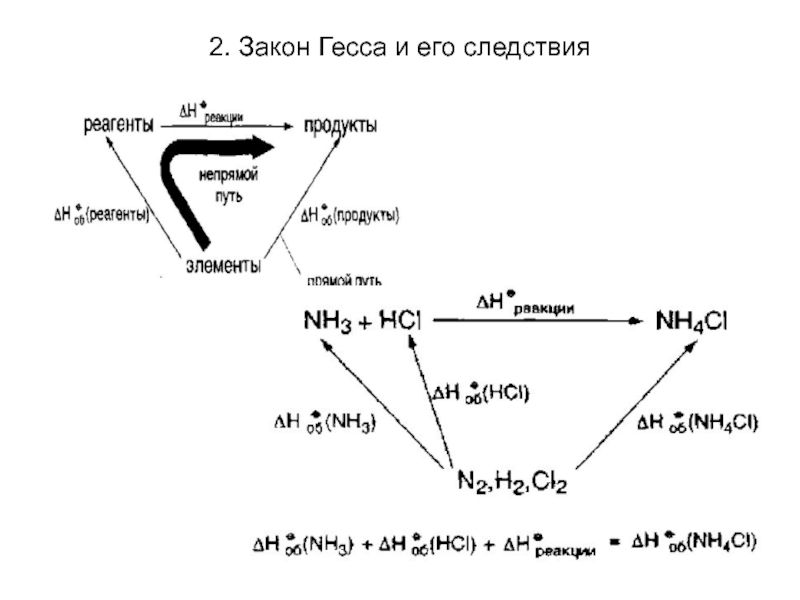
Закон Гесса: тепловой эффект физико-химического процесса не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.
Закон Гесса: тепловой эффект физико-химического процесса не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.
Слайд 222. Закон Гесса и его следствия
Закон Гесса позволяет обращаться с термохимическими
уравнениями, как с алгебраическими, т.е. складывать, вычитать, умножать и делить на целые и дробные числа, если только тепловые эффекты относятся к одинаковым условиям.
Для термохимических расчетов чаще используют следствия из закона Гесса, которые позволяют определить тепловые эффекты многочисленных физико-химических процессов, не прибегая к измерениям.
Для термохимических расчетов чаще используют следствия из закона Гесса, которые позволяют определить тепловые эффекты многочисленных физико-химических процессов, не прибегая к измерениям.
Слайд 232. Закон Гесса и его следствия
1-е следствие закона Гесса: тепловой эффект
разложения какого-либо вещества точно равен и противоположен по знаку тепловому эффекту его образования (закон Лавуазье-Лапласа)
Слайд 242. Закон Гесса и его следствия
2 -e следствие: тепловой эффект реакции
равен алгебраической сумме теплот образования продуктов реакции за вычетом алгебраической суммы теплот образования исходных веществ с учетом стереохимических коэффициентов.
Слайд 262. Закон Гесса и его следствия
3 - е следствие: тепловой эффект
реакции равен алгебраической сумме энтальпий сгорания исходных веществ за вычетом алгебраической суммы энтальпий сгорания продуктов с учетом их стехиометрических коэффициентов.
Слайд 272. Закон Гесса и его следствия
4 —е следствие: если совершаются две
реакции, приводящие из различных начальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое. Это следствие позволяет точно вычислять тепловые эффекты процессов, которые зачастую даже не имеется возможности практически осуществить.
Слайд 282. Закон Гесса и его следствия
5 —е следствие: если совершаются две
реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой процесс перехода из одного конечного состояния в другие.
Слайд 293. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Все описанные выше расчеты
тепловых эффектов, основанные на теплотах образования, сгорания и т.д. имеют недостаток: используя закон Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно это 298 К), при которой известны величины стандартных теплот.
Как узнать тепловой эффект реакции при иных температурах?
Как узнать тепловой эффект реакции при иных температурах?
Слайд 303. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Тепловой эффект химической реакции
зависит от температуры.
Эта зависимость определяется законом Кирхгоффа:
температурный коэффициент теплового эффекта равен разности сумм теплот реагентов и сумм теплоемкостей продуктов.
Эта зависимость определяется законом Кирхгоффа:
температурный коэффициент теплового эффекта равен разности сумм теплот реагентов и сумм теплоемкостей продуктов.
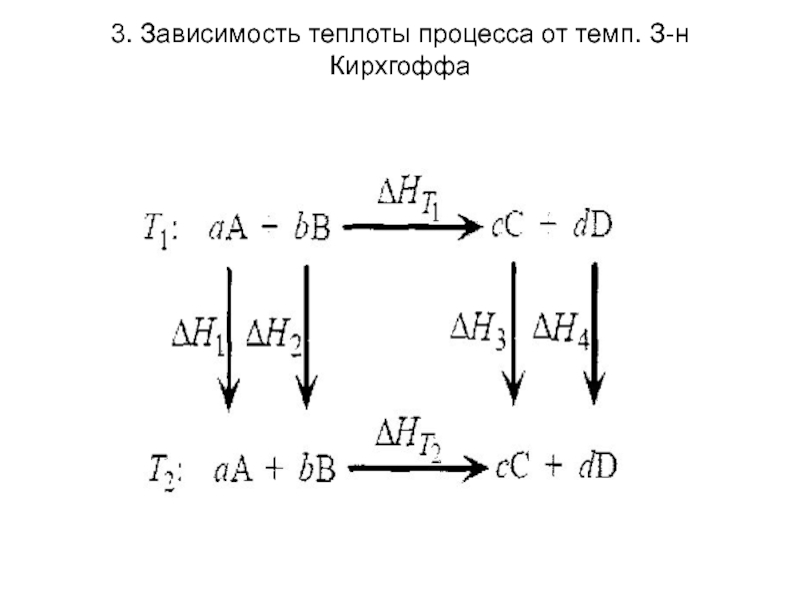
Слайд 323. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Согласно этой схеме, переход
из начального состояния (вещества А и В при температуре Т1) в конечное (вещества С и D при температуре Т2) может быть осуществлен двумя путями:
протекание химического превращения реагентов в продукты при температуре Т1 с последующим охлаждением или нагреванием продуктов до Т2;
Нагревание или охлаждение реагентов до Т2 и химическое превращение при этой температуре.
протекание химического превращения реагентов в продукты при температуре Т1 с последующим охлаждением или нагреванием продуктов до Т2;
Нагревание или охлаждение реагентов до Т2 и химическое превращение при этой температуре.
Слайд 333. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Согласно закону Гесса,
ΔНТ1
+ ΔН3 + ΔН4 = ΔН1 + ΔН2 + Δ НТ2 или ΔНТ1 + сСр,с(Т2- Т1) +dСр,D(Т2- Т1) = aСр,A(Т2- Т1) + b Ср,B(Т2- Т1) + ΔНТ2
откуда ΔНТ2 = (сСр,с + dСр,D - aСр,A- bСр,B(Т2- Т1) = ΔНТ1 + ΔСрΔТ, где ΔСр – изменение теплоемкости системы, происходящее в результате протекания реакции.
откуда ΔНТ2 = (сСр,с + dСр,D - aСр,A- bСр,B(Т2- Т1) = ΔНТ1 + ΔСрΔТ, где ΔСр – изменение теплоемкости системы, происходящее в результате протекания реакции.
Слайд 343. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Полученное уравнение является интегральной
формой уравнения Кирхгоффа, связывающего тепловые эффекты при разных температурах. Интегральное уравнение при дифференцировании можно перевести в дифференциальную форму.
Слайд 353. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Интегральная форма уравнения Кирхгоффа
Дифференциальная
форма уравнения Кирхгоффа
Слайд 363. Зависимость теплоты процесса от темп. З-н Кирхгоффа
Аналогично, можно показать, что
справедливы следующие соотношения для изохорных тепловых эффектов:
Слайд 373. Зависимость теплоты процесса от темп. З-н Кирхгоффа
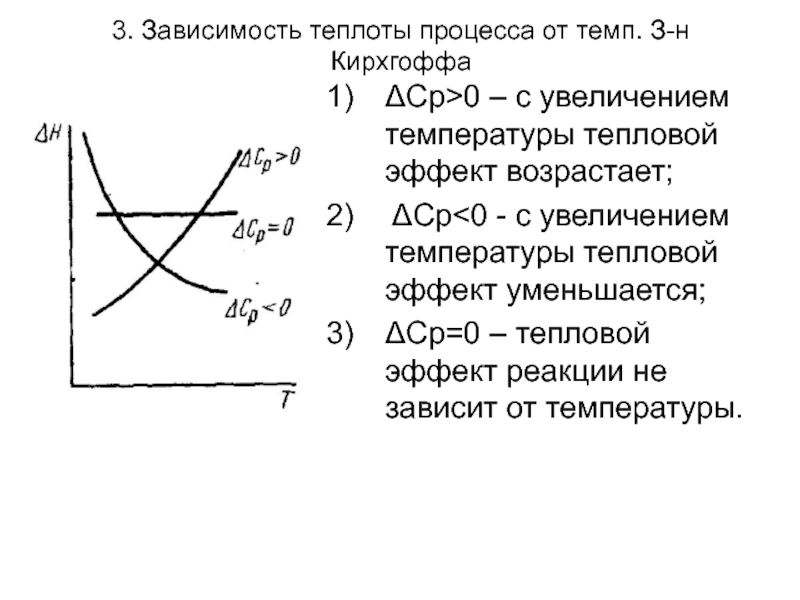
Уравнения Кирхгоффа в дифференциальной
форме позволяют качественно оценить зависимость теплового эффекта от температуры, которая определяется знаком величины ΔСр или ΔСv.
ΔН(Т2)= ΔН(Т1)+ ΔСр(Т2 –Т1)
ΔН(Т2)= ΔН(Т1)+ ΔСр(Т2 –Т1)
Слайд 383. Зависимость теплоты процесса от темп. З-н Кирхгоффа
ΔСр>0 – с увеличением
температуры тепловой эффект возрастает;
ΔСр<0 - с увеличением температуры тепловой эффект уменьшается;
ΔСр=0 – тепловой эффект реакции не зависит от температуры.
ΔСр<0 - с увеличением температуры тепловой эффект уменьшается;
ΔСр=0 – тепловой эффект реакции не зависит от температуры.