- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термохимия. Термохимические уравнения презентация
Содержание
- 2. Термохимия Термохимические уравнения Термохимическая и термодинамическая
- 3. Термохимическая и термодинамическая системы знаков противоположны друг
- 4. Термохимические уравнения
- 5. Термохимическое уравнение должно содержать указание на агрегатные состояния веществ – участников реакции
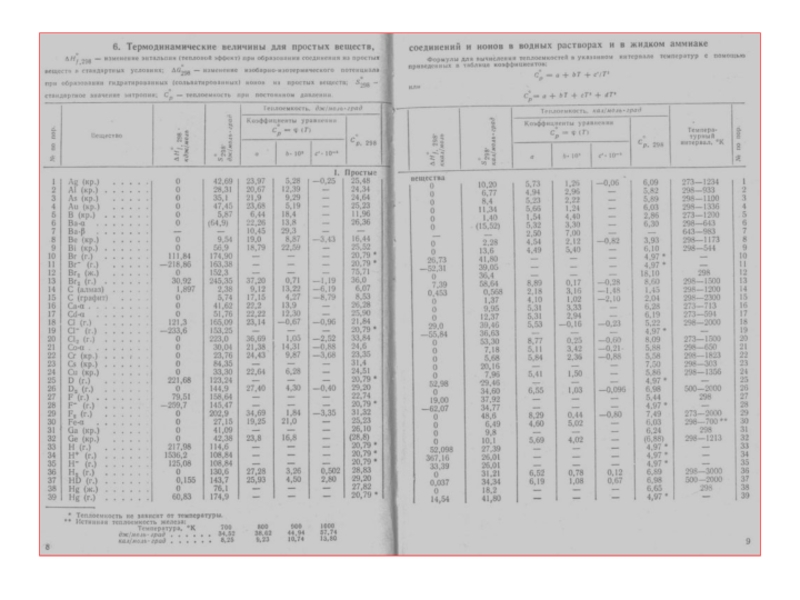
- 6. Измерение тепловых эффектов химических реакций
- 7. В химической лаборатории кафедры ОиСХ ИАТЭ НИЯУ МИФИ
- 8. Следствия первого закона термодинамики Новая функция состояния
- 9. Закон Гесса Тепловой эффект химической реакции, проводимой
- 11. Следствия закона Гесса Тепловой эффект прямой реакции
- 13. Следствия закона Гесса Тепловой эффект химической реакции
- 14. Теплота образования сложного вещества Под теплотой образования
- 15. Стандартные условия Давление 1 атмосфера (0,1 мПа)
- 18. Абсолютные значения энтальпии не могут быть определены.
- 20. Типовые задачи
- 21. Задача Используя справочные данные, рассчитать тепловой эффект реакции обжига пирита. Записать термохимическое уравнение
- 22. Задача Тепловой эффект реакции равен
- 23. Задача Какое количество
- 24. Расчеты тепловых эффектов физико -химических процессов через
- 25. Рассчитать теплоту аллотропного превращения графита в алмаз
- 26. С целью расчета тепловых эффектов реакций, данные
- 27. Задача Исходя из данных для реакций
- 29. Расчет теплот фазовых переходов Рассчитать теплоту
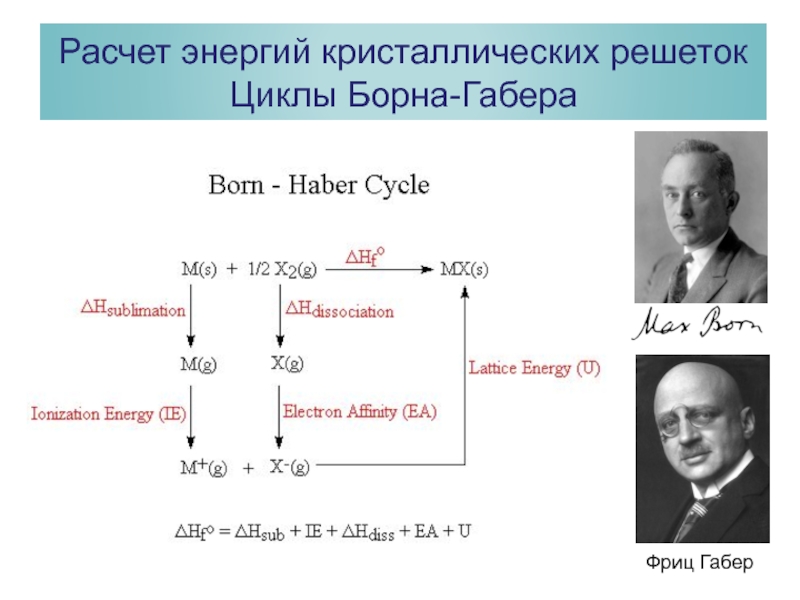
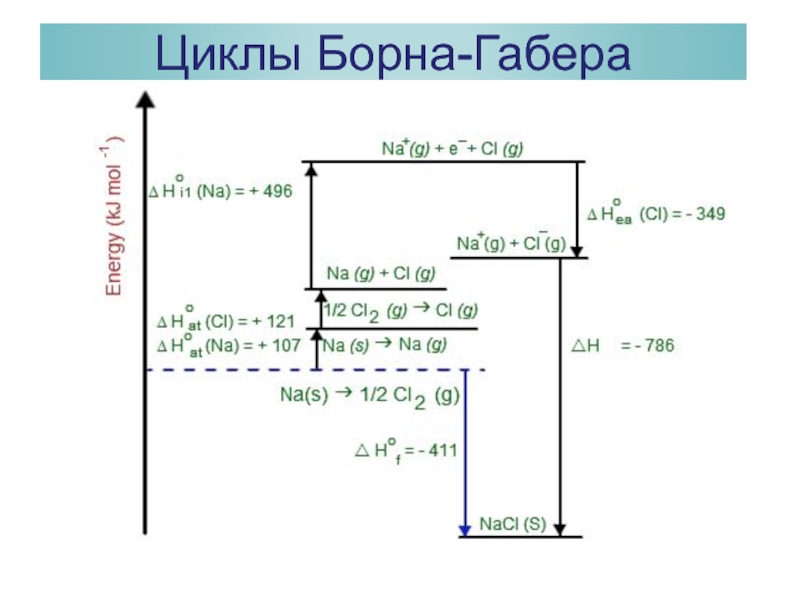
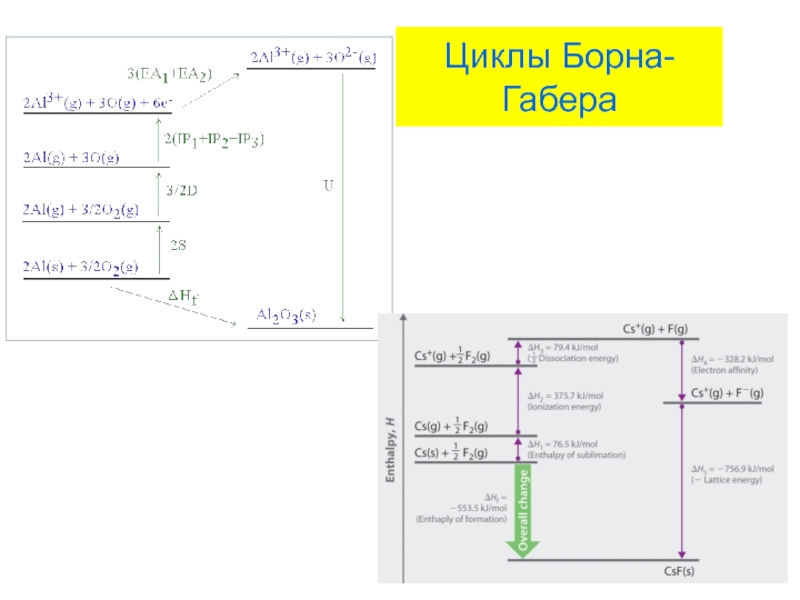
- 30. Расчет энергий кристаллических решеток Циклы Борна-Габера Фриц Габер
- 31. Циклы Борна-Габера
- 32. Циклы Борна-Габера
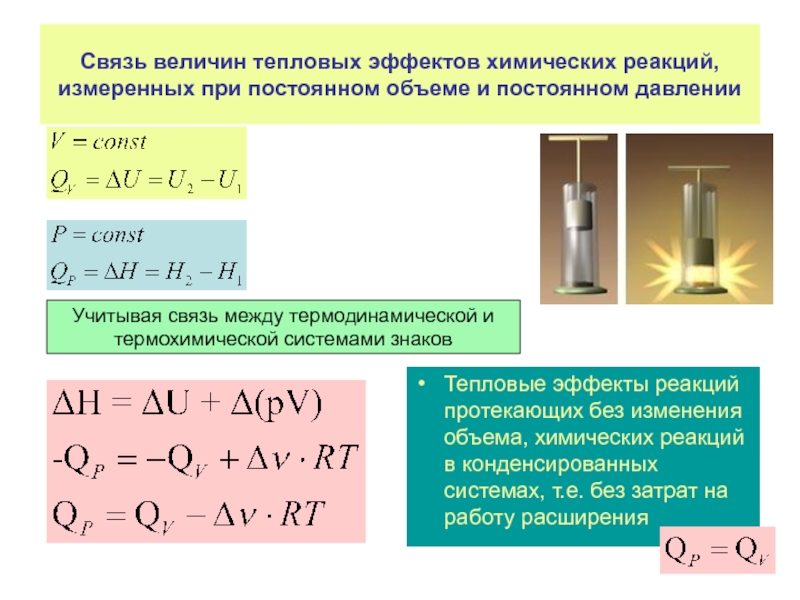
- 33. Связь величин тепловых эффектов химических реакций, измеренных
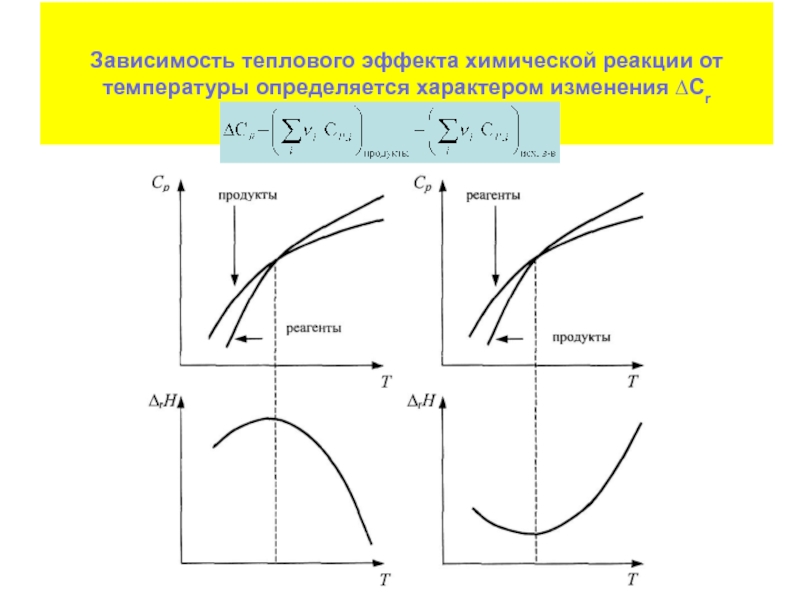
- 34. Температурная зависимость теплового эффекта химических реакций
- 36. Вывести аналитическую зависимость теплового эффекта (Дж) реакции от температуры
- 37. Зависимость теплового эффекта химической реакции от температуры определяется характером изменения ∆Сr
Слайд 2Термохимия
Термохимические уравнения
Термохимическая и термодинамическая система знаков
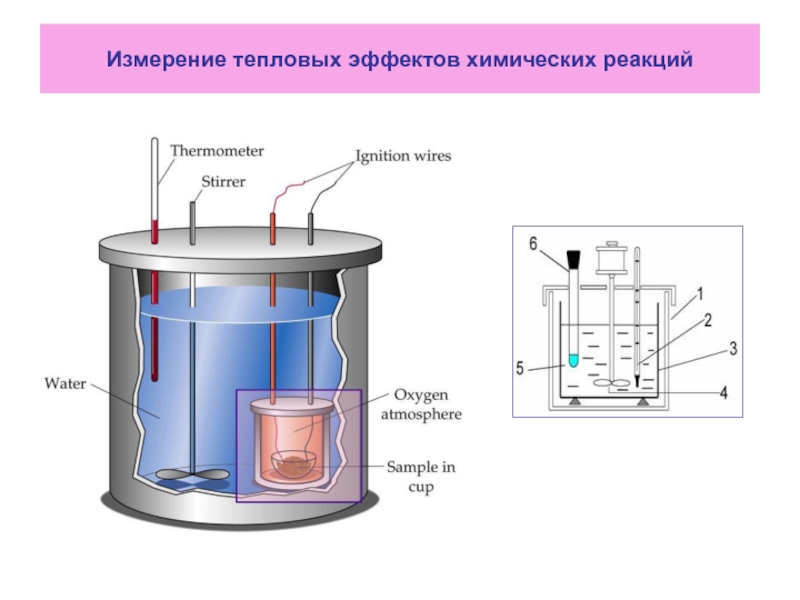
Измерение тепловых эффектов химических реакций
Закон
Следствия из закона Гесса
Теплота (энтальпия) образования
Стандартные условия
Расчет тепловых эффектов химических реакций
Температурная зависимость тепловых эффектов химических реакций. Закон Кирхгоффа
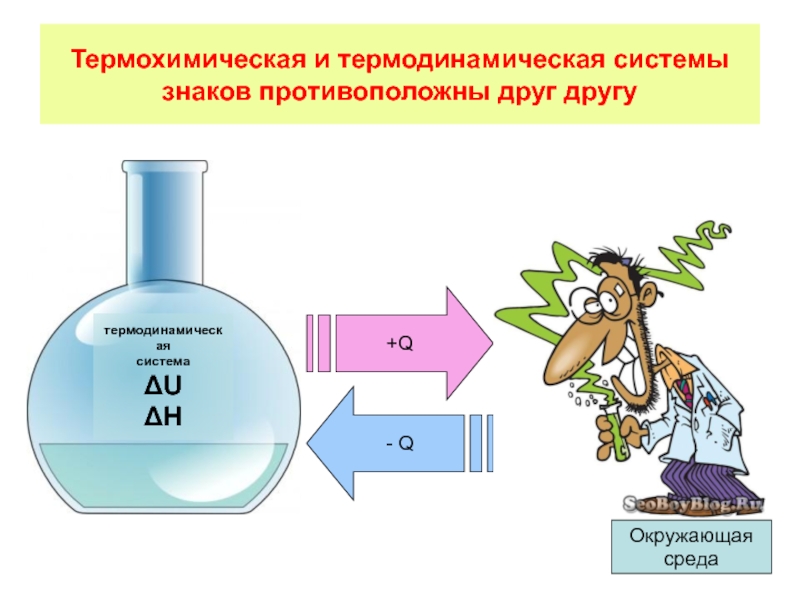
Слайд 3Термохимическая и термодинамическая системы знаков противоположны друг другу
термодинамическая
система
ΔU
ΔH
+Q
- Q
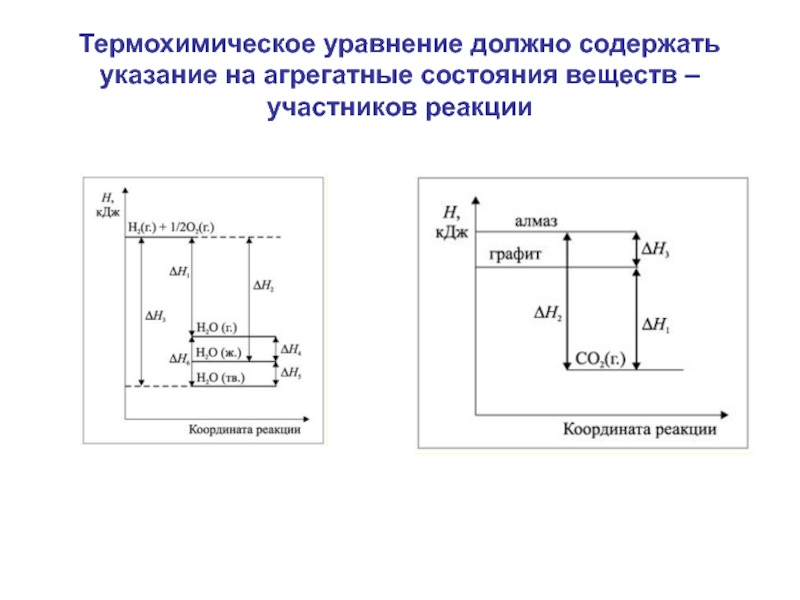
Слайд 5Термохимическое уравнение должно содержать указание на агрегатные состояния веществ – участников
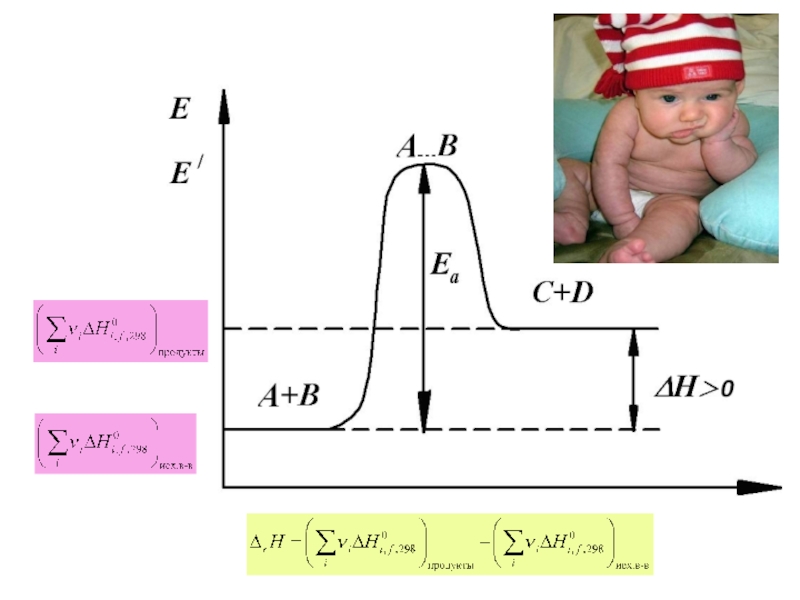
Слайд 8Следствия первого закона термодинамики
Новая функция состояния системы – ЭНТАЛЬПИЯ
Для изобарно-изотермических и изохорно-изотермических процессов тепловой эффект химической реакции не зависит от пути проведения химической реакции
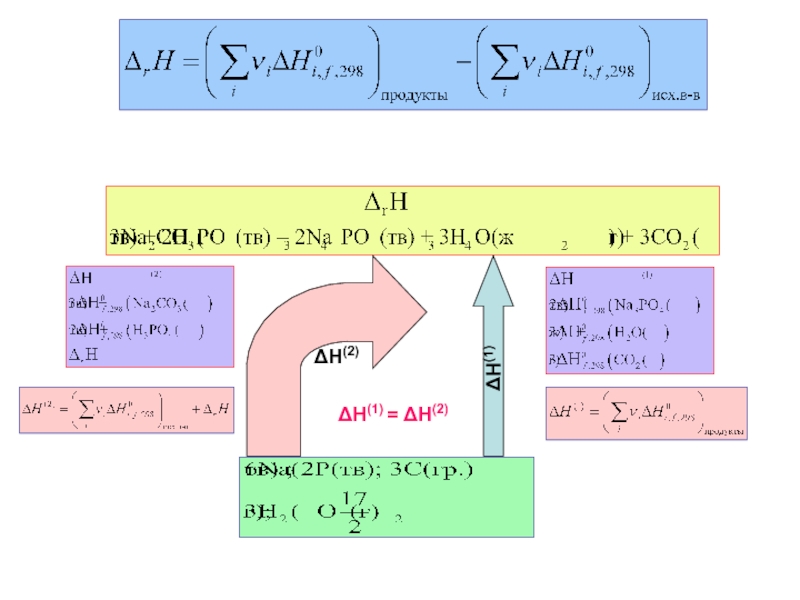
Слайд 9Закон Гесса
Тепловой эффект химической реакции, проводимой при P=const или V=const не
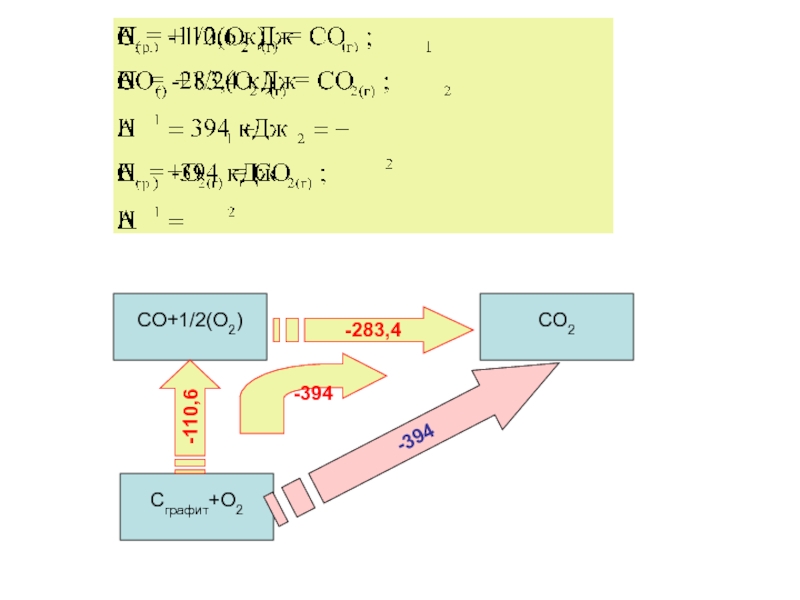
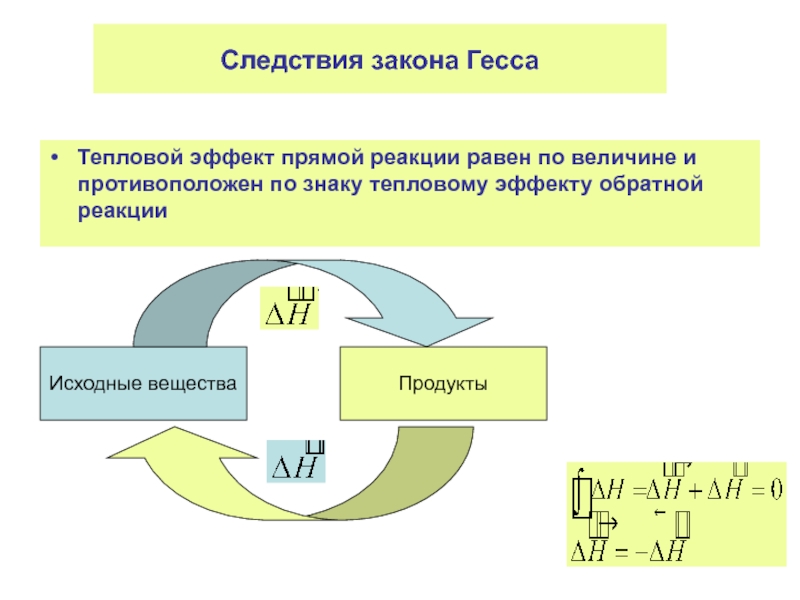
Слайд 11Следствия закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен
Слайд 13Следствия закона Гесса
Тепловой эффект химической реакции равен разности суммы теплот образования
Слайд 14Теплота образования сложного вещества
Под теплотой образования (энтальпией образования) сложного вещества подразумевают
Теплота образования (энтальпия образования) простого вещества равна нулю
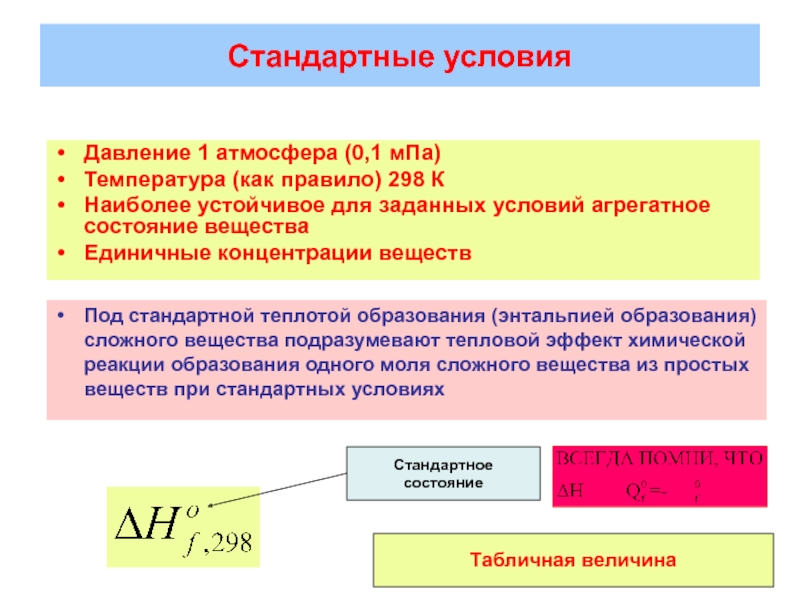
Слайд 15Стандартные условия
Давление 1 атмосфера (0,1 мПа)
Температура (как правило) 298 К
Наиболее
Единичные концентрации веществ
Табличная величина
Под стандартной теплотой образования (энтальпией образования) сложного вещества подразумевают тепловой эффект химической реакции образования одного моля сложного вещества из простых веществ при стандартных условиях
Слайд 18Абсолютные значения энтальпии не могут быть определены. Приняв в качестве «точки отсчета»
Слайд 21Задача
Используя справочные данные, рассчитать тепловой эффект реакции обжига пирита. Записать
Слайд 22Задача
Тепловой эффект реакции
равен
Определить стандартную теплоту образования сероводорода, используя стандартные энтальпии образования оксида серы (IV) и воды (взять из справочника)
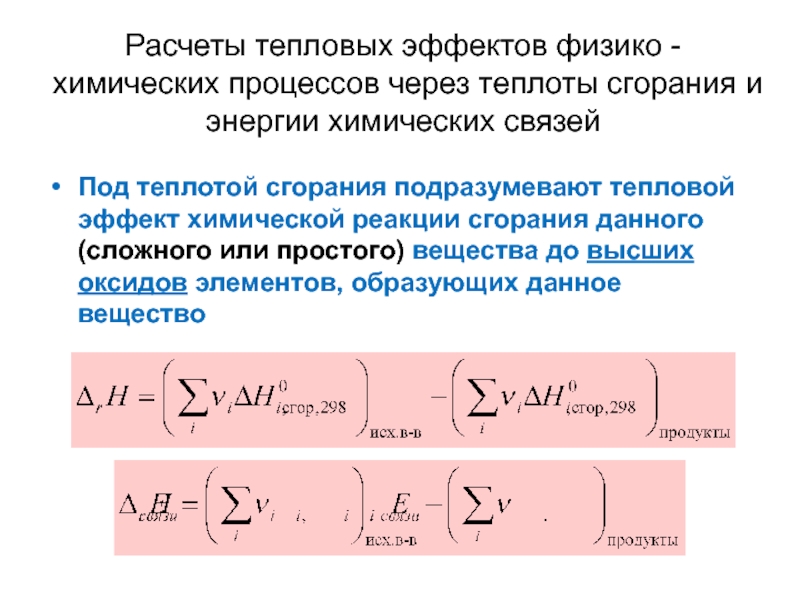
Слайд 24Расчеты тепловых эффектов физико -химических процессов через теплоты сгорания и энергии
Под теплотой сгорания подразумевают тепловой эффект химической реакции сгорания данного (сложного или простого) вещества до высших оксидов элементов, образующих данное вещество
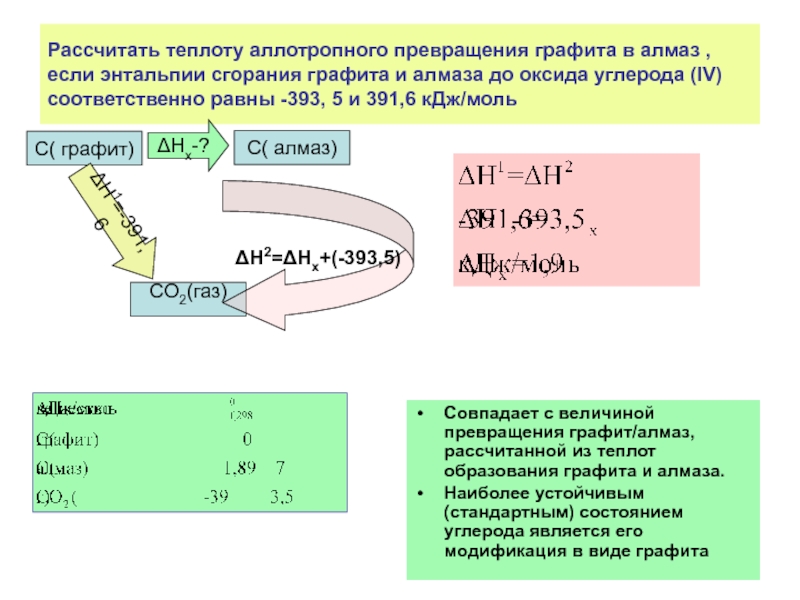
Слайд 25Рассчитать теплоту аллотропного превращения графита в алмаз , если энтальпии сгорания
Совпадает с величиной превращения графит/алмаз, рассчитанной из теплот образования графита и алмаза.
Наиболее устойчивым (стандартным) состоянием углерода является его модификация в виде графита
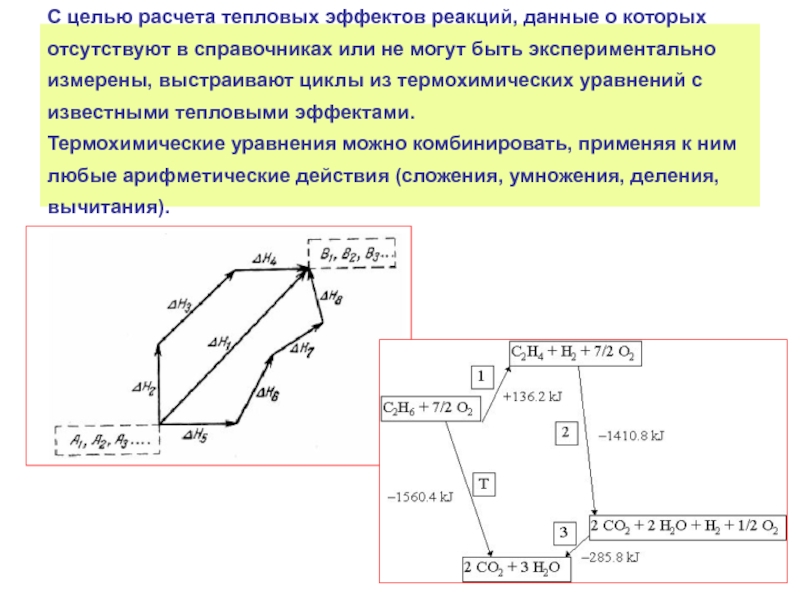
Слайд 26С целью расчета тепловых эффектов реакций, данные о которых отсутствуют в
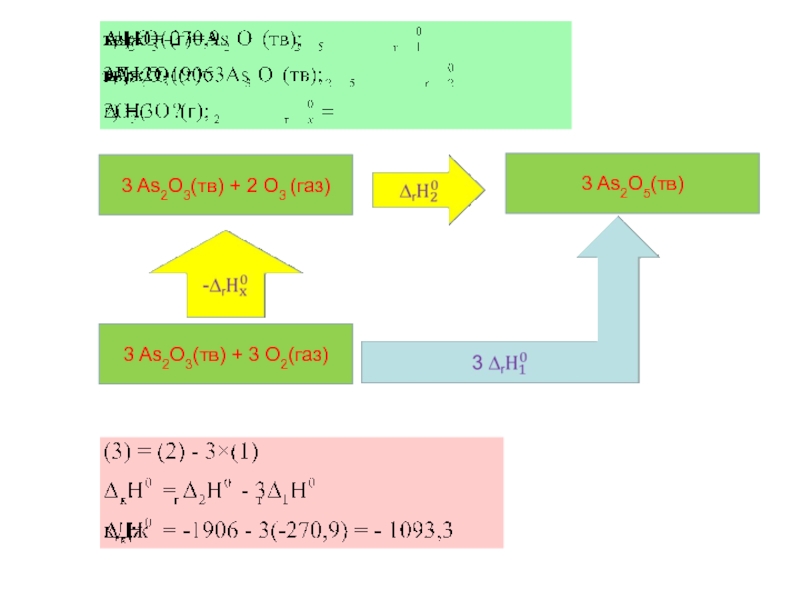
Слайд 27Задача
Исходя из данных для реакций окисления оксида мышьяка (III) кислородом
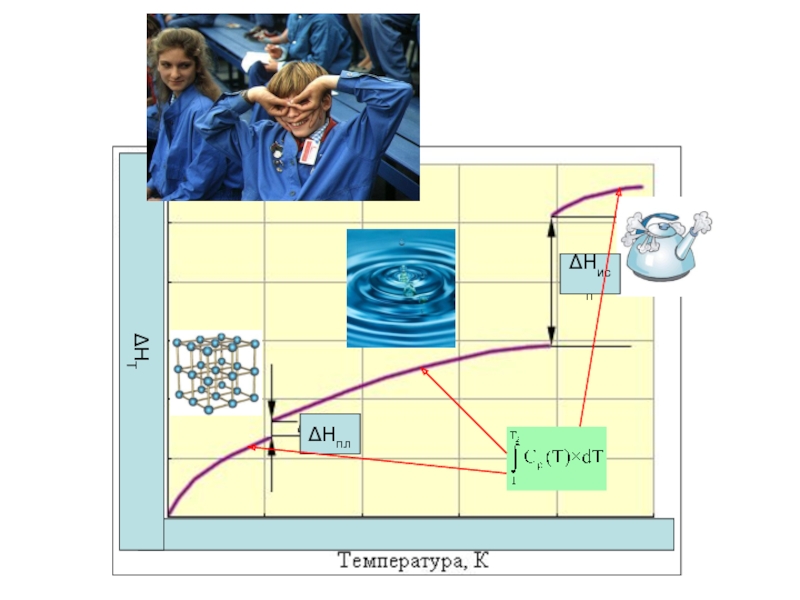
Слайд 29Расчет теплот фазовых переходов
Рассчитать теплоту плавления, испарения и сублимации воды
Слайд 33Связь величин тепловых эффектов химических реакций, измеренных при постоянном объеме и
Тепловые эффекты реакций протекающих без изменения объема, химических реакций в конденсированных системах, т.е. без затрат на работу расширения
Учитывая связь между термодинамической и
термохимической системами знаков