- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 8. Электрохимия презентация
Содержание
- 1. Лекция 8. Электрохимия
- 2. Электрохимия – это раздел химической науки, изучающий электрохимические процессы.
- 3. Электрохимическими называются процессы: а) протекающие в растворе
- 4. Большинство электрохимических процессов являются окислительно-восстановительными.
- 5. План 8.1 Термодинамика ОВР 8.2 Устройство и принцип действия гальванических элементов 8.3 Потенциометрические методы анализа
- 6. 8.1 ОВР – это реакции, протекающие с
- 7. Степень окисления – это условный заряд атома
- 8. Степень окисления принимает любые значения: целые, дробные,
- 9. Типы ОВР Межмолекулярные ОВР – окислитель и
- 10. 2.Внутримолекулярные ОВР – атом-окислитель и атом-восстановитель входят
- 11. 3. Реакции диспропорционирования – атом одного
- 12. Схема межмолекулярной ОВР : Ок1 + Вос2
- 13. Например: MnO2 + 4 HCl →
- 14. Если ОВР протекает в водном растворе, то
- 15. В справочниках приводятся стандартные ОВП (φ0ок/вос).
- 16. Чем меньше ОВП, тем сильнее восстановитель и
- 17. Чем больше ОВП, тем сильнее окислитель и
- 18. Зная ОВП, можно сравнивать силу окислителей и
- 19. Сила окислителей и восстановителей зависит от:
- 20. Влияние температуры и концентрации на ОВ свойства
- 21. где n – число отданных или принятых
- 22. Немецкий физик и химик, профессор Берлинского универ-ситета,
- 23. При Т = 298 К
- 24. Соответственно: φОк/Вос = φ0Oк/Вос + 0,0592 n lg [Ок] [Вос]
- 25. Пример: MnO4‾ + 8H+ + 5
- 26. Характеристикой ОВР является ее электродвижущая сила (ЭДС или Е), В Е=φОк1/Вос1–φОк2/Вос2
- 27. Например: KMnO4 + H2O2 + H2SO4
- 28. Рассчитав электродвижущую силу ОВ реакции, можно определить
- 29. Аэл = nFE Aэл
- 30. Если Е > 0, то ΔrG <
- 31. Большинство ОВР имеют обратимый характер, поэтому их
- 33. При Т = 298К К = 10 nE0 0,0592
- 34. Большинство биохимических реакций являются окислительно-восстановительными. Они играют важную роль в организме, выполняя две важнейшие функции.
- 35. 1) пластическую –
- 36. Энергоснабжение организма на 99% обеспечивается протеканием в
- 37. Фармакологическое действие ряда лекарственных препаратов основано на
- 38. Na2S2O3 – универсальное противоядие, применяемое при отравлениях
- 39. 8.2 Гальванический элемент (ГЭ) – это устройство для превращения химической энергии в электрическую.
- 40. ГЭ состоит из двух электродов (полуэлементов). Простейший
- 41. Более активный металл называется анодом.
- 42. На менее активном металле, называемом катодом, протекает
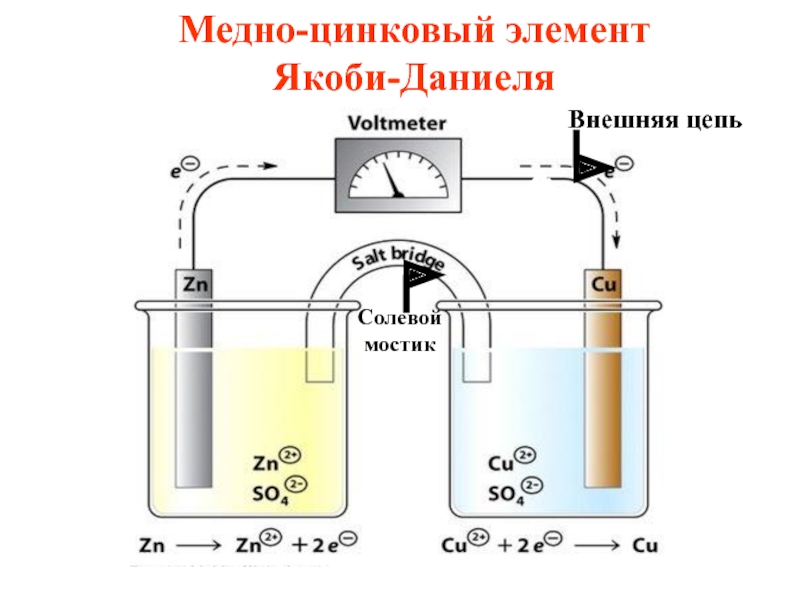
- 43. Солевой мостик Медно-цинковый элемент
- 44. Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического элемента
- 45. Растворы солей CuSO4 и ZnSO4 соединены между
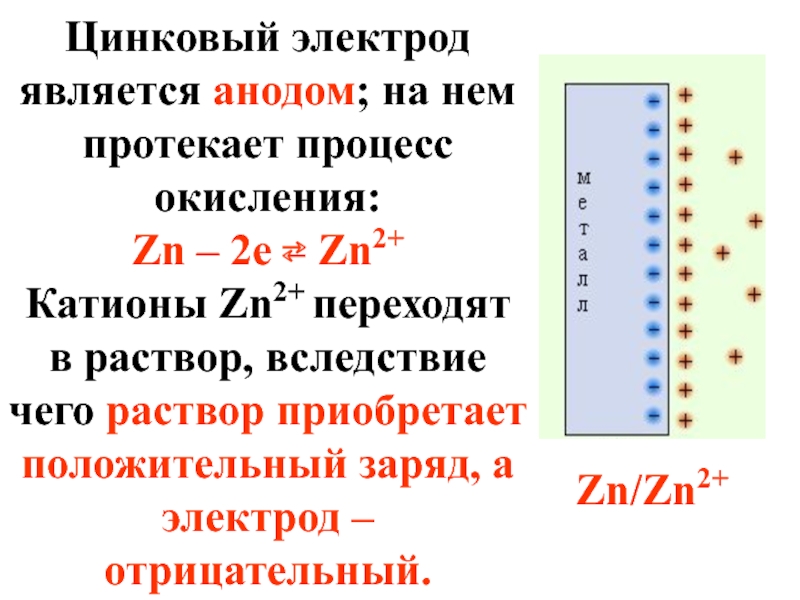
- 46. Цинковый электрод является анодом; на нем протекает
- 47. Электроны , отданные цинком, поступают во внешнюю цепь и мигрируют к меди.
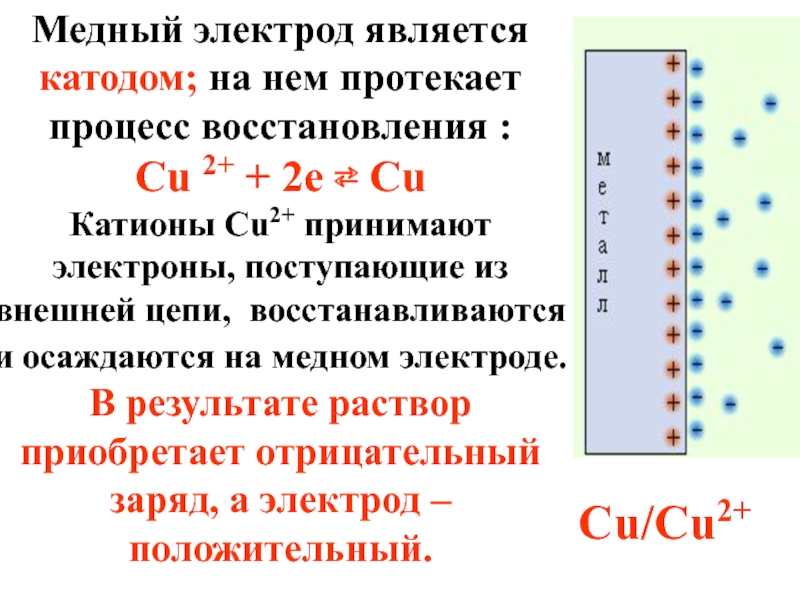
- 48. Медный электрод является катодом; на нем протекает
- 49. (-)Zn / Zn2+ // Cu2+/ Cu (+) Схема медно-цинкового гальванического элемента
- 50. / обозначает поверхность раздела металл-раствор, а также
- 51. // обозначают границу раздела двух растворов, а
- 52. Катод: Zn – 2e ⇄
- 53. Э.д.с. гальванического элемента рассчитывают как: Е=φ(катод)–φ(анод)
- 54. Кроме ОВ и диффузионных потенциалов существуют мембранные
- 55. Ионный состав нервной клетки
- 56. Для каждого проникающего иона мембранный потенциал рассчитывается
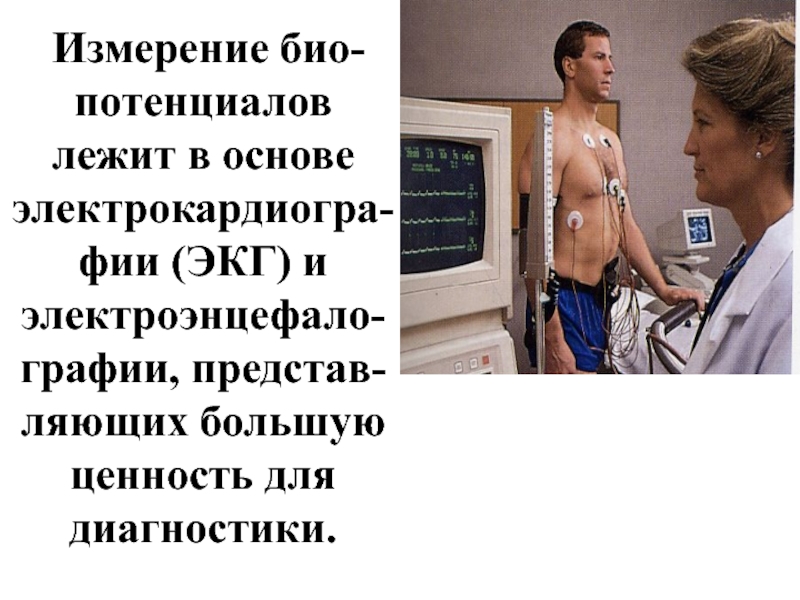
- 57. Измерение био-потенциалов лежит в основе электрокардиогра-фии
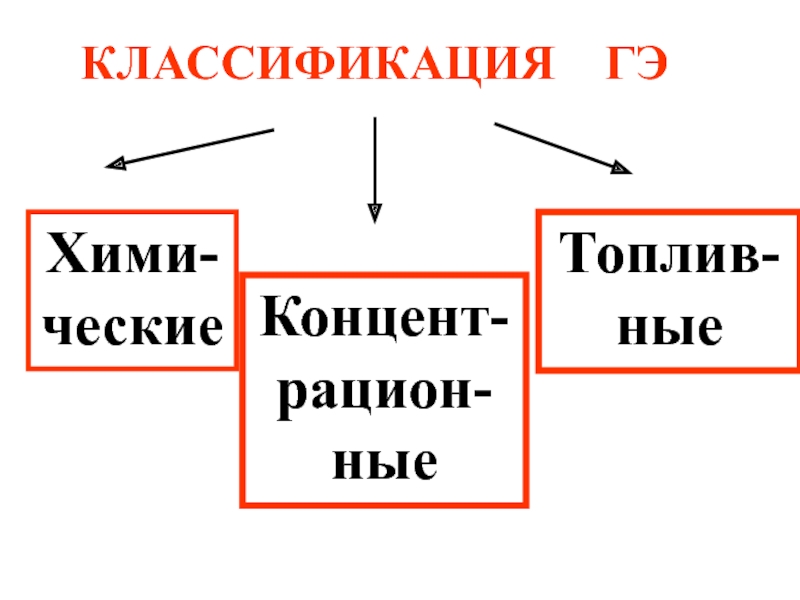
- 58. КЛАССИФИКАЦИЯ ГЭ Хими-ческие Концент-рацион-ные Топлив-ные
- 59. Химические ГЭ состоят из различных электродов. Концентрационные
- 60. С3Н8 + 5 О2 → 3 СО2
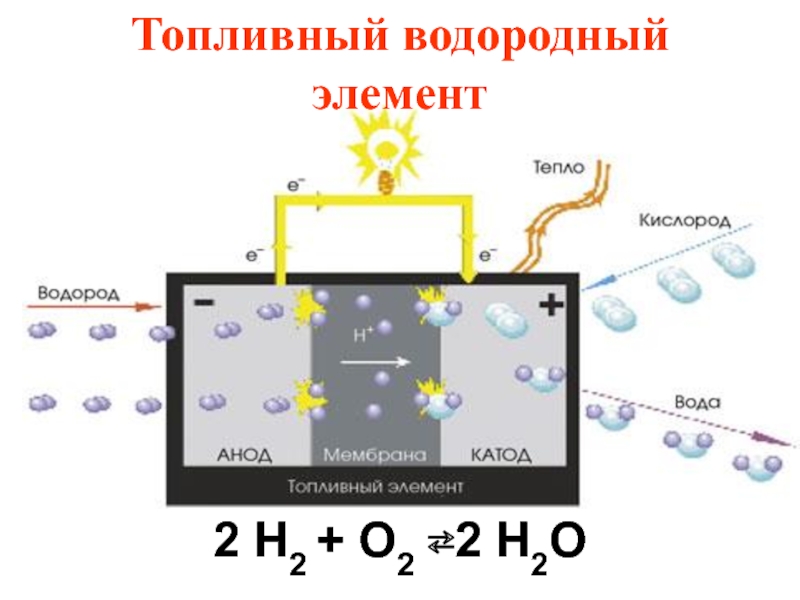
- 61. Топливный водородный элемент 2 H2 + O2 ⇄2 H2O
- 62. КПД водородного элемента составляет не менее 50%.
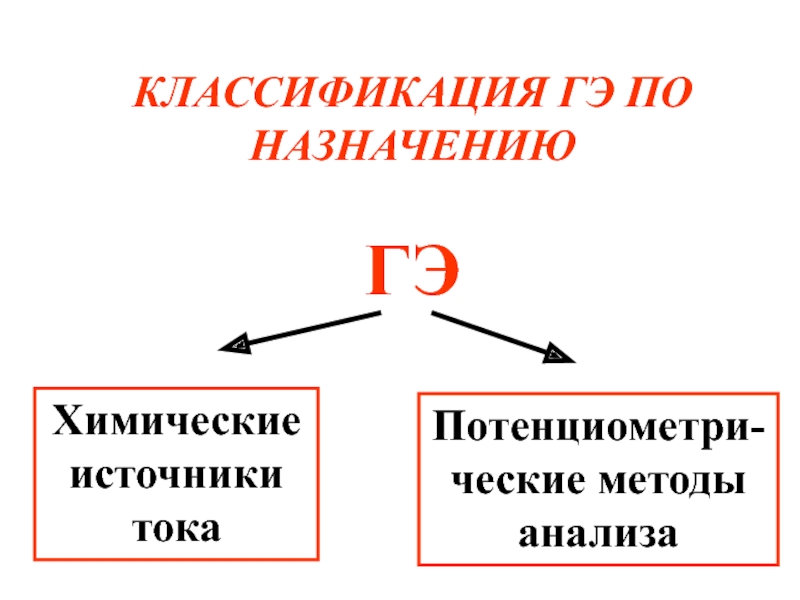
- 63. КЛАССИФИКАЦИЯ ГЭ ПО НАЗНАЧЕНИЮ ГЭ Химические источники тока Потенциометри-ческие методы анализа
- 64. Открытие ГЭ принадлежит анатому из Болоньи
- 65. Алоизо Луиджи Гальвани (1726 - 1798) Итальянский
- 66. 8.3Потенциометрия – совокупность физико-химических методов анализа, основанных на измерении э.д.с специально составленных ГЭ.
- 67. Потенциометрия ПРЯМАЯ
- 68. Типы электродов, применяемых в потенциометрии Электроды 1-го
- 69. φ = φ0 + 0,0592
- 70. Электроды 2-го рода – металл, покрытый слоем своего труднорастворимого соединения и опущенный в раствор соли.
- 71. Ag,AgCl / KCl(нас) При его работе
- 72. Устройство и принцип действия водородного электрода Pt,
- 73. Ионоселективные электроды (ИСЭ) позволяют определять содержание
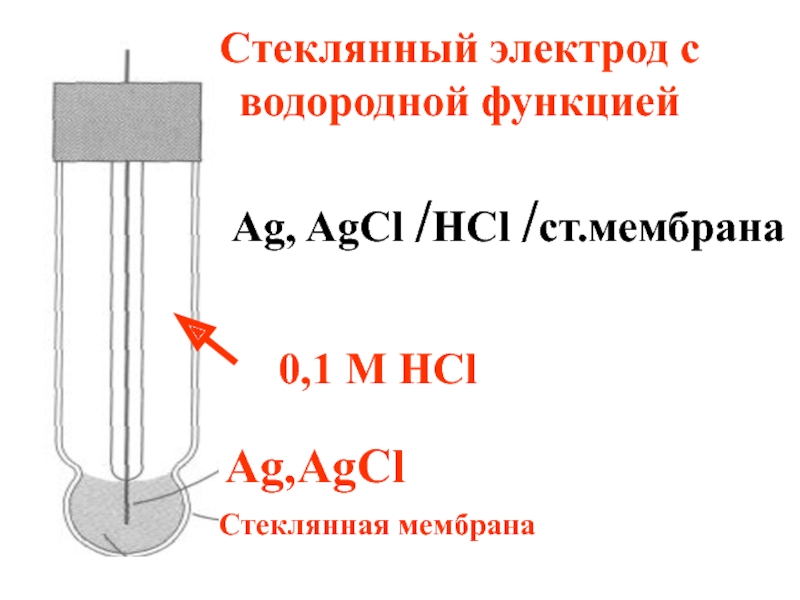
- 74. Стеклянный электрод с водородной функцией 0,1 M
- 75. Из-за различного содержания Н+ во внутреннем и
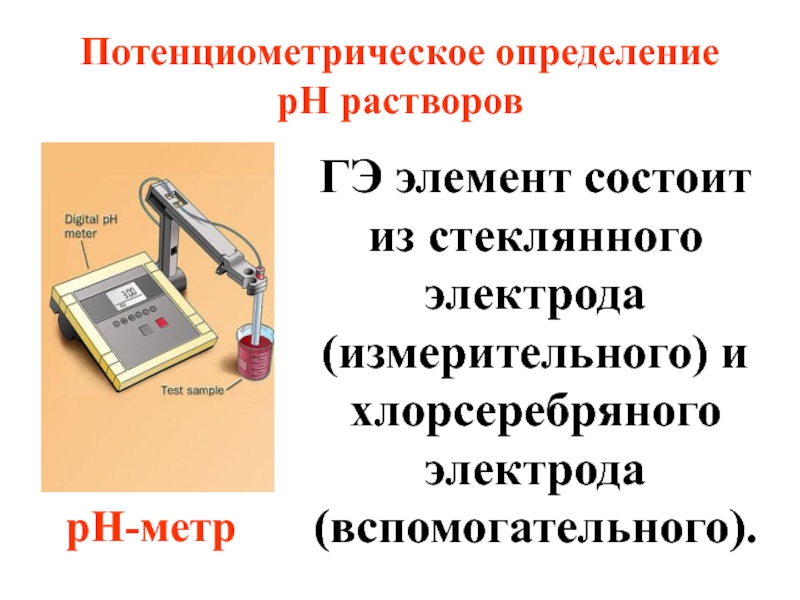
- 76. Потенциометрическое определение рН растворов pH-метр ГЭ элемент
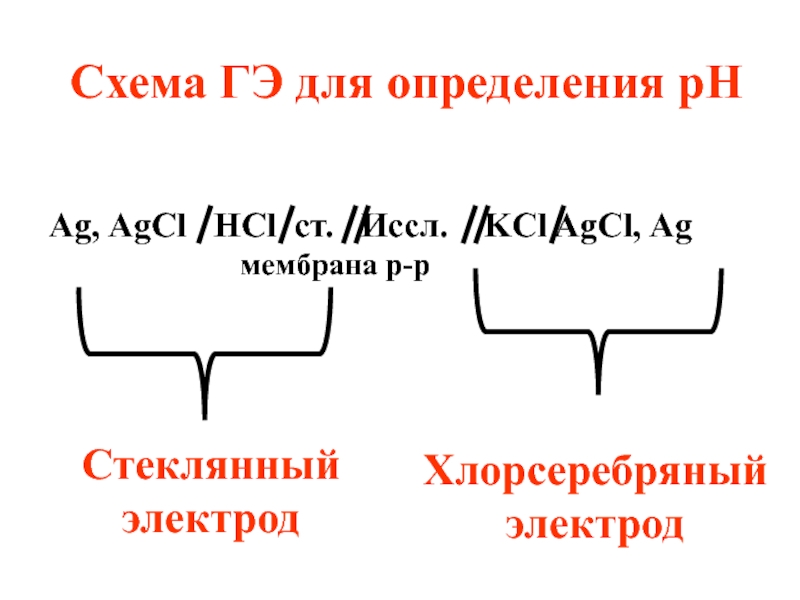
- 77. Ag, AgCl HCl ст. Иссл.
- 78. Потенциометрическое титрование - это любой метод титриметрического
- 79. Интегральная кривая потенциометрического титрования Е, В Объем титранта V экв
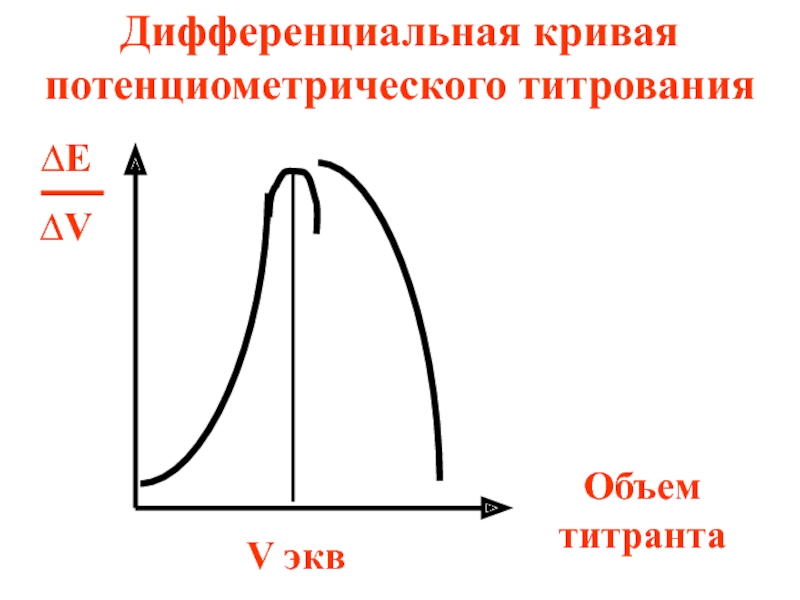
- 80. ∆Е ∆V Объем титранта Дифференциальная кривая потенциометрического титрования V экв
- 81. Потенциометрические методы анализа позволяют: анализировать окрашенные растворы,
- 82. Благодарим за внимание!!!
Слайд 3Электрохимическими называются процессы:
а) протекающие в растворе под воздействием электрического тока (электролиз);
б)
Слайд 5План
8.1 Термодинамика ОВР
8.2 Устройство и принцип действия гальванических элементов
8.3 Потенциометрические методы
Слайд 68.1 ОВР – это реакции, протекающие с изменением степени окисления атомов,
Слайд 7Степень окисления – это условный заряд атома в молекуле, вычисленный исходя
Слайд 8Степень окисления принимает любые значения: целые, дробные, положительные, отрицательные:
К2+1О‾2 Na2+1О2-1
КО3
Слайд 9Типы ОВР
Межмолекулярные ОВР – окислитель и восстано-витель, разные вещества:
К2Cr2O7 + 6KI
Слайд 102.Внутримолекулярные ОВР – атом-окислитель и атом-восстановитель входят в состав одного вещества
2Cu(NO3)2 →2CuO + 4NO2 + O2
Слайд 113. Реакции диспропорционирования
– атом одного химического элемента является и окислителем,
3Cl2 + 6KOH → 5KCl +KClO3 + 3H2O
2Н2О2 → 2H2O + O2
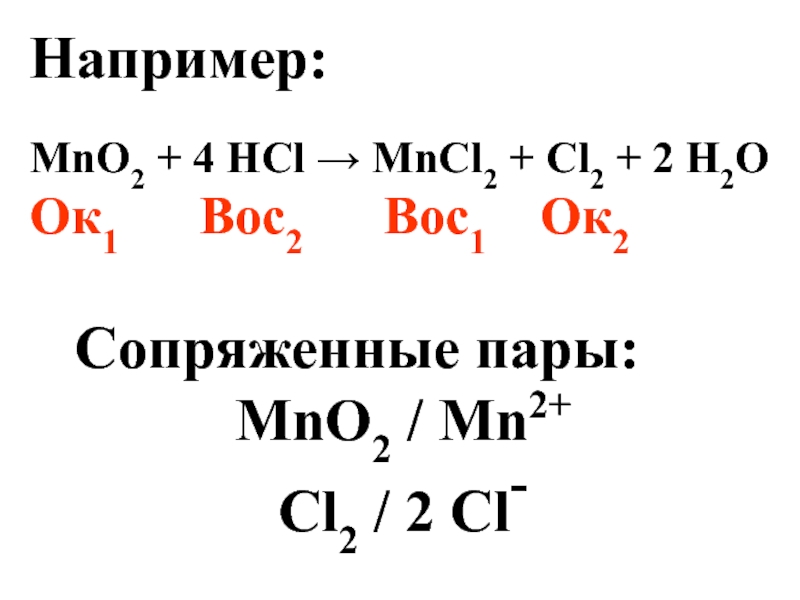
Слайд 13Например:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
Ок1
Сопряженные пары:
MnO2 / Mn2+
Сl2 / 2 Cl-
Слайд 14Если ОВР протекает в водном растворе, то характеристикой каждой сопряженной пары
Слайд 15В справочниках приводятся стандартные ОВП (φ0ок/вос).
Стандартные ОВП изменяются в диапазоне
φ0 (Li+ / Li) = – 3,045 В
φ0 (F2 / 2F‾) = + 2,87 В
Слайд 16Чем меньше ОВП, тем сильнее восстановитель и слабее сопряженный с ним
Li – самый сильный восстановитель, Li+ – самый слабый окислитель
Слайд 17Чем больше ОВП, тем сильнее окислитель и слабее сопряженный с ним
F2 – самый сильный окислитель, F- – самый слабый восстановитель.
Слайд 18Зная ОВП, можно сравнивать силу окислителей и восстано-вителей:
φ0 (MnO4‾ / Mn2+)
φ0 (MnO4‾ / MnО2) = 0,60 В
φ0 (MnO4‾ / MnО42‾) = 0,56 В
Уменьше-ние окисли-тельной активности KMnO4
Слайд 19Сила окислителей и восстановителей зависит от:
их природы,
концентрации,
иногда от рН.
Слайд 20Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста
φОк/Вос = φ0Oк/Вос +
RT
nF
ln
[Ок]
[Вос]
Слайд 22Немецкий физик и химик, профессор Берлинского универ-ситета, лауреат Нобе-левской премии 1920
В.Ф.Нернст
1864-1941
Слайд 27Например:
KMnO4 + H2O2 + H2SO4 →
Ок1
MnSO4 + O2 + K2SO4 +H2O
Вос1 Ок2
φ0 MnO4‾ / Mn2+ = 1,51 В
φ0 O2 / H2O2 = 0,68 В
Е0 = 1,51 – 0,68 = 0,83 В
Слайд 28Рассчитав электродвижущую силу ОВ реакции, можно определить ее характер (само- или
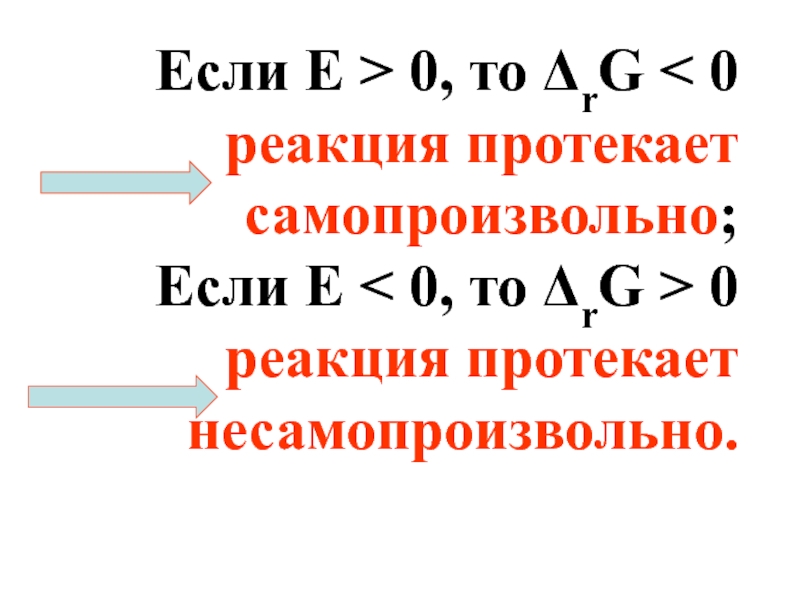
Слайд 30Если Е > 0, то ΔrG < 0 реакция
Если E < 0, то ΔrG > 0 реакция протекает несамопроизвольно.
Слайд 31Большинство ОВР имеют обратимый характер, поэтому их важной характеристикой является константа
ΔrG0 = – RTlnK
ΔrG0 = – nFE0
nFE0 = RTlnK
Слайд 34Большинство биохимических реакций являются окислительно-восстановительными. Они играют важную роль в организме,
Слайд 351) пластическую – синтез сложных органических
2) энергетическую – выделение энергии при окислении сложных высокомолекулярных веществ (углеводов, жиров и белков).
Слайд 36Энергоснабжение организма на 99% обеспечивается протеканием в нем ОВ процессов. Причем,
Слайд 37Фармакологическое действие ряда лекарственных препаратов основано на их ОВ свойствах. Известно,
Слайд 38Na2S2O3 – универсальное противоядие, применяемое при отравлениях тяжелыми металлами и хлором:
Pb(CH3COOH)2
Cl2 + Na2S2O3 + H2O→2 HCl + S + Na2SO4
Слайд 398.2 Гальванический элемент (ГЭ) – это устройство для превращения химической энергии
Слайд 40ГЭ состоит из двух электродов (полуэлементов). Простейший полуэлемент состоит из металлической
Слайд 41Более активный металл называется анодом.
Слайд 42На менее активном металле, называемом катодом, протекает процесс восстановления. При работе
Слайд 44Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического
Слайд 45Растворы солей CuSO4 и ZnSO4 соединены между собой солевым мостиком, образующим
Солевой мостик (электролитический ключ) –это стеклянная трубка, заполненная раствором электролита.
Слайд 46Цинковый электрод является анодом; на нем протекает процесс окисления:
Zn – 2e
Катионы Zn2+ переходят в раствор, вследствие чего раствор приобретает положительный заряд, а электрод – отрицательный.
Zn/Zn2+
Слайд 48Медный электрод является катодом; на нем протекает процесс восстановления :
Cu 2+
Катионы Cu2+ принимают электроны, поступающие из внешней цепи, восстанавливаются и осаждаются на медном электроде. В результате раствор приобретает отрицательный заряд, а электрод – положительный.
Cu/Cu2+
Слайд 50/ обозначает поверхность раздела металл-раствор, а также ОВ потенциал (электродный потенциал),
Слайд 51// обозначают границу раздела двух растворов, а так же диффузионный потенциал,
Слайд 52Катод: Zn – 2e ⇄ Zn2+
Анод: Cu 2+ + 2e ⇄ Cu 1
Zn + Cu2+ ⇄ Zn2+ + Cu
Суммируя уравнения ОВ полуреакций, получаем уравнение суммарной токообразующей реакции:
Слайд 54Кроме ОВ и диффузионных потенциалов существуют мембранные потенциалы, возникновение которых обусловлено
Слайд 56Для каждого проникающего иона мембранный потенциал рассчитывается по уравнению Нернста:
φ =
внутр
среда
Мембранные
Слайд 57 Измерение био-потенциалов лежит в основе электрокардиогра-фии (ЭКГ) и электроэнцефало-графии, представ-ляющих
Слайд 59Химические ГЭ состоят из различных электродов.
Концентрационные элементы состоят из одинаковых электродов
(–)Zn/ZnSO4aq//ZnSO4aq/Zn(+)
СМ(1) СМ(2)
Слайд 60С3Н8 + 5 О2 → 3 СО2 + 4 Н2О
В топливных
Слайд 62КПД водородного элемента составляет не менее 50%.
Областями его использования является
Слайд 63КЛАССИФИКАЦИЯ ГЭ ПО НАЗНАЧЕНИЮ
ГЭ
Химические источники тока
Потенциометри-ческие методы анализа
Слайд 64Открытие ГЭ принадлежит анатому из Болоньи
Слайд 65Алоизо Луиджи Гальвани
(1726 - 1798)
Итальянский врач, анатом и физиолог конца XVIII
Слайд 668.3Потенциометрия – совокупность физико-химических методов анализа, основанных на измерении э.д.с специально
Слайд 68Типы электродов, применяемых в потенциометрии
Электроды 1-го рода – металл, опущенный в
Cu / Cu2+aq; Zn / Zn2+aq
Слайд 70Электроды 2-го рода – металл, покрытый слоем своего труднорастворимого соединения и
Слайд 71Ag,AgCl / KCl(нас)
При его работе протекает ОВ полуреакция:
AgCl + ē
φ= φo – 0,0592 lg[Cl‾]
Устройство и принцип действия хлорсеребряного электрода
Ag,AgCl
KCl
Слайд 72Устройство и принцип действия водородного электрода
Pt, H2/2H+aq
2 H+ + 2 ē
φ=φo+0,0592 lg[H+]
или
φ = – 0,0592 pH,
т.к. φoCВЭ = О
Газовые электроды
Слайд 73Ионоселективные электроды (ИСЭ)
позволяют определять содержание определенного иона в исследуемом растворе,
Слайд 74Стеклянный электрод с водородной функцией
0,1 M HCl
Ag,AgCl
Ag, AgCl /HCl /ст.мембрана
Стеклянная мембрана
Слайд 75Из-за различного содержания Н+ во внутреннем и исследуемом растворах на поверхности
φст = φo + 0,059 lg[H+]
φст = φo – 0,059 pH
Слайд 76Потенциометрическое определение рН растворов
pH-метр
ГЭ элемент состоит из стеклянного электрода (измерительного) и
Слайд 77Ag, AgCl HCl ст. Иссл. KCl AgCl, Ag
мембрана р-р
Схема ГЭ для определения рН
Стеклянный электрод
Хлорсеребряный электрод
Слайд 78Потенциометрическое титрование
- это любой метод титриметрического анализа, в котором точка эквивалентности
Слайд 81Потенциометрические методы анализа позволяют:
анализировать окрашенные растворы, растворы с осадком и гели,
получать
исследовать состав биологических жидкостей человека без их разрушения, путем введения электродов в пораженные органы и ткани.


















![Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста (1889): φОк/Вос = φ0Oк/Вос +RTnFln[Ок][Вос]](/img/tmb/4/374381/9805f1ddade6c6788ef7ef6c5d7e6677-800x.jpg)



![Соответственно:φОк/Вос = φ0Oк/Вос +0,0592 nlg[Ок][Вос]](/img/tmb/4/374381/47dae56ca05e687b91ef54d2aa7a5263-800x.jpg)


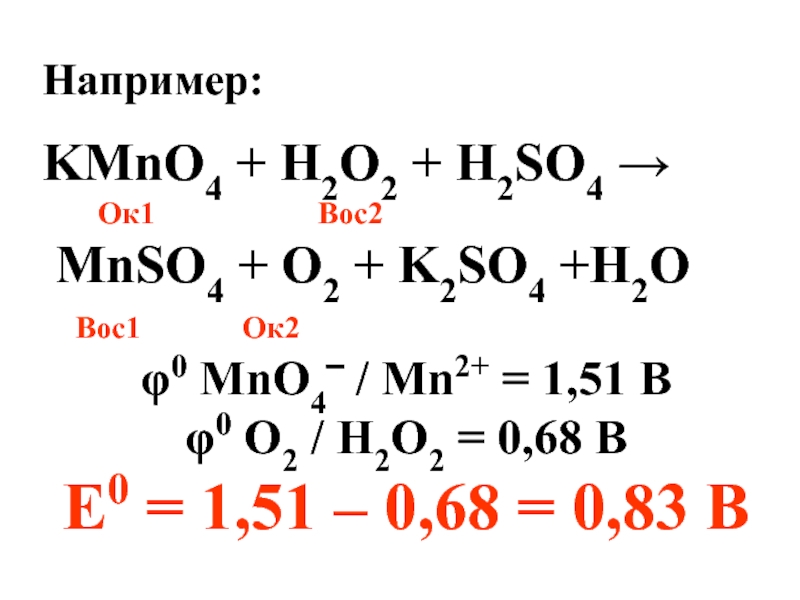

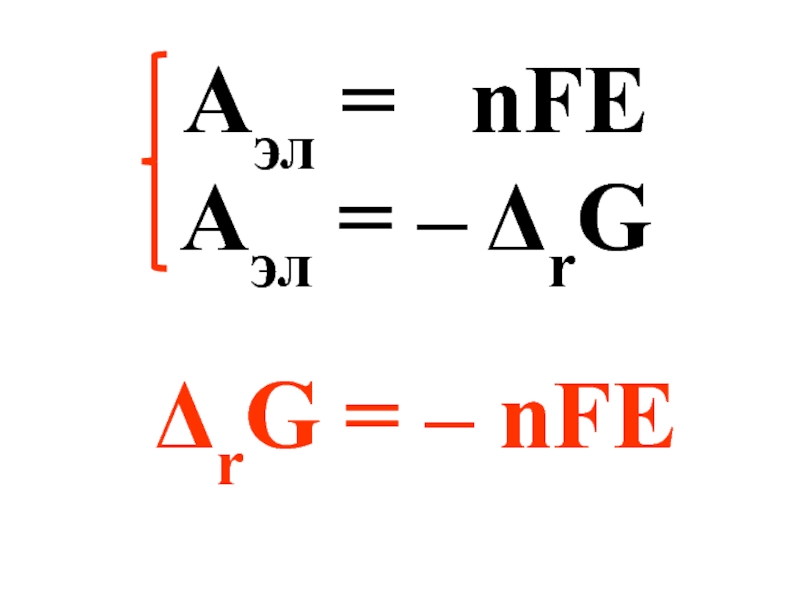


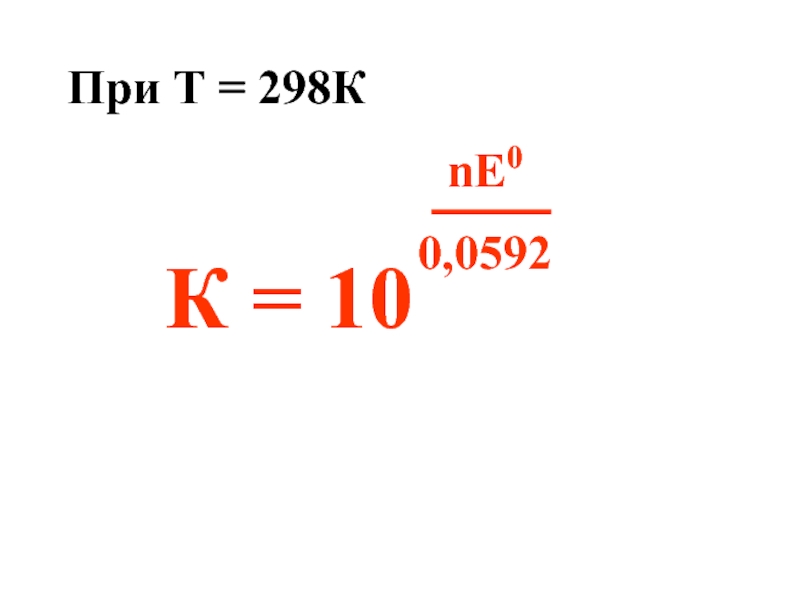



























![φ = φ0 + 0,0592 nlg [Me n+]Men+ - потенциалопределяющий ион](/img/tmb/4/374381/7e88a421b89e91f6dedbf912200b77b5-800x.jpg)


![Устройство и принцип действия водородного электродаPt, H2/2H+aq2 H+ + 2 ē ⇄ H2φ=φo+0,0592 lg[H+] илиφ](/img/tmb/4/374381/3e8bf0ae29629cb769176703d2fba6b4-800x.jpg)