- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов презентация
Содержание
- 1. Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
- 2. Электролиты - вещества, диссоциирующие на ионы при
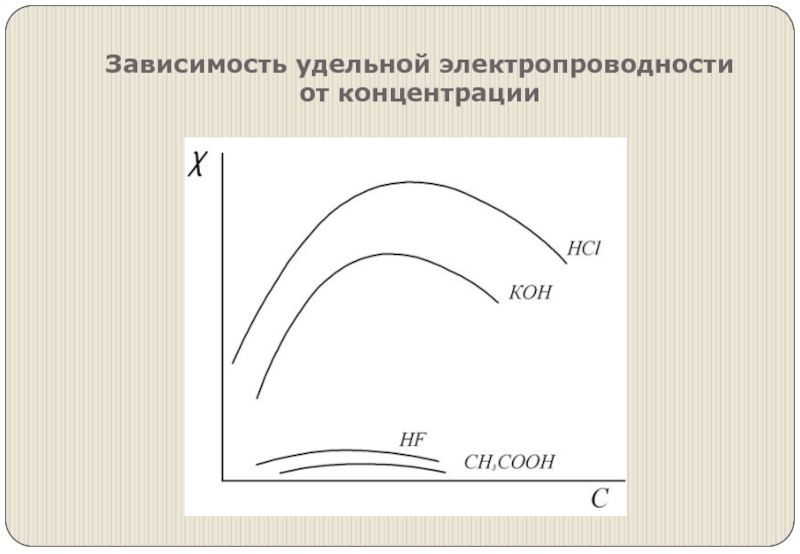
- 4. Зависимость удельной электропроводности от концентрации
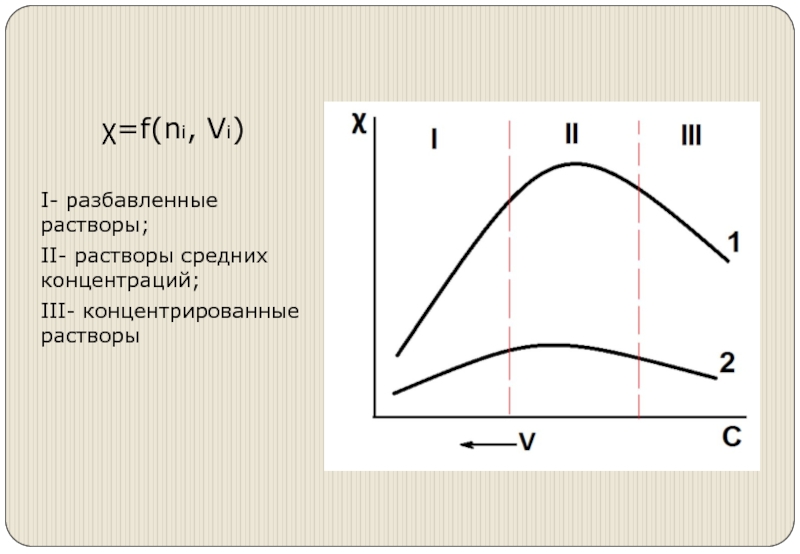
- 5. χ=f(ni, Vi) I- разбавленные растворы; II- растворы средних концентраций; III- концентрированные растворы
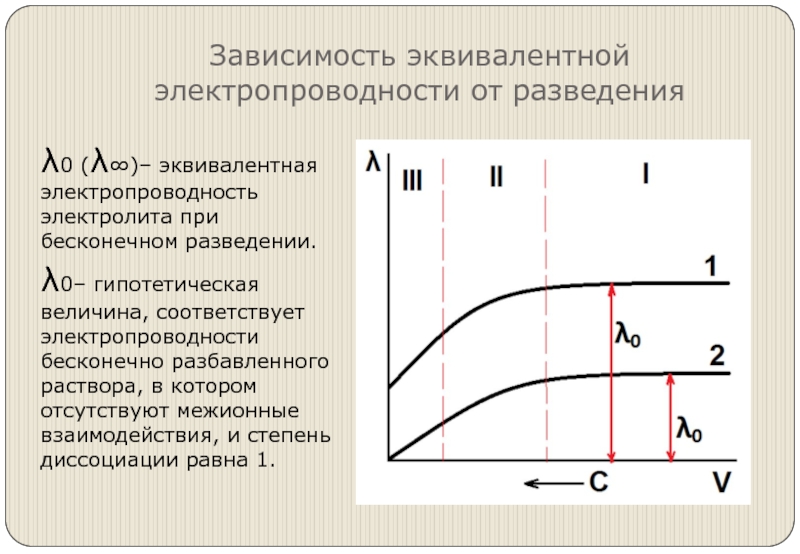
- 8. Зависимость эквивалентной электропроводности от разведения λ0 (λ∞)–
- 10. При бесконечном разведении растворов кулоновские силы исчезают, величины ионных подвижностей стремятся к предельным значениям.
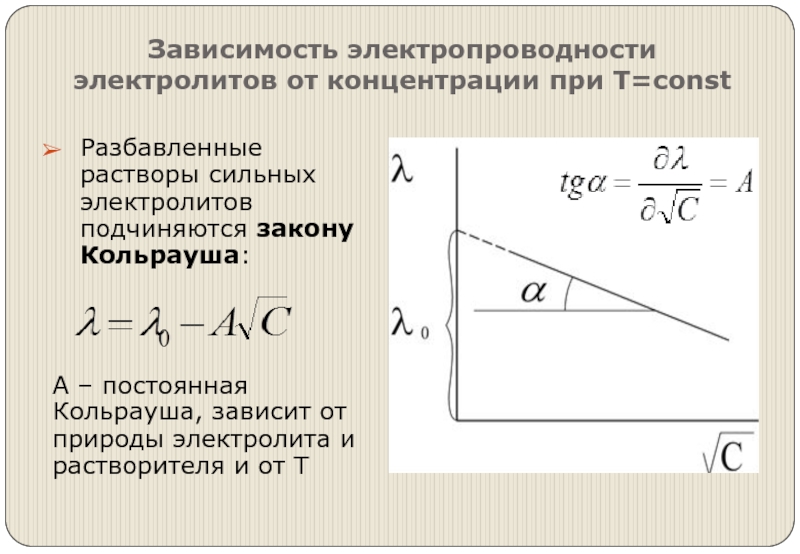
- 11. Зависимость электропроводности электролитов от концентрации при Т=const
- 12. Растворы слабых электролитов подчиняются закону разведения Оствальда.
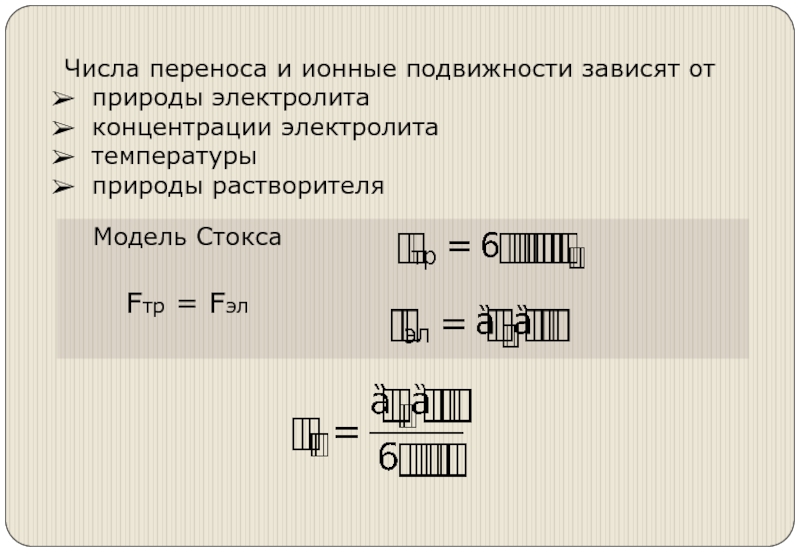
- 15. Движение ионов в электрическом поле. Числа переноса ионов
- 19. Влияние природы электролита (иона и парного иона)
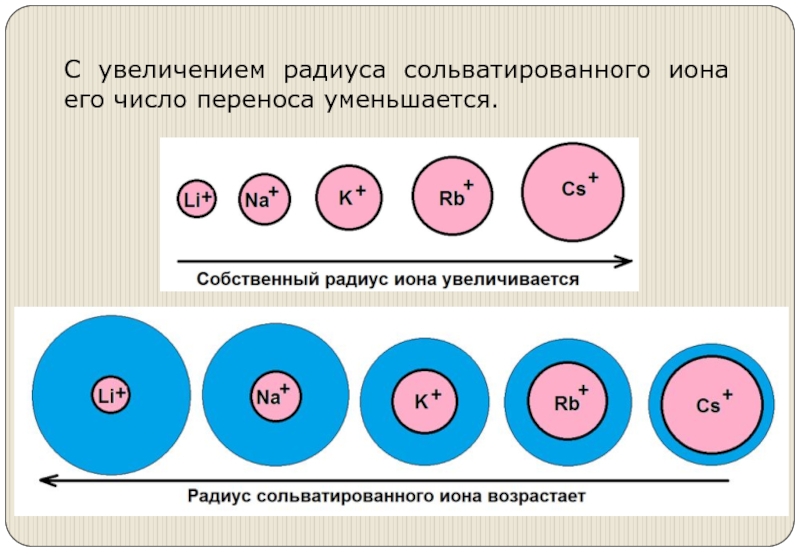
- 20. С увеличением радиуса сольватированного иона его число переноса уменьшается.
- 21. Аномально высокие подвижности и числа переноса имеют
- 23. Влияние температуры. С ростом температуры снижается
- 24. Влияние природы растворителя вязкость растворителя; полярность растворителя
Слайд 2Электролиты - вещества, диссоциирующие на ионы при взаимодействии с растворителем и
сообщающие раствору способность проводить электрический ток.
Слайд 5
χ=f(ni, Vi)
I- разбавленные растворы;
II- растворы средних концентраций;
III- концентрированные растворы
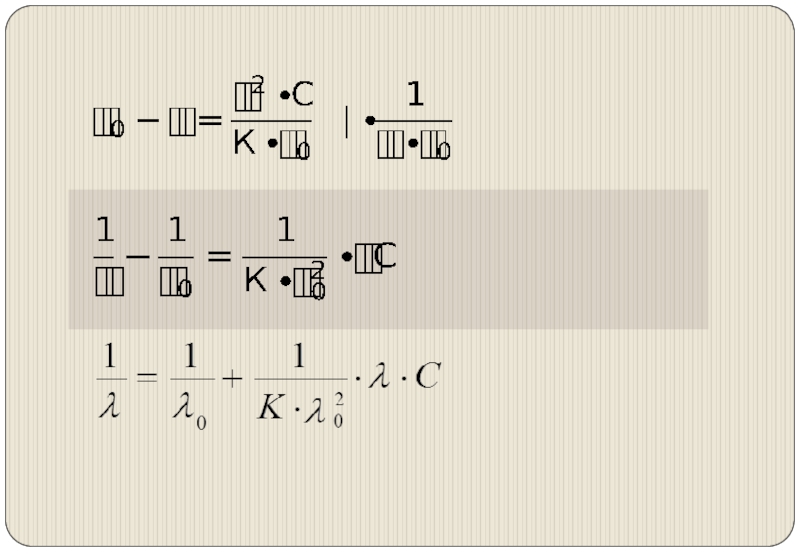
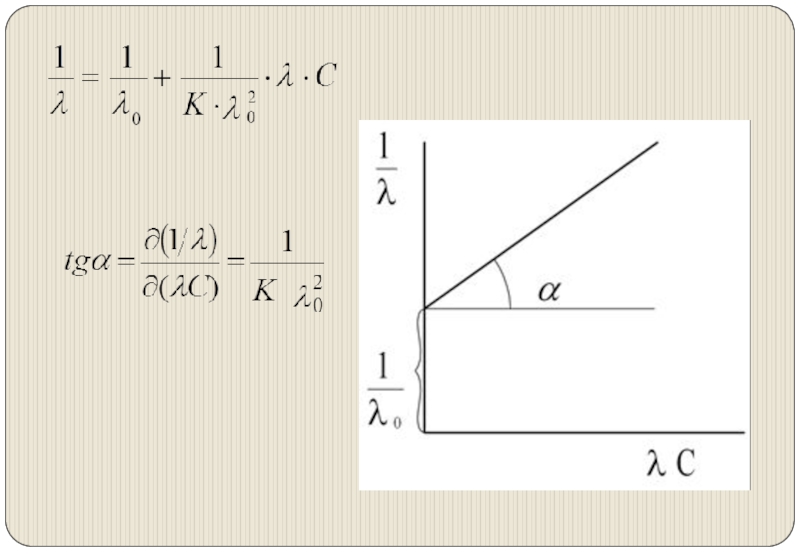
Слайд 8Зависимость эквивалентной электропроводности от разведения
λ0 (λ∞)– эквивалентная электропроводность электролита при бесконечном
разведении.
λ0– гипотетическая величина, соответствует электропроводности бесконечно разбавленного раствора, в котором отсутствуют межионные взаимодействия, и степень диссоциации равна 1.
λ0– гипотетическая величина, соответствует электропроводности бесконечно разбавленного раствора, в котором отсутствуют межионные взаимодействия, и степень диссоциации равна 1.
Слайд 10При бесконечном разведении растворов кулоновские силы исчезают, величины ионных подвижностей стремятся
к предельным значениям.
Слайд 11Зависимость электропроводности электролитов от концентрации при Т=const
Разбавленные растворы сильных электролитов подчиняются
закону Кольрауша:
А – постоянная Кольрауша, зависит от природы электролита и растворителя и от Т
А – постоянная Кольрауша, зависит от природы электролита и растворителя и от Т
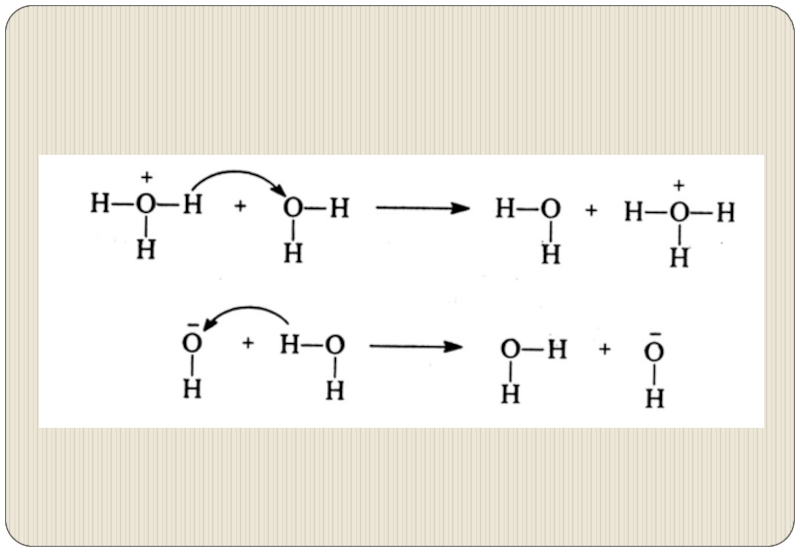
Слайд 21Аномально высокие подвижности и числа переноса имеют Н3О+ и ОН− вследствие
эстафетного механизма переноса протонов Н+.
Происходят перескоки Н+ от иона гидроксония к молекуле воды или от молекулы воды к иону гидроксила в направлении действия электрического поля.
Происходят перескоки Н+ от иона гидроксония к молекуле воды или от молекулы воды к иону гидроксила в направлении действия электрического поля.
Слайд 23
Влияние температуры.
С ростом температуры
снижается вязкость раствора;
происходит десольватация ионов;
числа переноса катиона и
аниона сближаются
Влияние концентрации электролита
Рост концентрации приводит
к усилению межионных взаимодействий;
уменьшению подвижностей и чисел переноса ионов.
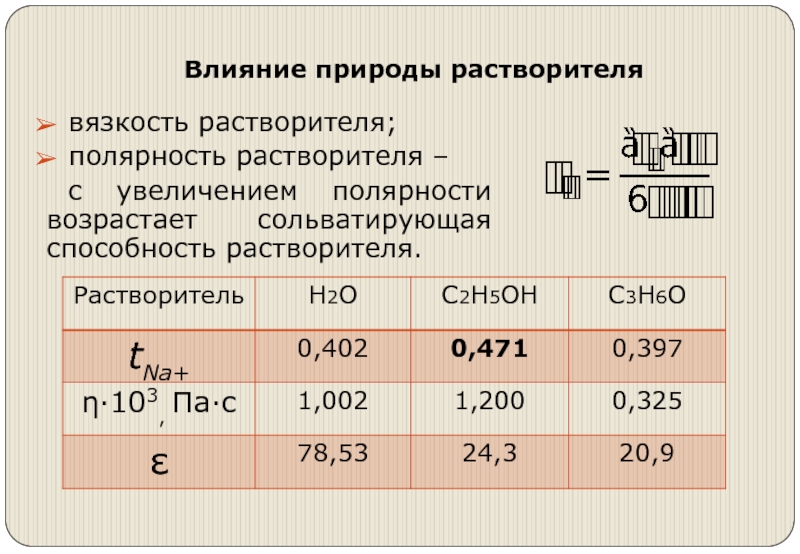
Слайд 24Влияние природы растворителя
вязкость растворителя;
полярность растворителя –
с увеличением полярности возрастает
сольватирующая способность растворителя.