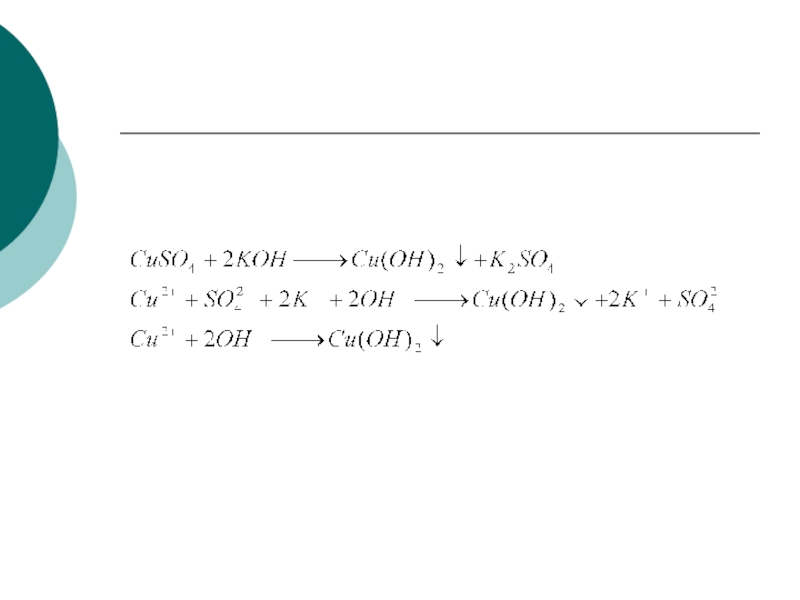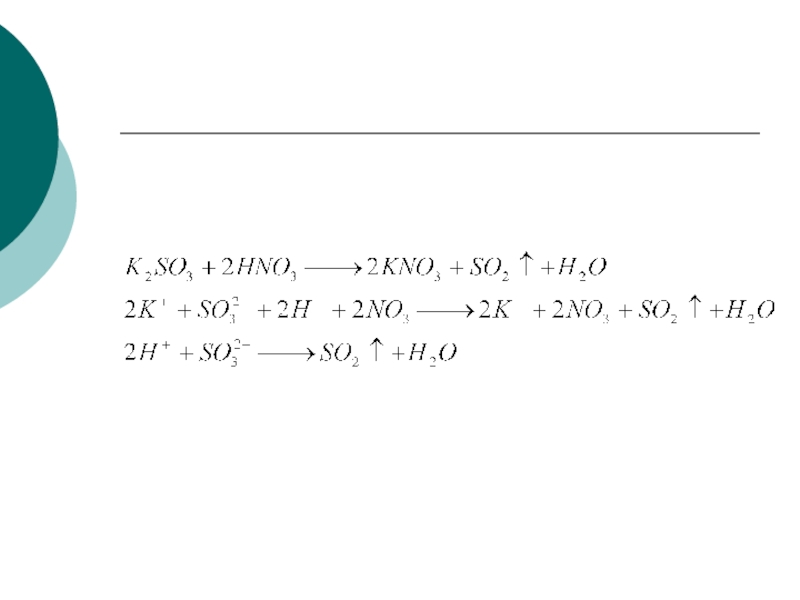- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория растворов электролитов и неэлектролитов презентация
Содержание
- 1. Теория растворов электролитов и неэлектролитов
- 2. С водой необратимо реагируют ………… Распределите
- 3. Численное выражение состава раствора: Процентная концентрация:
- 5. Задача. На нейтрализацию 10 мл раствора гидроксида
- 6. Растворимость – это свойство вещества растворяться
- 7. Подобное растворяется в подобном
- 11. В зависимости от того, проводит ли раствор
- 13. Механизм диссоциации веществ с ионной связью При
- 14. Этапы электролитической диссоциации полярных молекул (а) и
- 16. Теория электролитической диссоциации (ТЭД) (С. А. Аррениус)
- 18. Необходимо отметить! Ионы, в отличие от атомов,
- 20. Определения с позиции ТЭД Кислоты – электролиты,
- 21. Степень диссоциации – отношение числа молекул, распавшихся
- 23. Электролиты по степени диссоциации делятся на сильные,
- 24. Диссоциацию растворов можно зафиксировать количественно, причем это
- 25. Закон разведения Освальда (для слабых электролитов):
- 26. Тогда: или Для слабых электролитов известно, что a
- 27. Реакции ионного обмена Реакции ионного обмена
- 32. Вода – слабый электролит. В чистой воде
- 33. Водородный показатель pH – отрицательный десятичный
Слайд 1Теория растворов электролитов и неэлектролитов
Основные понятия;
Теория электролитической диссоциации;
Водородный показатель pH.
Слайд 2С водой необратимо реагируют …………
Распределите перечисленные оксиды по их кислотно-основным свойствам:
NO2;
Запишите реакцию Al2O3 с щелочью в растворе и при сплавлении
Слайд 3Численное выражение состава раствора:
Процентная концентрация:
Молярная концентрация – отношение количества растворенного
Слайд 5Задача. На нейтрализацию 10 мл раствора гидроксида натрия израсходовали 6 мл
Слайд 6
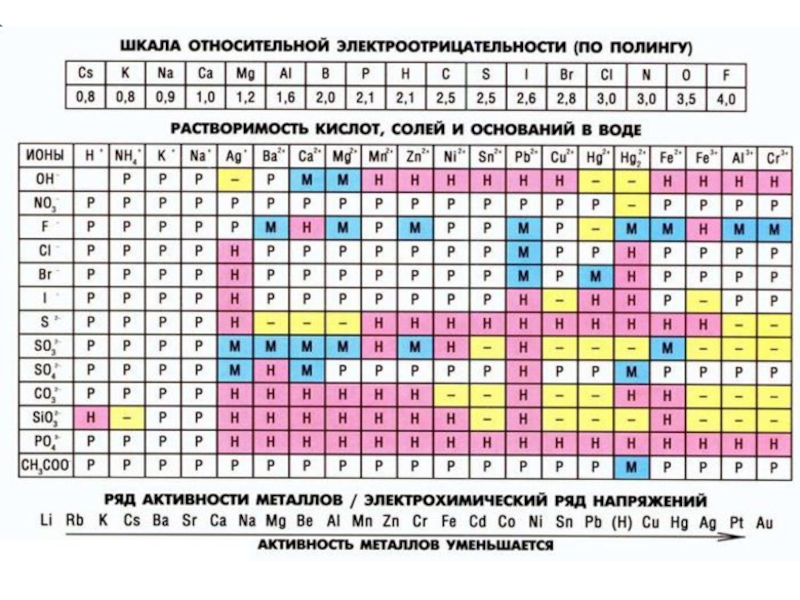
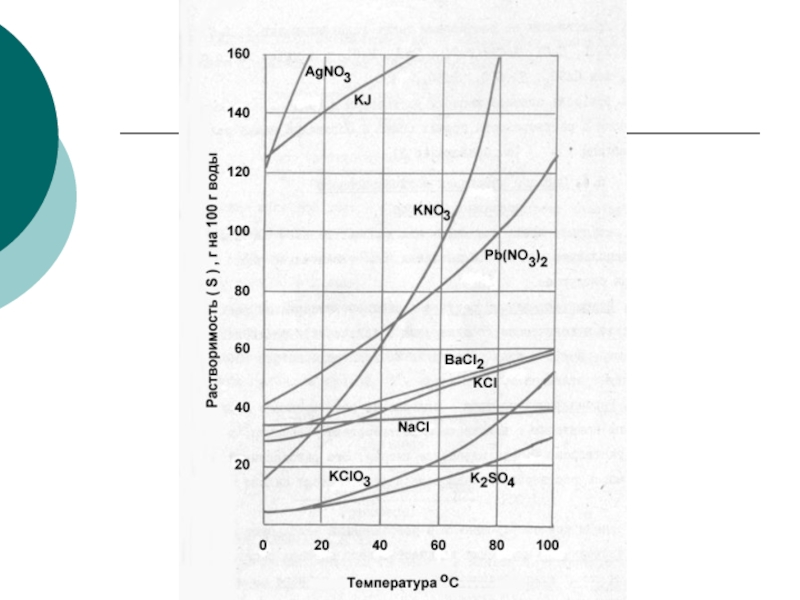
Растворимость – это свойство вещества растворяться в воде или в другом
По растворимости в воде растворы бывают ненасыщенными, насыщенными и перенасыщенными.
Насыщенный раствор – находится в динамическом равновесии с избытком растворенного вещества.
Ненасыщенный раствор – вещества находится меньше при данной температуре, чем в насыщенном растворе.
Количественно растворимость выражается концентрацией насыщенного раствора, т. е. максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре.
Перенасыщенный раствор – вещества находится при данной температуре больше, чем в насыщенном. Эти растворы нестабильны.
Слайд 11В зависимости от того, проводит ли раствор электрический ток или нет,
Электролиты – вещества, распадающиеся на ионы в растворах или расплавах и поэтому проводящие электрический ток (кислоты, основания, соли).
Неэлектролиты – вещества, которые при тех же условиях на ионы не распадаются и не проводят электрический ток (бензол, ацетон, газы, оксиды).
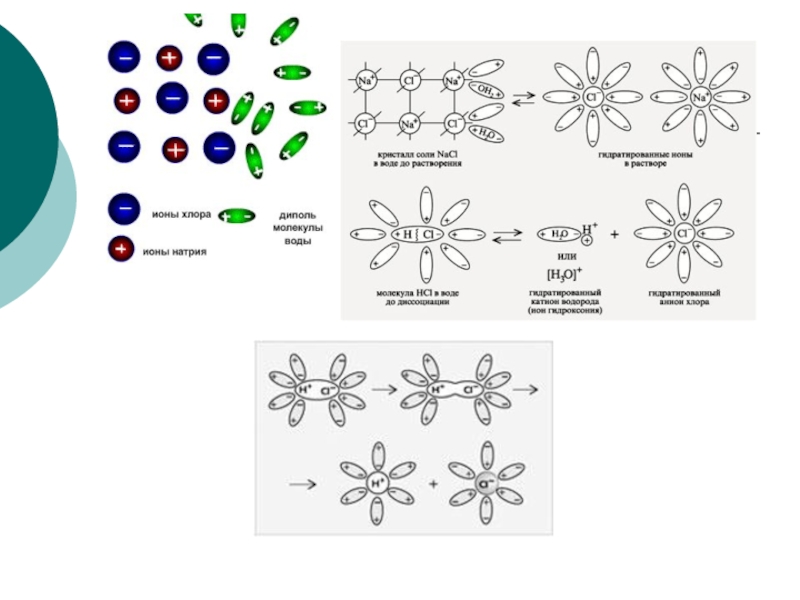
Электролитическая диссоциация – это распад электролитов на ионы при растворении их в воде.
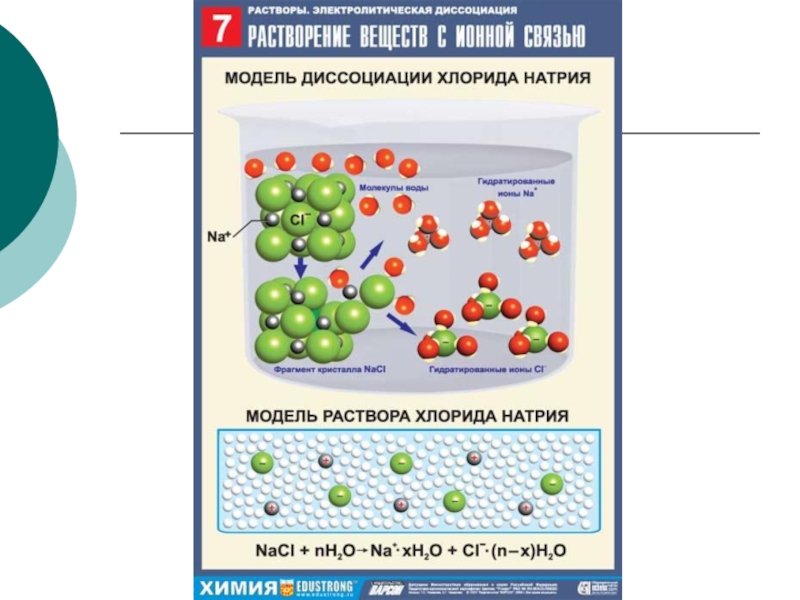
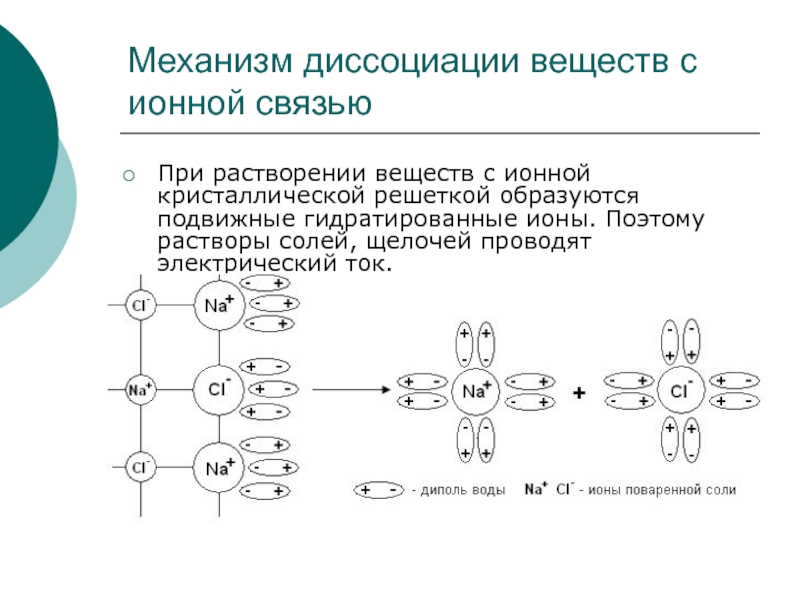
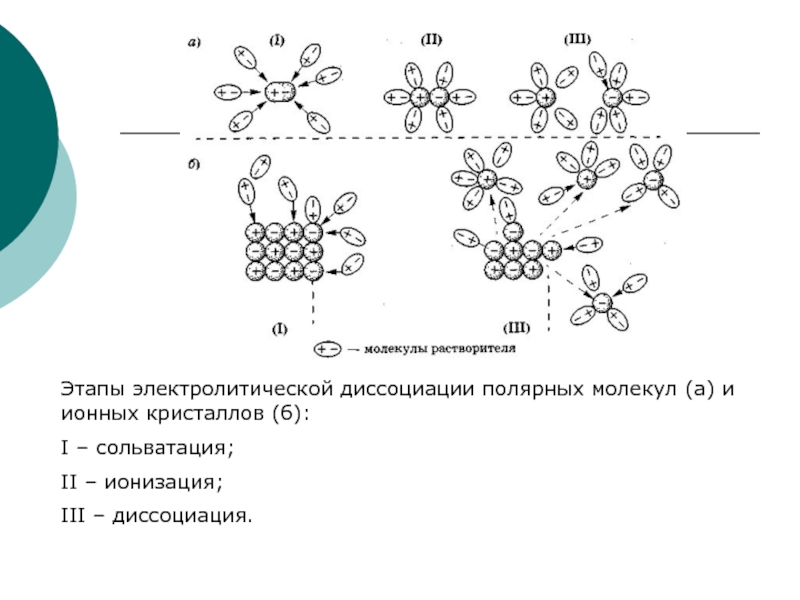
Слайд 13Механизм диссоциации веществ с ионной связью
При растворении веществ с ионной кристаллической
Слайд 14Этапы электролитической диссоциации полярных молекул (а) и ионных кристаллов (б):
I –
II – ионизация;
III – диссоциация.
Слайд 16Теория электролитической диссоциации (ТЭД) (С. А. Аррениус)
Электролиты при растворении в воде
Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду (отрицательному электроду), а анионы – к аноду (положительному электроду);
Диссоциация – процесс обратимый: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Слайд 18Необходимо отметить!
Ионы, в отличие от атомов, имеют завершенные внешние орбиты и
Слайд 20Определения с позиции ТЭД
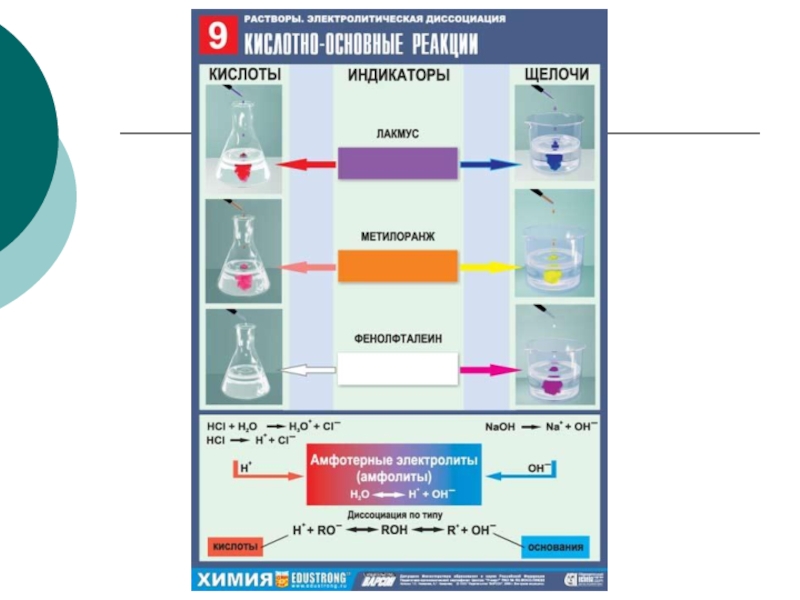
Кислоты – электролиты, которые диссоциируют на катион водорода
Основания – электролиты, которые диссоциируют на катион металла и анион гидроксо-группы (Фенолфталеин становится малиновым, а метилоранж – желтым).
Соли – электролиты, которые диссоциируют на катион металла и анион кислотного остатка.
Слайд 21Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему
a - степень диссоциации (выражается в долях единицы или в процентах);
n – число распавшихся на ионы молекул;
N – общее число растворенных молекул.
Степень диссоциации зависит он концентрации раствора в обратной пропорциональности
Слайд 23Электролиты по степени диссоциации делятся на сильные, средние и слабые:
Сильные электролиты
Слабые электролиты в воде диссоциируют на ионы частично (менее 30%). Таковыми являются слабые кислоты и основания;
Слайд 24Диссоциацию растворов можно зафиксировать количественно, причем это будет постоянная для каждого
Константа диссоциации – сильные электролиты диссоциируют полностью, и равновесие смещается в сторону образовавшихся ионов. В растворах слабых электролитов равновесие смещается в сторону образования молекул:
Константа диссоциации зависит от природы электролита, температуры, но не зависит от концентрации раствора.
Слайд 25Закон разведения Освальда (для слабых электролитов):
«Степень диссоциации слабых электролитов прямопропорциональна
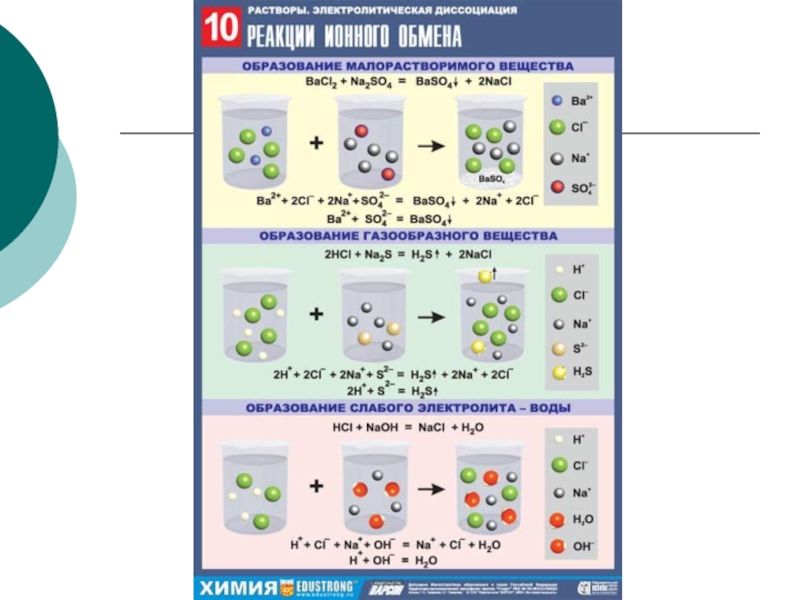
Слайд 27Реакции ионного обмена
Реакции ионного обмена – это реакции, протекающие между
образуется осадок
образуется легколетучее соединение (газ)
образуется малодиссициирующее вещество (например, вода)
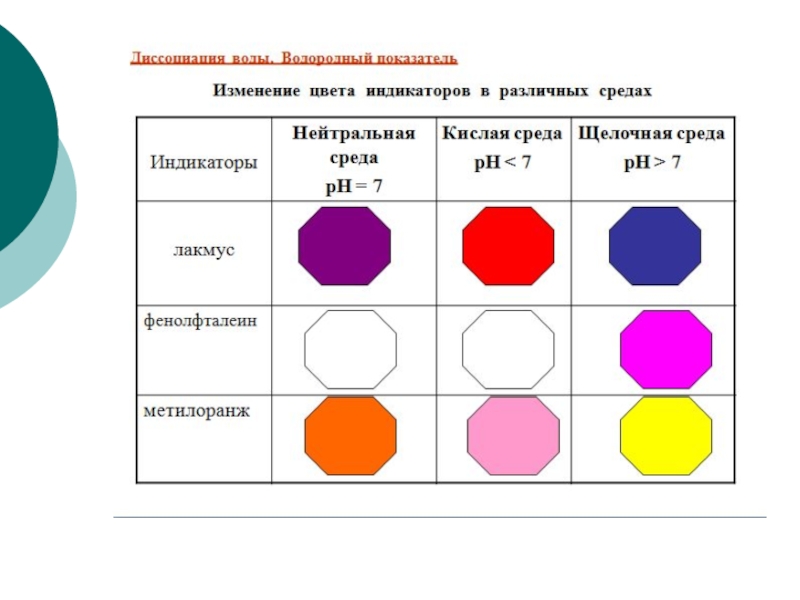
Слайд 32Вода – слабый электролит. В чистой воде существует равновесие:
Образование катиона или
или