Естайлақ Ақгүл Абусағитқызы
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бензол молекуласында байланыстардың түзілу сызбанұсқасы презентация
Содержание
- 1. Бензол молекуласында байланыстардың түзілу сызбанұсқасы
- 2. Бензол және оның қасиеті
- 3. Ашылу тарихы Бензолды алғаш алған неміс химигі
- 4. Екінші рет ашылуы Бензолды 1825 ж.
- 5. Жаңадан алынуы Неміс физико-химигі Эйльгард
- 6. Бензолдың құрылысы Кекуле 1865 ж.бензолдың циклді формуласын
- 7. Бензол молекуласында байланыстардың түзілу сызбанұсқасы
- 8. Квантомеханикалық теория және бензол молекуласы Неміс химигі
- 9. Физикалық қасиеттері Бензолдың гомлогтық қатарының төменгі өкілдері,
- 10. Химиялық қасиеттері 1.Бензолдың жануы: 2С6Н6 +
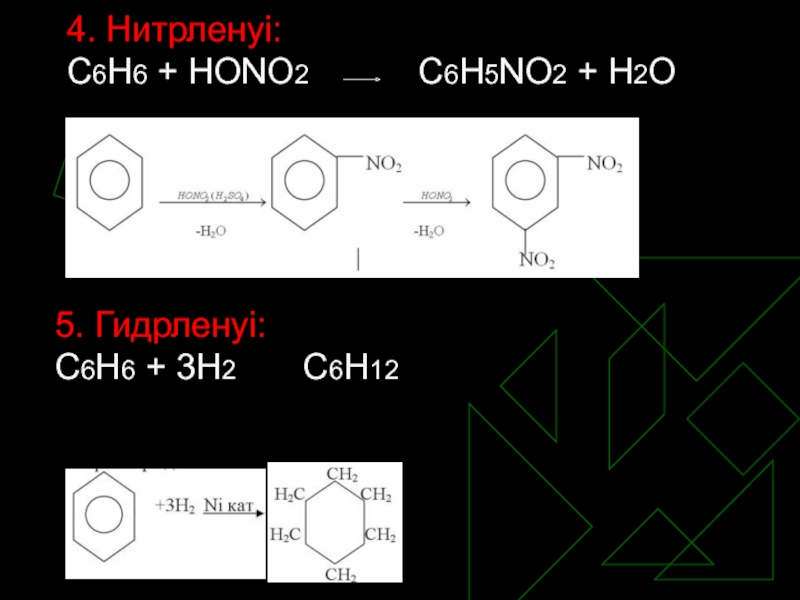
- 11. 4. Нитрленуі: С6Н6 + НОNО2
- 12. Алынуы Бензолды тас көмір шайырын айдап алады
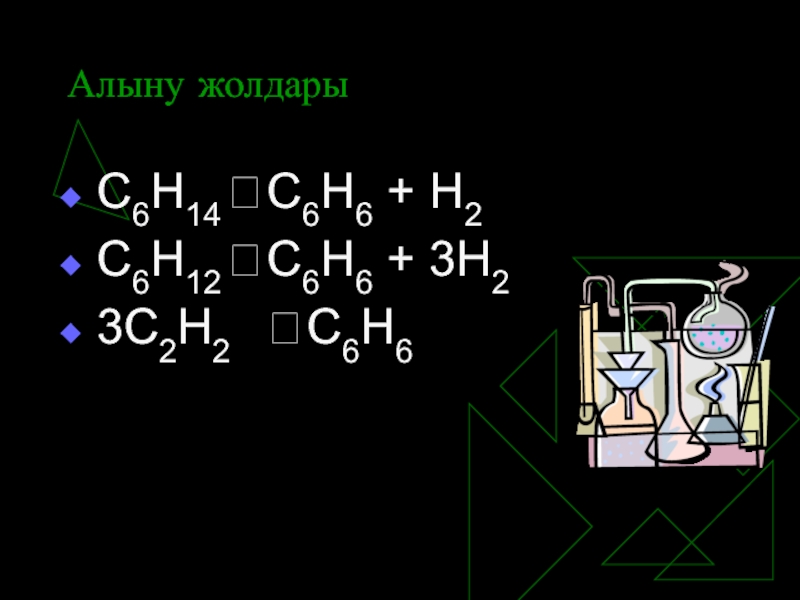
- 13. Алыну жолдары С6Н14 ? С6Н6 + Н2 С6Н12 ? С6Н6 + 3Н2 3С2Н2 ? С6Н6
- 14. Табиғи шикізаттары: Табиғи және серік газдар Мұнай Тас көмір
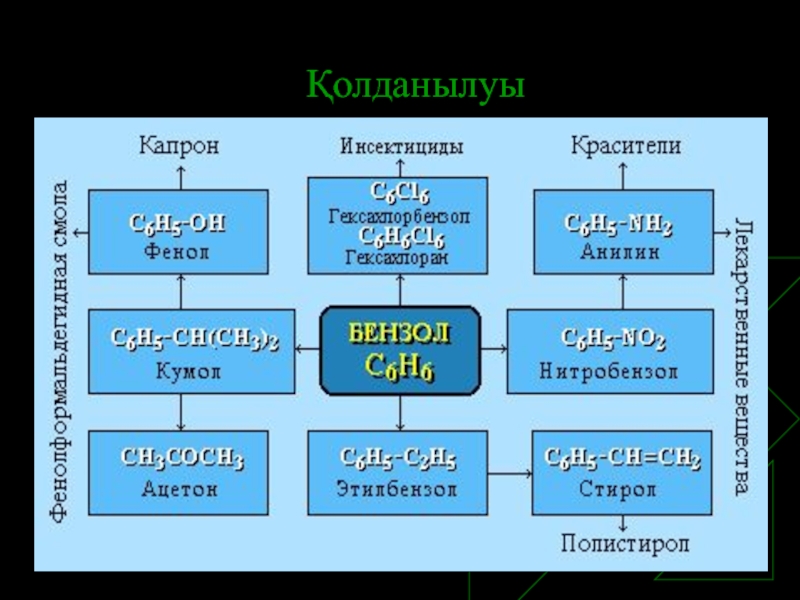
- 15. Қолданылуы
Слайд 1Қостанай облысы
Жангелдин ауданы
Аралбай ауылы
Жангелдин орта мектебінің
Химия-биология пәні мұғалімі
Слайд 3Ашылу тарихы
Бензолды алғаш алған неміс химигі Иоганн Глаубер. Ол 1649 жылы
бұл қосылысты тас-көмір қосылысын айдау кезінде алды.Бірақ қосылыстың аты да, құрылысы да белгісіз болды.
Слайд 4Екінші рет ашылуы
Бензолды 1825 ж. М.Фарадей жарық газын зерттей отырып,
соның құрамынан тапқан.
Слайд 5Жаңадан алынуы
Неміс физико-химигі Эйльгард Митчерлих 1834 ж. бензой қышқылын
құрғақ айдау арқылы бензолды алған. Осыдан бензол атауы шыққан.
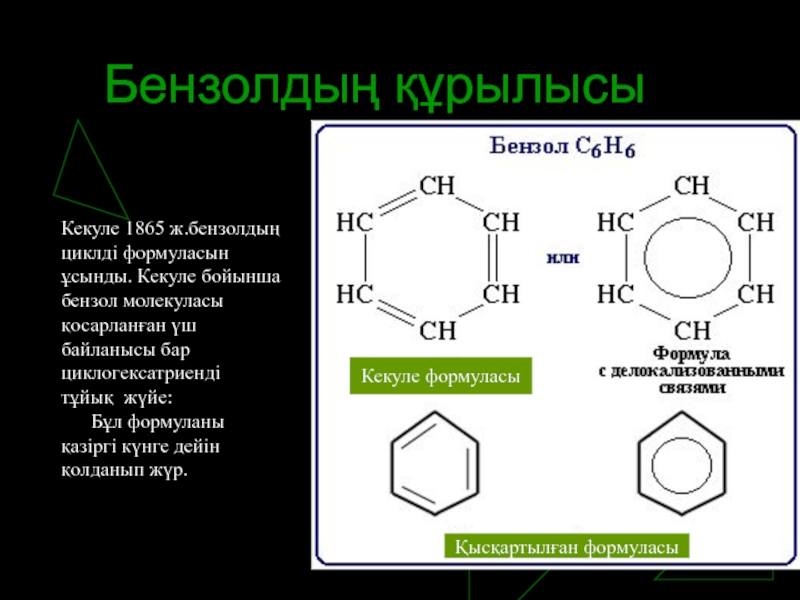
Слайд 6Бензолдың құрылысы
Кекуле 1865 ж.бензолдың циклді формуласын ұсынды. Кекуле бойынша бензол молекуласы
қосарланған үш байланысы бар циклогексатриенді тұйық жүйе:
Бұл формуланы қазіргі күнге дейін қолданып жүр.
Бұл формуланы қазіргі күнге дейін қолданып жүр.
Қысқартылған формуласы
Кекуле формуласы
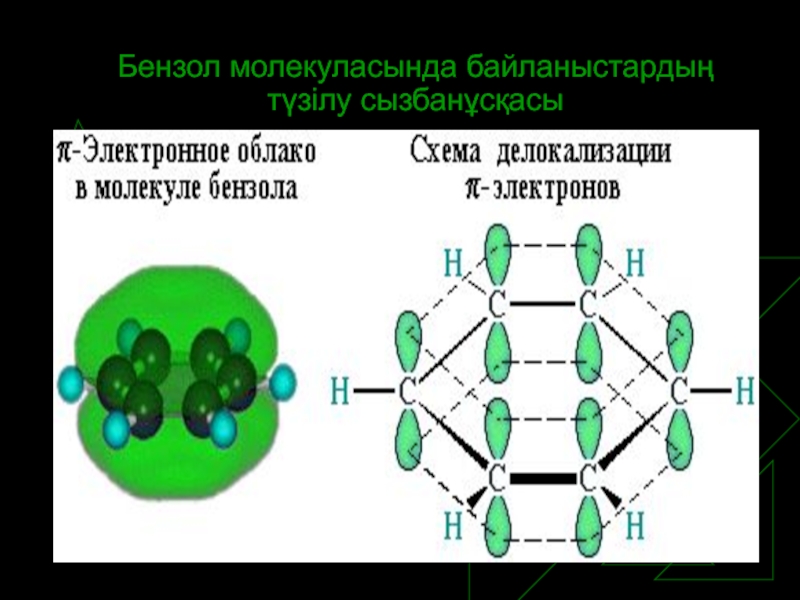
Слайд 8Квантомеханикалық теория және бензол молекуласы
Неміс химигі Э. Хюккель ароматтық қосылыстарға квантомеханикалық
теорияны қолданып бензолдың алты п-электроны кеңістікте орналасып, тұйық электрон бұлты пайда болатынын көрсетті
Слайд 9Физикалық қасиеттері
Бензолдың гомлогтық қатарының төменгі өкілдері, негізінен сұйықтық болады.Оның молекулалық массасы
өскен сайын қайнау температурасы да, артады, орта-изомерлер, әдетте, пара-изомерлерге қарағанда жоғары температурада қайнайды.
Бензолдың қайнау температурасы (80,10С) гексанның қайнау температурасынан (68,80С) жоғары.
Симметриялы құрылысты изомерлердің балқу температурасы жоғарырақ болып келеді. Екі орынбасарлары изомерлердің ішінде-пара-изомер ең жоғары температурада балқиды.
Май қатары мен алициклді қатар көмірсутектерден тығыздығы және жарық сындыру көрсеткіштері анағұрлым жоғары.
Бензол қатарындағы ароматты көмірсутектер судан жеңіл, суда ерімейді, ал көптеген органикалық еріткіштерде жақсы ериді.Олардың буымен ұзақ уақыт тыныс алғанда адам уланады.
Бензолдың қайнау температурасы (80,10С) гексанның қайнау температурасынан (68,80С) жоғары.
Симметриялы құрылысты изомерлердің балқу температурасы жоғарырақ болып келеді. Екі орынбасарлары изомерлердің ішінде-пара-изомер ең жоғары температурада балқиды.
Май қатары мен алициклді қатар көмірсутектерден тығыздығы және жарық сындыру көрсеткіштері анағұрлым жоғары.
Бензол қатарындағы ароматты көмірсутектер судан жеңіл, суда ерімейді, ал көптеген органикалық еріткіштерде жақсы ериді.Олардың буымен ұзақ уақыт тыныс алғанда адам уланады.
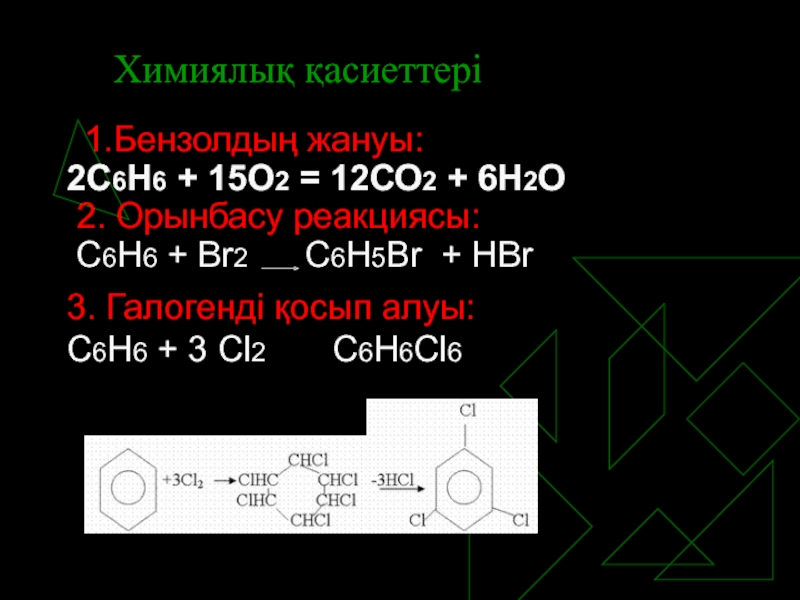
Слайд 10Химиялық қасиеттері
1.Бензолдың жануы:
2С6Н6 + 15О2 = 12СО2 + 6Н2О
2.
Орынбасу реакциясы:
С6Н6 + Br2 C6H5Br + HBr
С6Н6 + Br2 C6H5Br + HBr
3. Галогенді қосып алуы:
С6Н6 + 3 Cl2 C6H6Cl6
Слайд 12Алынуы
Бензолды тас көмір шайырын айдап алады
Қазіргі уақытта бензолды мұнайдан алады.
Бензолды жасанды
жолмен алады