- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) презентация
Содержание
- 1. Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
- 2. Целью дисциплины является изучение теоретических основ химико-технологических
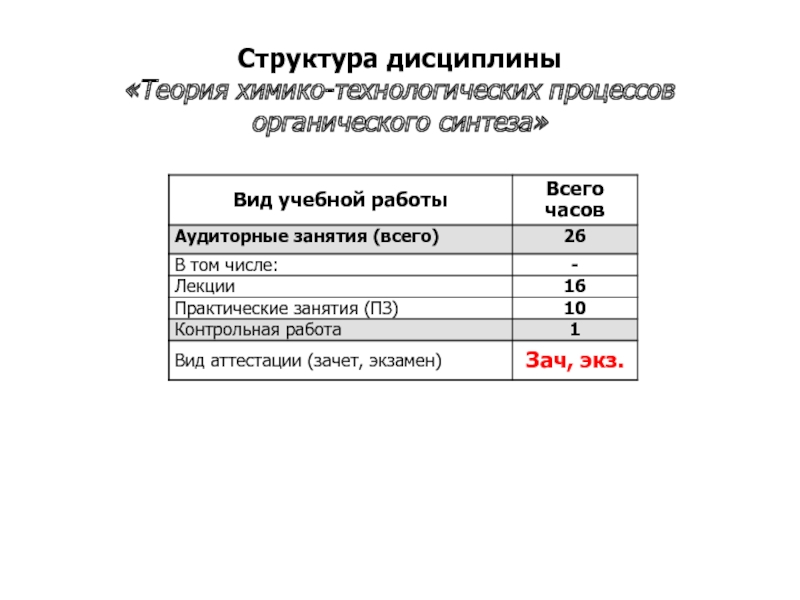
- 3. Структура дисциплины «Теория химико-технологических процессов органического синтеза»
- 4. Основная: Сайкс П. Механизмы реакций в
- 5. ЛИТЕРАТУРА Дополнительная: Лисицин В.Н. Химия и
- 6. Эмануэль Н.И., Кнорре Д.Г. Курс химической кинетики.
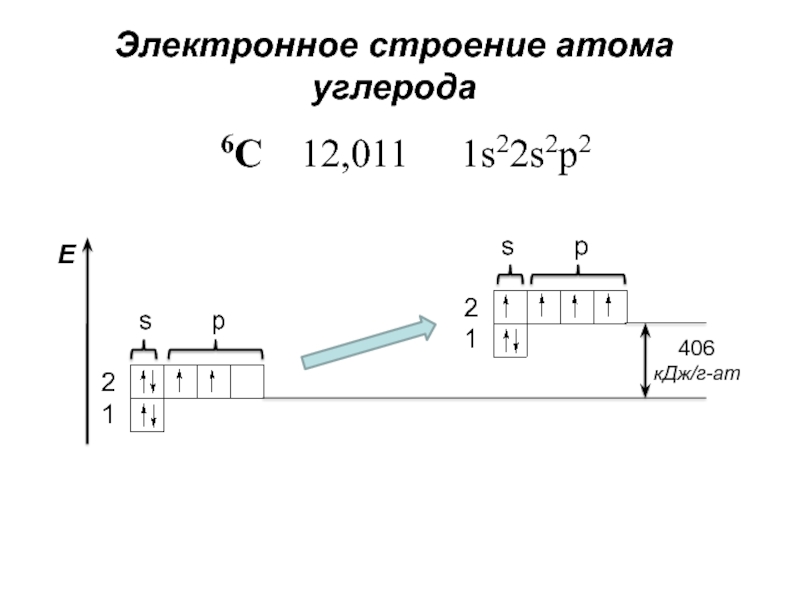
- 7. ВВЕДЕНИЕ
- 8. s p
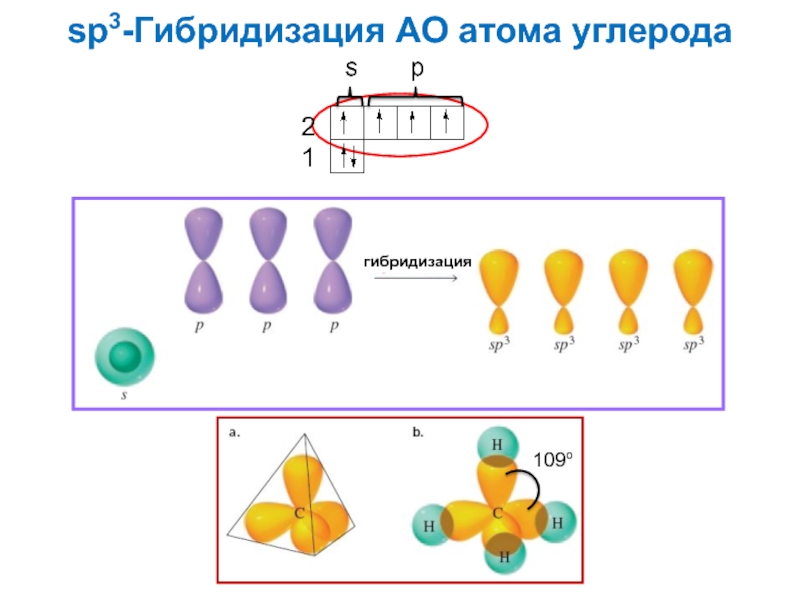
- 9. sp3-Гибридизация АО атома углерода
- 10. Взаимодействие sp3 гибридизованных АО с образованием
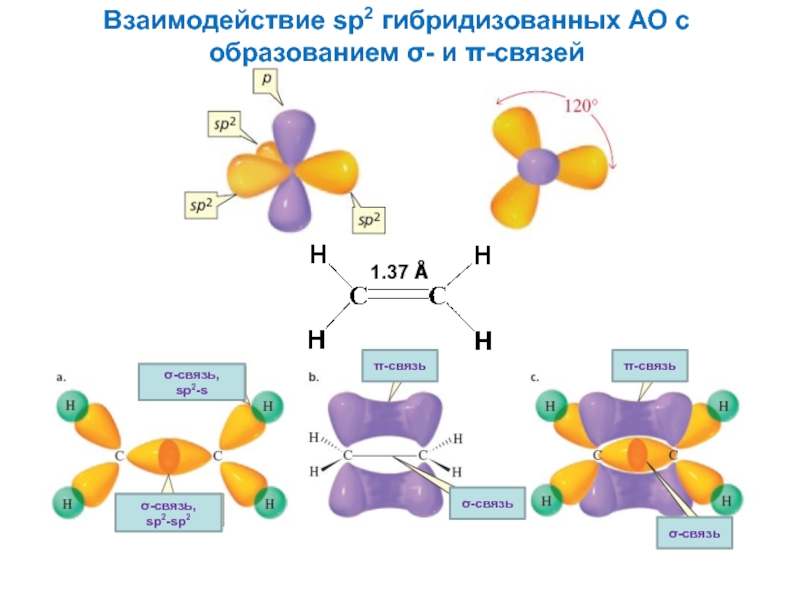
- 11. Взаимодействие sp2 гибридизованных АО с образованием
- 12. Взаимодействие sp1 гибридизованных АО с образованием
- 13. Взаимодействие 2pz орбиталей с образованием
- 14. Взаимодействие 2pz орбиталей с образованием сопряженных
- 15. СОПРЯЖЕНИЕ Формальным признаком сопряжения является чередование одинарных и двойных связей. гексатриен-1,3,5 бензол
- 16. СОПРЯЖЕНИЕ Формальным признаком сопряжения является
- 17. Свойства π-орбиталей Боковое перекрывание рz-АО; Эффективность
- 18. Фридрих Август Кекуле фон Штрадониц (нем. Friedrich August
- 19. Одним из фундаментальных понятий органической
- 20. Энергетические критерии Основаны на сравнении
- 21. Однако этот подход оказался неприемлемым,
- 22. Эти характеристики позволяют выстроить
- 23. Для удобства сравнения молекул с
- 24. Геометрические критерии Основаны на способности
- 25. Это недостаток был учтен при
- 26. Это уравнение можно разбить на составляющие:
- 27. Таблица. Значения НОМА органических соединений, рассчитанные на
- 28. Магнитные критерии В ароматической
- 29. [18]Аннулен имеет 2 сигнала в спектре 1Н ЯМР: 9,25 и -2,88 м.д. -2,88 9,25
- 30. В 1996 Шлейером с соавторами
- 31. Таблица. Вычисленные значения критерия ароматичности NICS (м.д.)
- 32. n=0 => 2π-электрона катион циклопропенилия
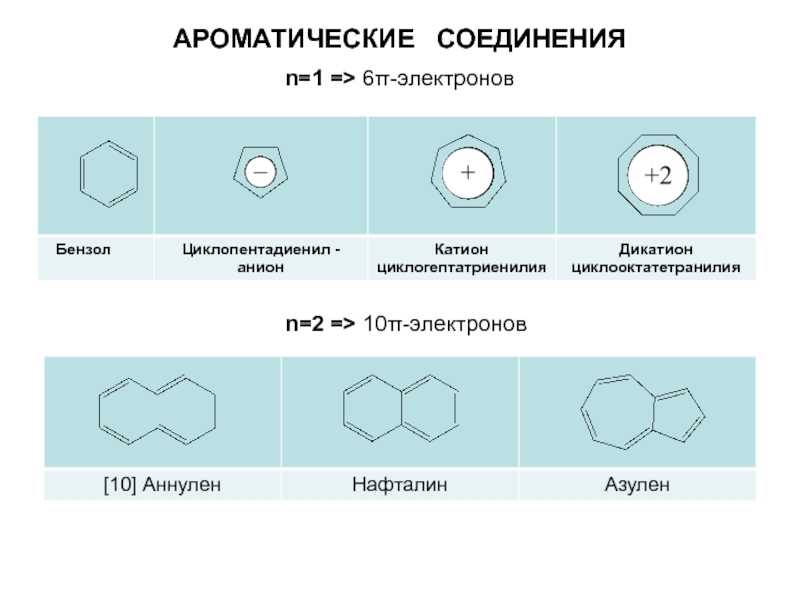
- 33. n=1 => 6π-электронов АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ n=2 => 10π-электронов
- 34. n=3 => 14π-электронов АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
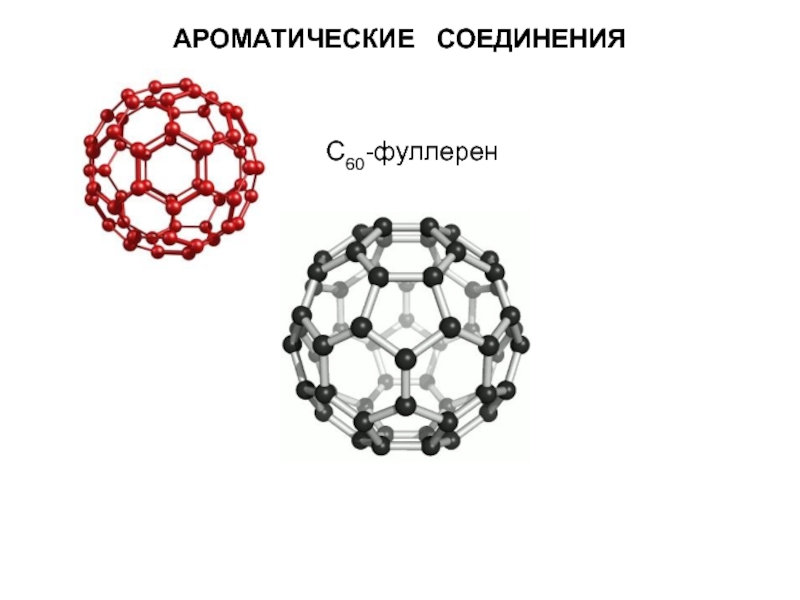
- 35. С60-фуллерен АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- 36. Фуллерен C540 АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
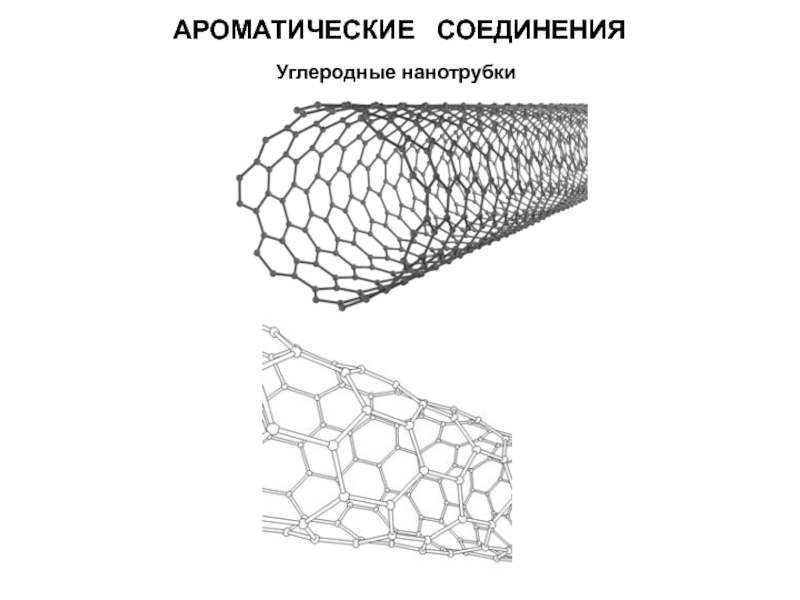
- 37. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ Углеродные нанотрубки
- 38. Является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную решётку. ГРАФЕН АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- 39. Science 22 October 2004: Vol. 306 no. 5696 pp. 666-669
- 40. 5 октября были удостоены Нобелевской премии в области физики
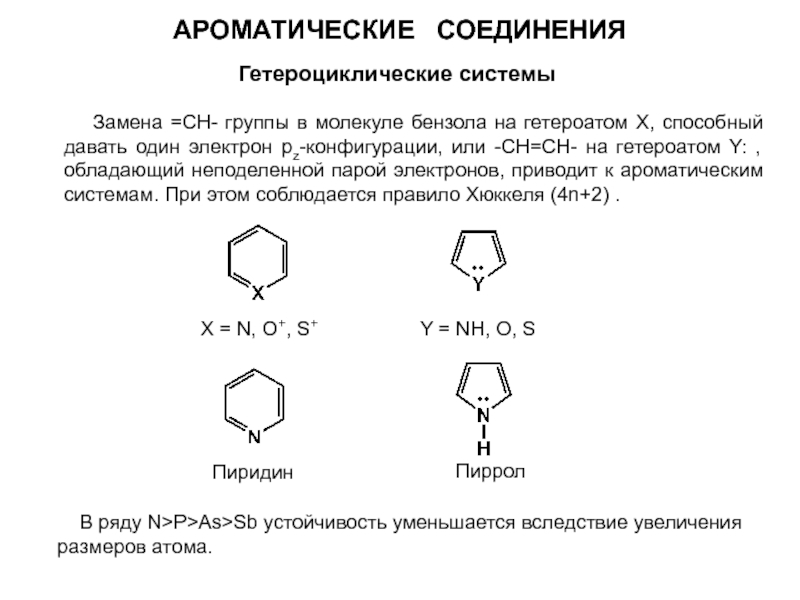
- 41. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ Гетероциклические системы
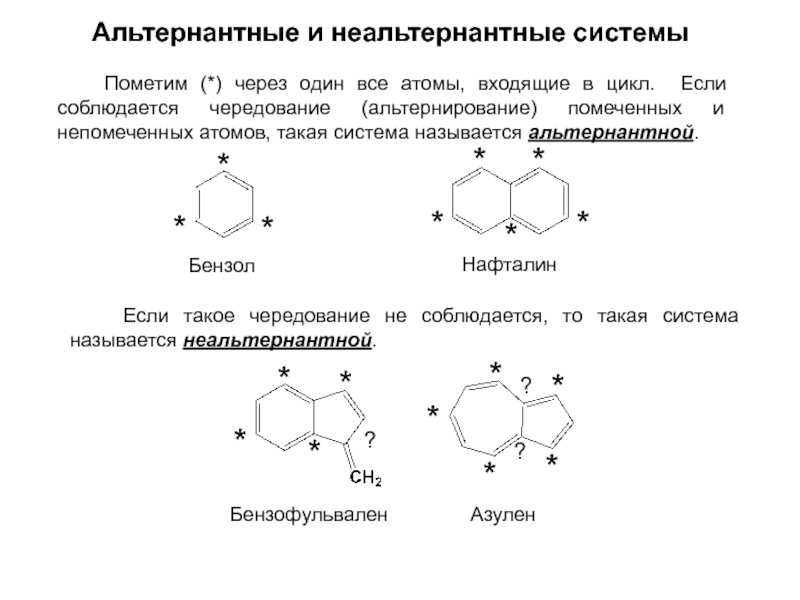
- 42. Альтернантные и неальтернантные системы * * *
Слайд 1ТЕОРИЯ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ
ПРОЦЕССОВ ОРГАНИЧЕСКОГО СИНТЕЗА
Проф., д.х.н. Исляйкин Михаил Константинович
В работе над
Слайд 2Целью дисциплины является изучение теоретических основ химико-технологических процессов тонкого органического, основного
- Механизмы органических реакций.
- Кинетика и термодинамика органических реакций.
- Теоретические основы катализа.
Теоретический курс включает три раздела:
Слайд 4
Основная:
Сайкс П. Механизмы реакций в органической химии. М.: Химия, 1991. -
Лебедев Н.Н., Манаков М.Н., Швец В.Ф. Теория химических процессов основного органического и нефтехимического синтеза. – М.: Химия, 1984. – 376 с. http://www.twirpx.com/file/105004/
Кудрик Е.В., Колесников Н.А., Любимцев А.В. Теория химико-технологических процессов органического синтеза. Часть 1. Механизмы органических реакций. / Под ред. Г.П.Шапошникова. Иван. Гос. Хим.-технол. Ун-т. 2004. 156с.
Потехин В.М., Потехин В.В. Основы теории химических процессов технологии органических веществ и нефтепереработки. – СПб.: Химиздат, 2007. – 944 с.
Кудрик Е.В. Вопросы для самоконтроля и варианты контрольных заданий по дисциплине «Теория химико-технологических процессов в органическом синтезе» для студентов специальности 2501 очной и заочной форм обучения: Методические указания для самостоятельной работы студентов / Сост. Е.В. Кудрик; Под. ред. Г.П. Шапошникова. Иван. гос. хим.-технол. ун-т. – Иваново, 2004, 28с.
№ 918.
ЛИТЕРАТУРА
Слайд 5ЛИТЕРАТУРА
Дополнительная:
Лисицин В.Н. Химия и технология промежуточных продуктов. - М.: Химия, 1987.
Лисицын В.Н. Химия и технология ароматических соединений. Учебное пособие. М.: ДеЛи принт. 2014, 391 с.
Магерил Р.З., Магерил Е.Р. Теоретические основы химико-технологических процессов: учеб. пособие. 3-изд. – М.: ИД КДУ, 2013. – 92 с. 66 М123.
Эфрос Л.С., Квитко И.Я. Химия и технология ароматических соединений в задачах и упражнениях. Л.: Химия, 1984.
Теоретические основы органической химии; Строение, реакционная способность и механизмы реакций органических соединений: Учебник / А. С. Днепровский, Т. И. Темникова. – 2-е изд., перераб. – Л.: Химия, 1991. – 560 с.
Пассет Б.В. Основные процессы химического синтеза биологически активных веществ.: Учебник. – М.: ГЭОТАР-МЕД, 2002. 376с.
Исляйкин, М.К. Применение квантово-химических методов для описания свойств органических соединений: метод. указания/ М.К.Исляйкин; Иван. гос. хим.-технол. ун-т - Иваново 2005. -44 с.
Слайд 6Эмануэль Н.И., Кнорре Д.Г. Курс химической кинетики. М.: ВШ, 1984. 464c.
Жоров
Жоров Ю.М. Кинетика промышленных органических реакций. – М.: Химия, 1989. – 384 с.
Бочкарев В.В. Теория химико-технологических процессов органического синтеза. Гетерофазные и гетерогенно-каталитические реакции. Учеб. пособие. Томск: изд. ТПУ, 2005. – 118 с. http://portal.tpu.ru/SHARED/s/STASYA_LS/i_work/tcp/Tab1/educational_supplies.pdf
Интернет-ресурсы: http://rushim.ru/books/books.htm; www.xumuk.ru.
Слайд 10Взаимодействие sp3 гибридизованных АО с
образованием σ-связи (H3C-CH3 – этан)
1.54 Å
Разрыхляющая
Связывающая МО
sp3 АО
sp3 АО
Энергия
Слайд 11Взаимодействие sp2 гибридизованных АО с
образованием σ- и π-связей
σ-связь,
sp2-sp2
σ-связь,
sp2-s
σ-связь
σ-связь
π-связь
π-связь
1.37 Å
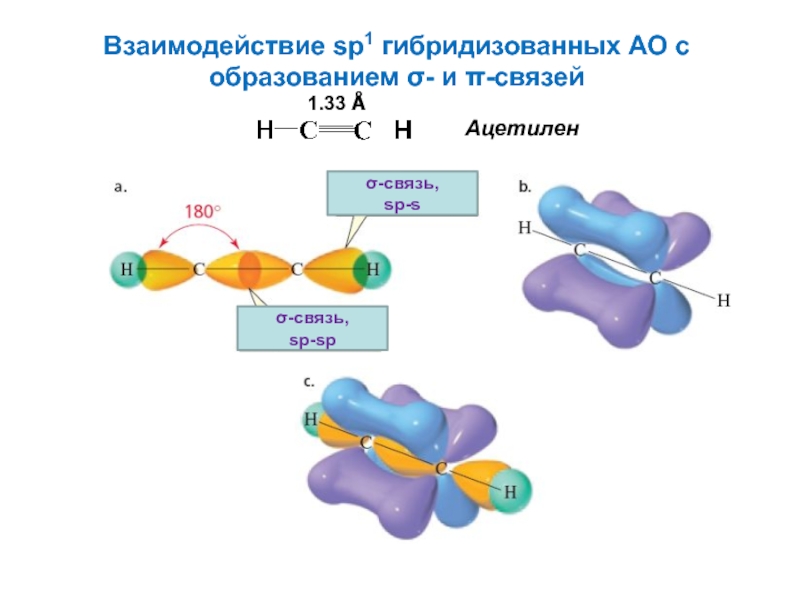
Слайд 12Взаимодействие sp1 гибридизованных АО с
образованием σ- и π-связей
Ацетилен
σ-связь,
sp-sp
σ-связь,
sp-s
1.33 Å
Слайд 13
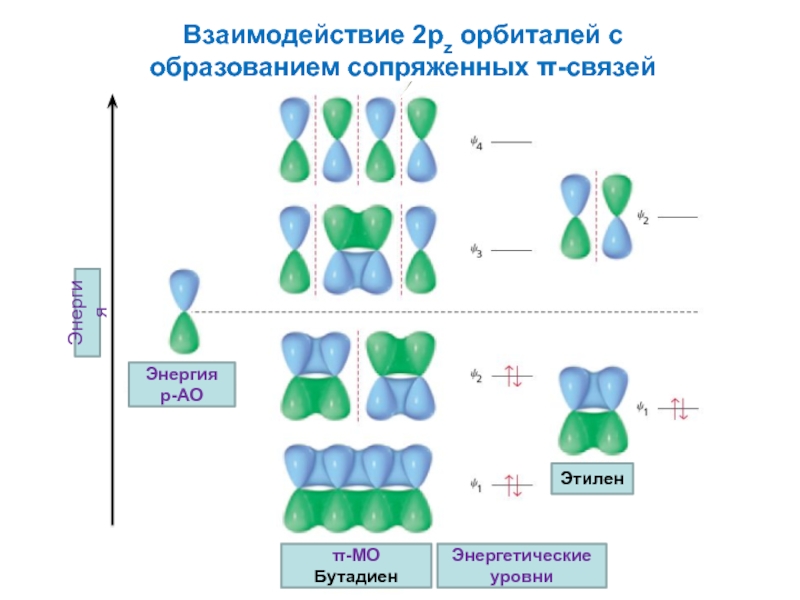
Взаимодействие 2pz орбиталей с
образованием сопряженных π-связей
Энергетические уровни
Этилен
Энергия
p-АО
π-MO
Бутадиен
Энергия
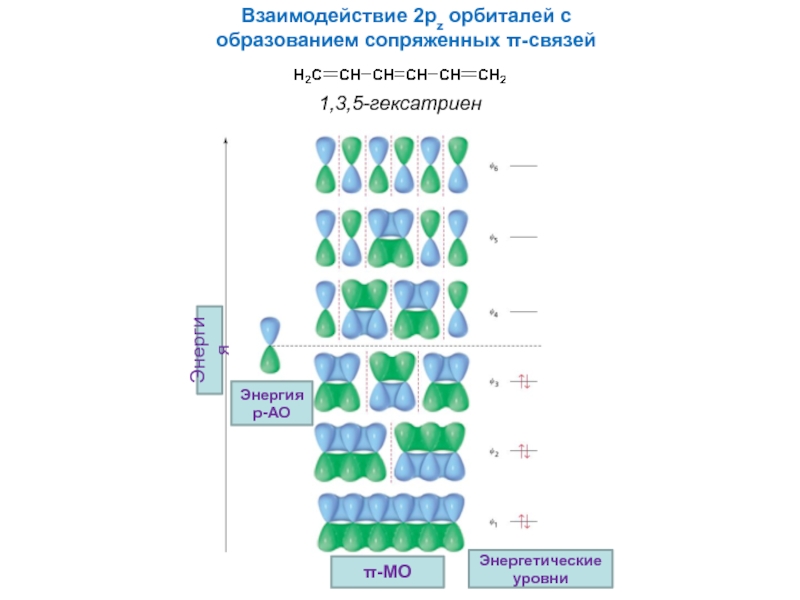
Слайд 14Взаимодействие 2pz орбиталей с
образованием сопряженных π-связей
1,3,5-гексатриен
Энергетические уровни
π-MO
Энергия
p-АО
Энергия
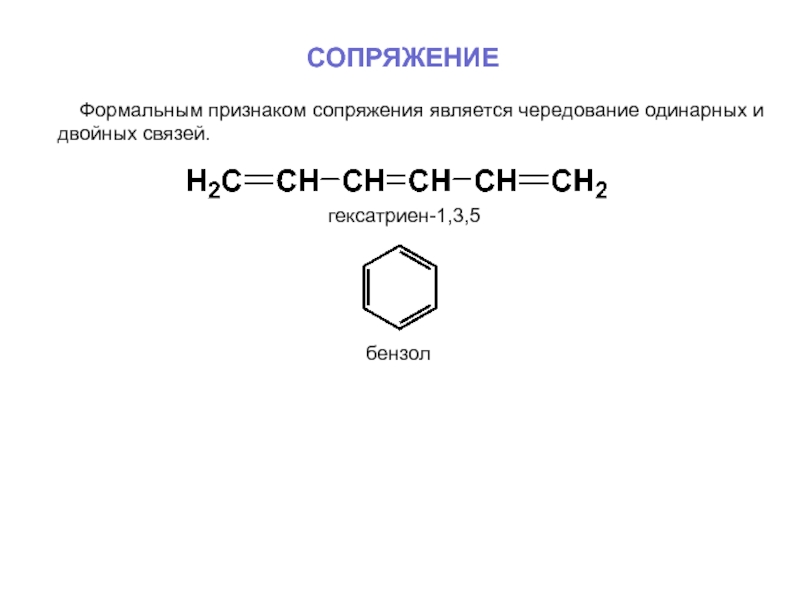
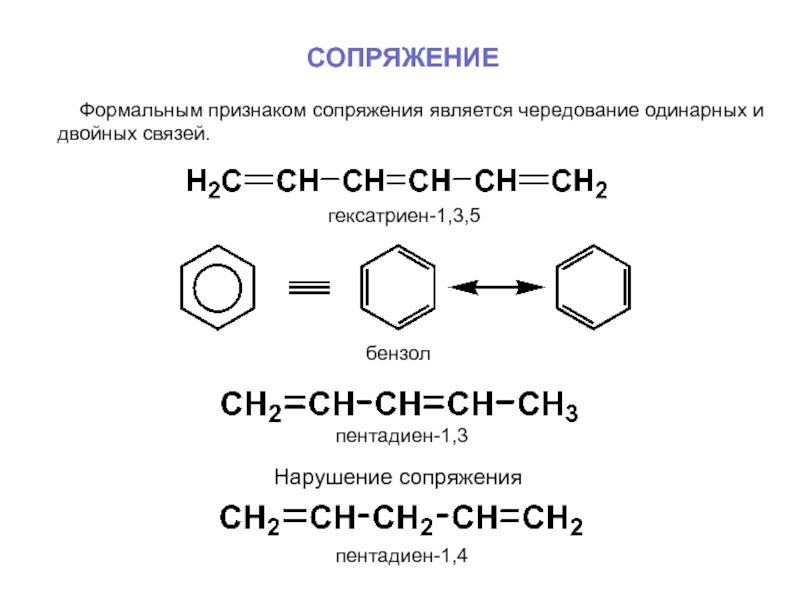
Слайд 15СОПРЯЖЕНИЕ
Формальным признаком сопряжения является чередование одинарных и двойных связей.
гексатриен-1,3,5
бензол
Слайд 16СОПРЯЖЕНИЕ
Формальным признаком сопряжения является чередование одинарных и двойных связей.
гексатриен-1,3,5
пентадиен-1,3
пентадиен-1,4
бензол
Нарушение
Слайд 17Свойства π-орбиталей
Боковое перекрывание рz-АО;
Эффективность перекрывания π-связи меньше, чем в случае
σ-связи;
Энергия связи: этилен 598 кДж/моль,
этан 347 кДж/моль
-------------
251 кДж/моль.
3. Сильная зависимость перекрывания от планарности молекулы;
4. Возможность формирования протяженных сопряженных систем;
5. π-Электроны более подвижны, чем σ-электроны;
6. π-Электронная плотность локализована над и под плоскостью молекулы; => Склонность к взаимодействию с электронодефицитными реагентами.
Слайд 18Фридрих Август Кекуле фон Штрадониц (нем. Friedrich August Kekulé von Stradonitz,
7
13 июля1896, Бонн) — немецкий химик-органик, создатель теории валентности.
АРОМАТИЧНОСТЬ
Kekule’s students received three of the first five Nobel Prizes in chemistry: Van’t Hoff in 1901, Fischer in 1902 and Baeyer in 1905.
Термин введен Ф. А. Кекуле (1865) для описания свойств соединений,
структурно близких к бензолу - родоначальнику класса ароматических
соединении.
Слайд 19 Одним из фундаментальных понятий органической химии является ароматичность. Термин
АРОМАТИЧНОСТЬ
- более устойчивы, чем их ациклические аналоги;
- характеризуются связями, длины которых лежат между длинами типично одинарной и типично двойной связей;
- обнаруживают π-электронный кольцевой ток, который индуцируется под воздействием внешнего магнитного поля, что приводит к возрастанию величин магнитной восприимчивости и специфическим химическим сдвигам в спектрах 1Н ЯМР;
- проявляют особую реакционную способность, заключающуюся в склонности ароматических соединений вступать в реакции замещения, а не присоединения.
Ароматичность – это свойство, которое нельзя непосредственно измерить. В связи с этим были разработаны различные критерии (индексы) для оценки ароматического характера. Наибольшее распространение получили энергетические, геометрические и магнитные критерии.
Слайд 20Энергетические критерии
Основаны на сравнении π-электронной энергии ароматической и модельной
Энергия делокализации (ЭД) или энергия резонанса рассчитывается как разность между π-электронной энергией молекулы и энергией соответствующего количества изолированных двойных связей. Эта разность характеризует выигрыш в энергии за счет делокализации π-электронов.
ЭД = Eπ - nEC=C
По данным простого метода Хюккеля для бензола Eπ=6α + 8β.
π-Электронная энергия изолированной двойной связи EC=C = 2α + 2β. Тогда энергия делокализации будет равна:
ЭД = 6α + 8β - 3(2α + 2β) = 2β
Для циклобутадиена: Eπ=4α + 4β, а ЭД=4α + 4β - 2(2α + 2β)=0.
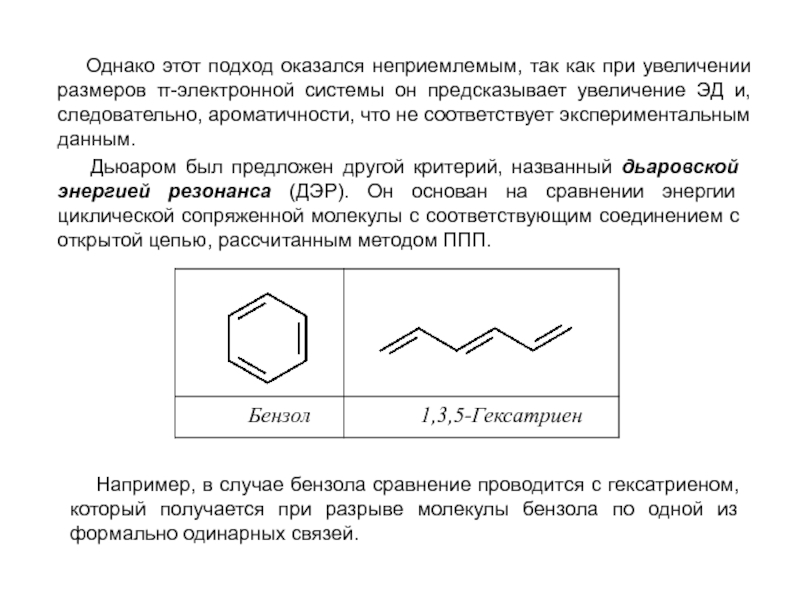
Слайд 21 Однако этот подход оказался неприемлемым, так как при увеличении
Дьюаром был предложен другой критерий, названный дьаровской энергией резонанса (ДЭР). Он основан на сравнении энергии циклической сопряженной молекулы с соответствующим соединением с открытой цепью, рассчитанным методом ППП.
Например, в случае бензола сравнение проводится с гексатриеном, который получается при разрыве молекулы бензола по одной из формально одинарных связей.
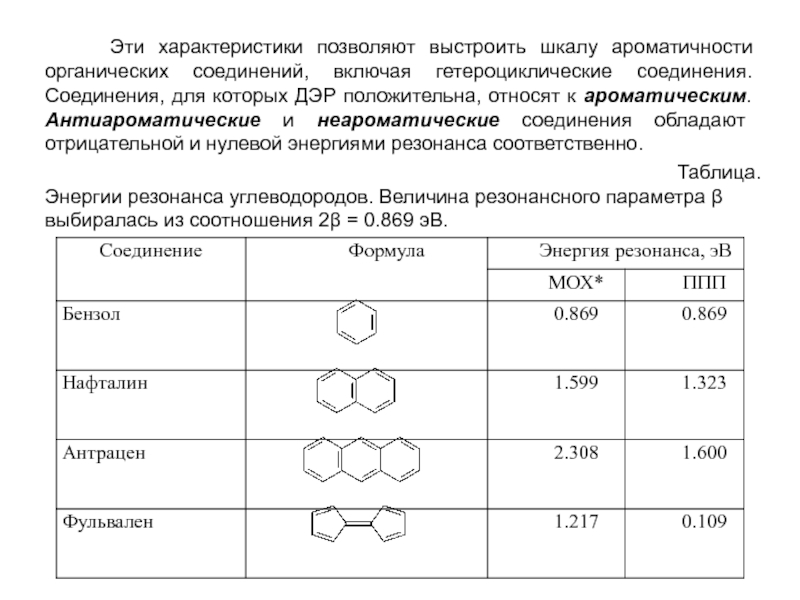
Слайд 22 Эти характеристики позволяют выстроить шкалу ароматичности органических соединений,
Таблица.
Энергии резонанса углеводородов. Величина резонансного параметра β выбиралась из соотношения 2β = 0.869 эВ.
Слайд 23 Для удобства сравнения молекул с различным количеством π-электронов удобно
УдДЭР = ДЭР/Nel ,
где Nel – число π-электронов в системе.
Слайд 24Геометрические критерии
Основаны на способности ароматических соединений к выравниванию связей
К настоящему времени разработано большое количество критериев ароматичности, основанных на геометрических характеристиках молекул. Например, критерий А, учитывающий отклонение длин связей от среднего значения:
n – число связей в цикле;
Ri – длина i-ой связи;
Rav – средняя длина связи.
Однако данный индекс не учитывает отклонение средней длины связи от оптимального значения.
П17
Слайд 25 Это недостаток был учтен при разработке критерия, называемого моделью
где
n - число связей в цикле;
- эмпирическая константа, выбранная таким образом, чтобы НОМА=0 для гипотетической структуры бензола Кекуле и НОМА = 1 для системы, у которой все длины связей равны величине Ropt;
для углеводородов α = 257.7.
Ri – длина i-ой связи.
Слайд 26Это уравнение можно разбить на составляющие:
Первое слагаемое в квадратных
Второе слагаемое - изменения ароматичности, вызванные отклонением длин связей от средней длины связи, обозначаются как GEO.
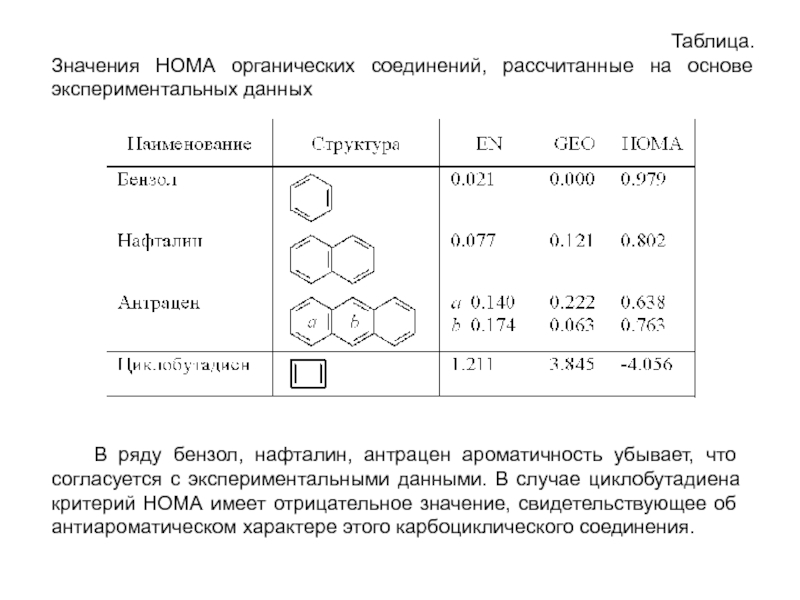
Слайд 27Таблица.
Значения НОМА органических соединений, рассчитанные на основе экспериментальных данных
В
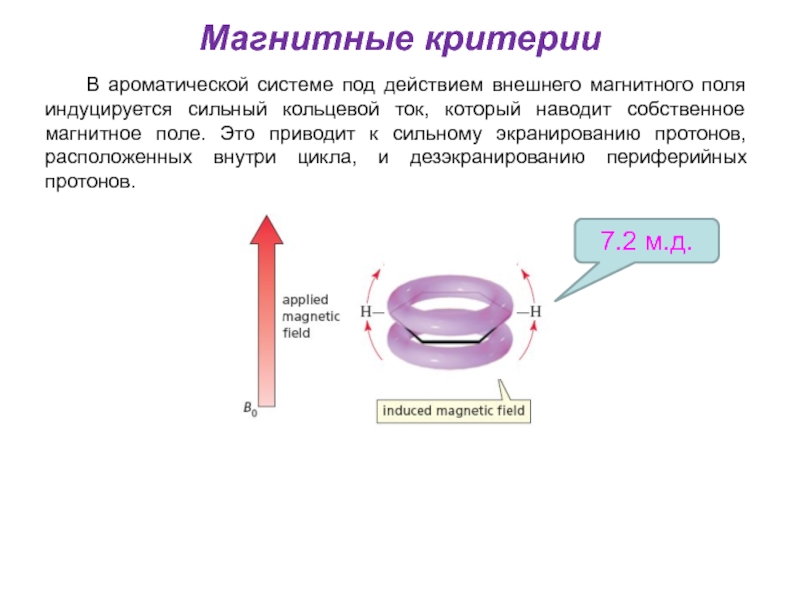
Слайд 28Магнитные критерии
В ароматической системе под действием внешнего магнитного
7.2 м.д.
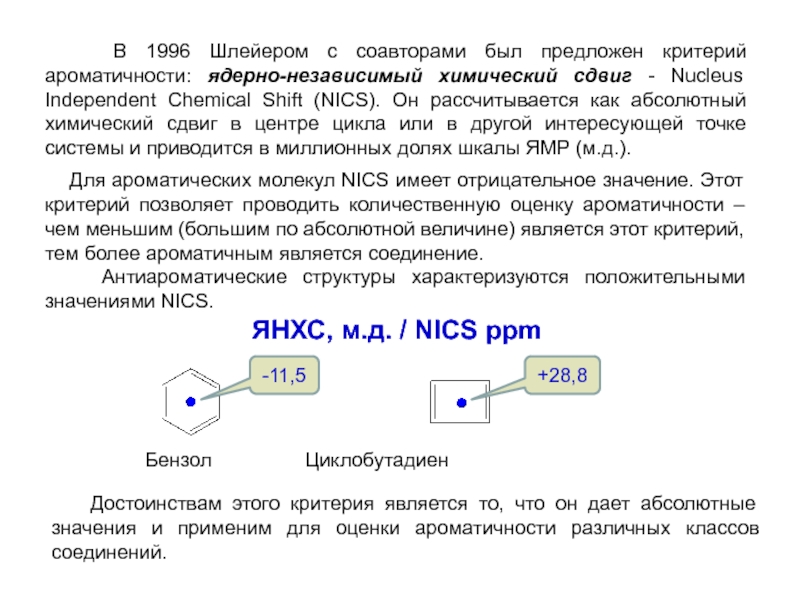
Слайд 30 В 1996 Шлейером с соавторами был предложен критерий ароматичности:
Для ароматических молекул NICS имеет отрицательное значение. Этот критерий позволяет проводить количественную оценку ароматичности – чем меньшим (большим по абсолютной величине) является этот критерий, тем более ароматичным является соединение.
Антиароматические структуры характеризуются положительными значениями NICS.
Достоинствам этого критерия является то, что он дает абсолютные значения и применим для оценки ароматичности различных классов соединений.
-11,5
+28,8
Бензол Циклобутадиен
ЯНХС, м.д. / NICS ppm
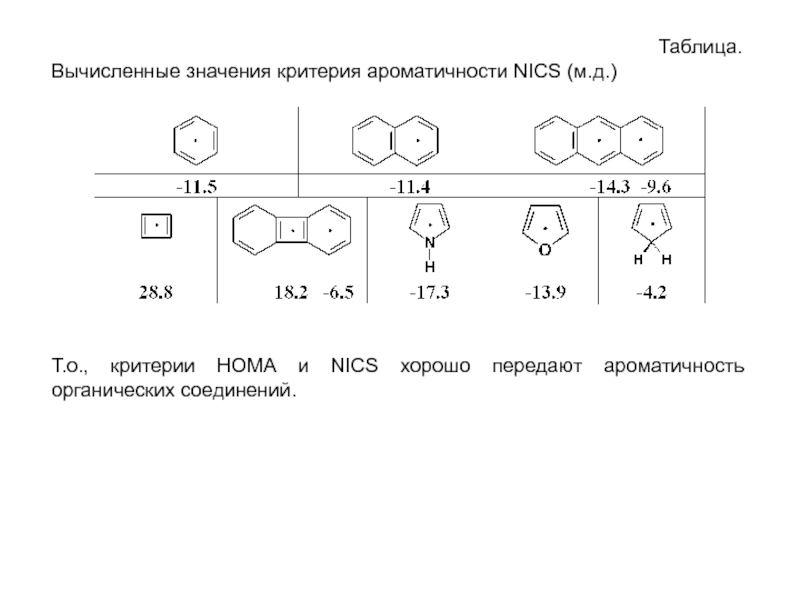
Слайд 31Таблица.
Вычисленные значения критерия ароматичности NICS (м.д.)
Т.о., критерии НОМА и NICS хорошо
Слайд 32
n=0 => 2π-электрона
катион циклопропенилия дикатион циклобутадиенилия
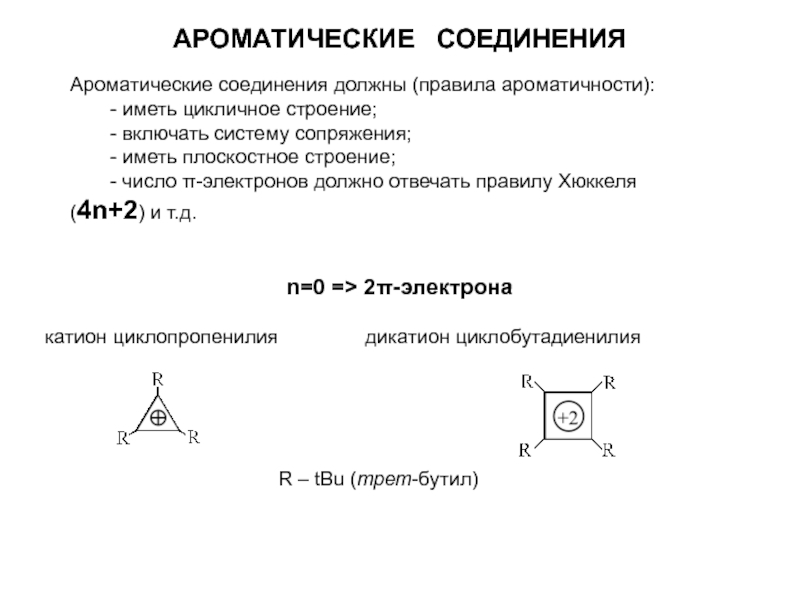
АРОМАТИЧЕСКИЕ
Ароматические соединения должны (правила ароматичности):
- иметь цикличное строение;
- включать систему сопряжения;
- иметь плоскостное строение;
- число π-электронов должно отвечать правилу Хюккеля (4n+2) и т.д.
R – tBu (трет-бутил)
Слайд 34n=3 => 14π-электронов
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
[14] Аннулен
Нафталин
Антрацен
Фенантрен
Пирен
Линейное
аннелирование
Ангулярное
аннелирование
пери-
Аннелирование
Аннелирование - циклоприсоединение
Слайд 38Является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную решётку.
ГРАФЕН
АРОМАТИЧЕСКИЕ
Слайд 39Science 22 October 2004:
Vol. 306 no. 5696 pp. 666-669
DOI: 10.1126/science.1102896
Electric Field Effect in Atomically Thin
K. S. Novoselov1, A. K. Geim1,*, S. V. Morozov2, D. Jiang1, Y. Zhang1,
S. V. Dubonos2, I. V. Grigorieva1, A. A. Firsov2
1 Department of Physics, University of Manchester, Manchester M13 9PL, UK.
2 Institute for Microelectronics Technology, 142432 Chernogolovka, Russia.
ABSTRACT
We describe monocrystalline graphitic films, which are a few atoms thick but are nonetheless stable under ambient conditions, metallic, and of remarkably high quality. The films are found to be a two-dimensional semimetal with a tiny overlap between valence and conductance bands, and they exhibit a strong ambipolar electric field effect such that electrons and holes in concentrations up to 1013 per square centimeter and with room-temperature mobilities of ∼10,000 square centimeters per volt-second can be induced by applying gate voltage.
Слайд 405 октября были удостоены Нобелевской премии в области физики за 2010 год за
Андрей Гейм родился в 1958 году, а Константин Новосёлов - в 1974-м.
Слайд 41АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические системы
Замена =СН- группы в молекуле бензола
X = N, O+, S+
Y = NH, O, S
Пиридин
Пиррол
В ряду N>P>As>Sb устойчивость уменьшается вследствие увеличения размеров атома.
Слайд 42Альтернантные и неальтернантные системы
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
Пометим (*) через один все атомы,
Если такое чередование не соблюдается, то такая система называется неальтернантной.
Бензол
Нафталин
*
*
?
?
?
Бензофульвален
Азулен















![[18]Аннулен имеет 2 сигнала в спектре 1Н ЯМР: 9,25 и -2,88 м.д. -2,889,25](/img/tmb/6/505881/3227edb4e95972808cc04c9d12e8ce55-800x.jpg)
![n=3 => 14π-электроновАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ[14] АннуленНафталинАнтраценФенантренПиренЛинейное аннелированиеАнгулярное аннелированиепери-АннелированиеАннелирование - циклоприсоединение](/img/tmb/6/505881/206e72fb4f074ffa7cf2ab0498199c51-800x.jpg)