в яких відбувається розщеплення одних зв’язків та утворення інших, то напрямок хімічної реакції суттєво залежить від розподілу електронної густини в молекулах реагуючих речовин.
Електрони не розподілені рівномірно по всій молекулі. Навіть в формально нейтральних молекулах є місця з підвищеним негативним зарядом і є місця з підвищеним позитивним зарядом. Отже молекули, а також у більшій чи меншій мірі поляризовані. Розподіл електронної густини в молекулі залежить від взаємного впливу атомів.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теорія взаємного впливу атомів у молекулах органічних речовин презентация
Содержание
- 1. Теорія взаємного впливу атомів у молекулах органічних речовин
- 2. Найефективніше впливають один на одного безпосередньо зв`язані
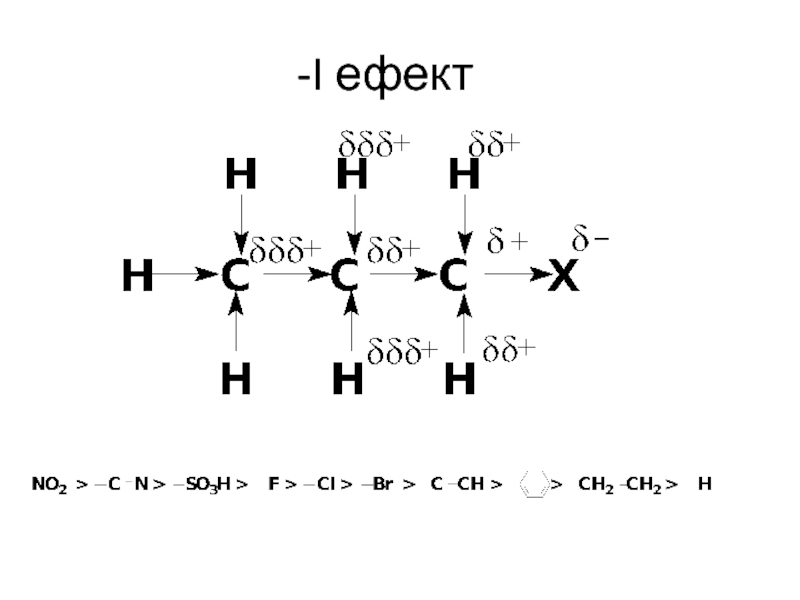
- 3. -I ефект
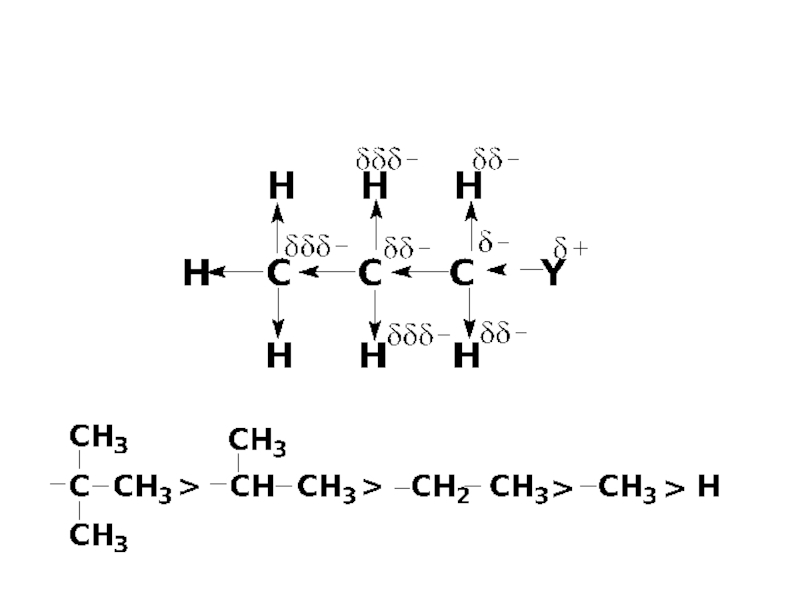
- 4. +I ЕФЕКТ
- 5. МЕЗОМЕРНИЙ ЕФЕКТ (ЕФЕКТ СПРЯЖЕННЯ, РЕЗОНАНСНИЙ ЕФЕКТ) Схема розподілу електронів по спряжених p
- 6. МЕЗОМЕРНИЙ ЕФЕКТ (ЕФЕКТ СПРЯЖЕННЯ, РЕЗОНАНСНИЙ ЕФЕКТ)
- 7. Першою вказується електронодонорна орбіталь,
- 8. Умови, що необхідні для виникнення
- 9. Замісники, які проявляють +М-ефект +М-Ефект
- 10. Замісники, які проявляють (–М)-ефект До
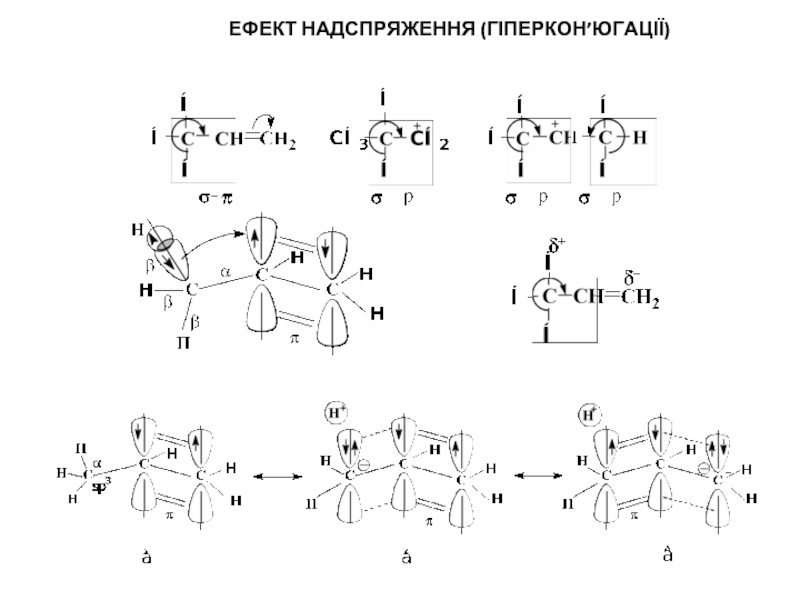
- 11. ЕФЕКТ НАЕФЕКТ НАДСПРЯЖЕННЯ (ГІПЕРКОН’ЮГАЦІЇ) Д
Слайд 1ТЕОРІЯ ВЗАЄМНОГО ВПЛИВУ АТОМІВ
У МОЛЕКУЛАХ ОРГАНІЧНИХ РЕЧОВИН
Оскільки хімічні реакції є процесами,
Слайд 2Найефективніше впливають один на одного безпосередньо зв`язані атоми. Характер їх взаємного
впливу проявляється в природі хімічного зв`язку між ними. Але навіть безпосередньо незв`язані атоми також впливають один на одного і цей вплив здійнюється за допомогою так званих електронних ефектів.
Розглянеми найбільш вагомі з них.
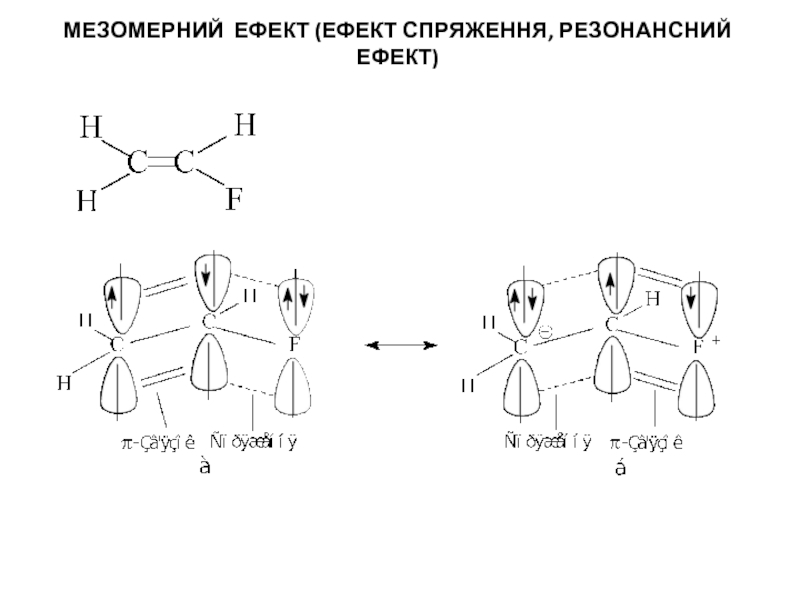
Слайд 5МЕЗОМЕРНИЙ ЕФЕКТ (ЕФЕКТ СПРЯЖЕННЯ, РЕЗОНАНСНИЙ ЕФЕКТ)
Схема розподілу електронів по спряжених p
Слайд 6МЕЗОМЕРНИЙ ЕФЕКТ (ЕФЕКТ СПРЯЖЕННЯ, РЕЗОНАНСНИЙ ЕФЕКТ)
Електронні зміщення за участю електронів спряжених
p-орбіталей, а найчастіше π-зв'язків називають мезомерним ефектом (М-ефектом), С-ефектом або ефектом спряження, R-ефектом або резонансним ефект.
Зсув електронної густини, викликаний мезомерним ефектом позначається вигнутою стрілкою, початок якої показує, які електрони (р- або π-) зміщуються, а кінець стрілки - зв'язки або атоми, до яких зміщується електронна густина:
Зсув електронної густини, викликаний мезомерним ефектом позначається вигнутою стрілкою, початок якої показує, які електрони (р- або π-) зміщуються, а кінець стрілки - зв'язки або атоми, до яких зміщується електронна густина:
Слайд 7
Першою вказується електронодонорна орбіталь, а другою – електроноакцепторна, тобто та, на
яку передається електронна густина.
Слайд 8
Умови, що необхідні для виникнення спряження?
1). Наявність р-орбіталей на двох
сусідніх атомах, які формально не зв'язані π-зв'язком.
2). Ці орбіталі не повинні сильно відрізнятись за розмірами.
3). Вісі цих орбіталей мають бути паралельними. Ця умова легко виконується, якщо є можливість вільного обертання атомів довкола ординарного зв'язку, що з'єднує ці атоми.
2). Ці орбіталі не повинні сильно відрізнятись за розмірами.
3). Вісі цих орбіталей мають бути паралельними. Ця умова легко виконується, якщо є можливість вільного обертання атомів довкола ординарного зв'язку, що з'єднує ці атоми.
Слайд 9Замісники, які проявляють +М-ефект
+М-Ефект проявляють атоми, що мають на p-орбіталі неподілену
пару електронів. Аніони є найсильнішими донорами електронів, і саме вони проявляють найсильніший +М-ефект.
F- > Cl- > Br- > I- > O- > O= > S- > S=
F- > Cl- > Br- > I- > O- > O= > S- > S=
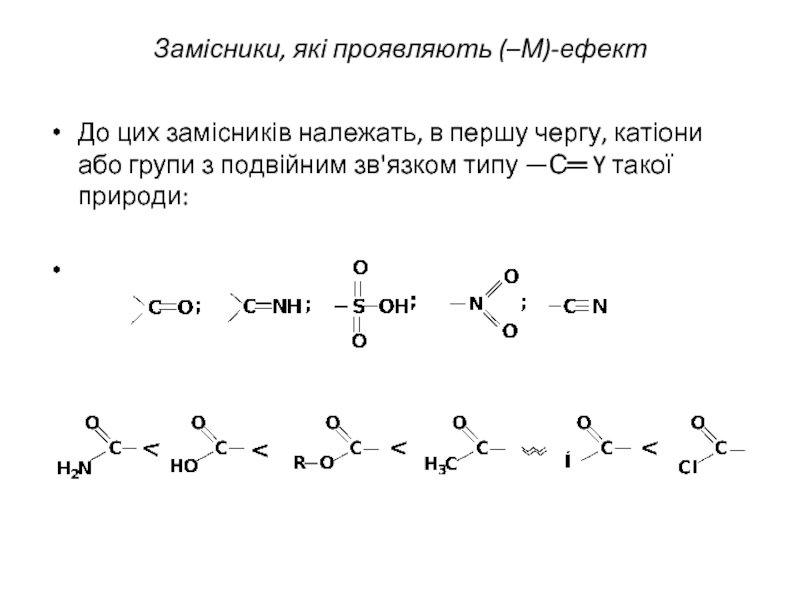
Слайд 10Замісники, які проявляють (–М)-ефект
До цих замісників належать, в першу чергу, катіони
або групи з подвійним зв'язком типу —С═ Y такої природи: