- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Понятие о коррозии металлов. Способы защиты от коррозии презентация
Содержание
- 1. Понятие о коррозии металлов. Способы защиты от коррозии
- 2. Девиз: «Знать – значит победить» Цель
- 3. Результат: прямые потери массы
- 4. Делийская железная колонна Эйфелева башня
- 5. Тема урока: «Понятие о коррозии металлов. Способы защиты от коррозии»
- 6. «Знать – значит победить» А. Н. Несмеянов
- 7. Графический диктант 1 вариант Для Меди
- 8. Графический диктант Металлом можно воспользоваться для получения
- 9. Ключ для проверки I вариант:
- 10. Историческая страница электрохимической коррозии.
- 11. Информационная страница КОРРОЗИЯ – это разрушение
- 13. Почему темнеет яблоко?
- 14. Интересные факты
- 15. Интересные факты О том, сколь коварна и
- 16. Информационная страница КОРРОЗИЯ – это окислительно-восстановительный
- 17. с. 108-109 учебника
- 18. Химическая коррозия Газовая В жидких
- 19. Электрохимическая коррозия 2Fe + O2 + 2H2O
- 20. Виды коррозии
- 21. По виду коррозионной среды
- 22. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 23. По характеру разрушений
- 24. Сплошная коррозия Равномерная Неравномерная
- 25. Местная коррозия
- 26. Причины возникновения местной коррозии Соль на дорогах
- 27. Факторы, влияющие на скорость коррозии Экспериментальная страница
- 28. Цель: исследовать влияние сред, контактов металлов на скорость коррозии
- 29. Гипотеза исследования Коррозия металлов – химическая реакция,
- 30. Метод исследования Эксперимент
- 31. Что делали 1 стакан: Fe + H2O
- 32. Результат эксперимента
- 33. Что наблюдали Стакан №1. Железо слабо
- 34. Стакан №2. Скорость коррозии выше,
- 35. Стакан №3. Железный гвоздь в контакте
- 36. Стакан №4. В контакте с цинком железо не корродирует.
- 37. Стакан №5.
- 38. Вывод Действительно, мы увидели, что
- 39. ПРИМЕРЫ КОРРОЗИИ
- 40. луженое железо Консервная банка
- 41. Оцинкованное ведро Основа – железо, поверхность – серебристо-белый блестящий металл – Zn
- 42. Практическая страница «Просто знать –
- 43. Ингибиторы – это вещества, способные в малых
- 44. Практическая страница Способы защиты металлов от коррозии: Шлифование поверхностей.
- 45. Способы защиты металлов от
- 46. Способы защиты металлов от
- 47. Способы защиты металлов от
- 48. Способы защиты металлов от
- 49. Способы защиты металлов от
- 50. Способы защиты металлов от
- 51. Способы защиты металлов от
- 52. Нанотехнология. Самовосстанавливающийся газопровод.
- 53. Shewanella oneidensis — грамотрицательнаяграмотрицательная, факультативно анаэробнаяграмотрицательная, факультативно анаэробная бактерия
- 54. «Стоп! Красный свет!» Вопросы: Что такое коррозия?
- 55. Задача Сантехника попросили поставить водопроводный кран,
- 56. Задача Человек поставил на зуб золотую
- 57. Задача Определите массу оксида серы (VI),
- 58. Задача Определите объем водовода, который образуется
- 59. Задача Расчитайте массовые доли (в %) элементов в С12Н22О12.
- 61. Рефлексия Сегодня на уроке я узнал(а)… Было
- 62. Домашнее задание 24 стр. 108-118. вопросы 1,
Слайд 1«Понятие о коррозии металлов.
Способы защиты от коррозии»
Разработала:
Диденко Кристина Васильевна
учитель химии
МБОУ Гришинская школа
Слайд 2 Девиз: «Знать – значит победить» Цель работы
Изучить коррозию металлов, исследовать причины и условия её возникновения.
Актуальность
Практическое использование современных взглядов на коррозию металлов и сплавов и защиты металлических изделий от разрушения в быту и на производстве.
изучить сущность химической и электрохимической коррозии металлов;
закрепить представления об окислительно-восстановительных реакциях;
научить использовать приобретенные знания для объяснения явлений окружающей среды;
научить грамотному использованию металлических изделий;
проверить знания о строении металлов и их свойствах;
Слайд 3
Результат:
прямые потери массы металла;
косвенные потери - утрата важнейших свойств.
Коррозия
Грызёт металлический лом.
В. Шефнер
Ежегодно в мире «теряется»
до ¼ произведённого железа…
Слайд 4Делийская
железная колонна
Эйфелева башня
Высота 7, 2 м, вес около
Возраст 1600 лет
Красили 18 раз,
отчего ее масса 9000 т
каждый раз увеличивалась на 70 т
(в сумме - 10260 т)
Слайд 6«Знать – значит победить»
А. Н. Несмеянов
Цели урока:
познакомиться с типами коррозии, со
объяснить реакции окисления-восстановления, протекающие на поверхности металла в процессе коррозии.
Слайд 7Графический диктант
1 вариант
Для Меди (Си)
2 вариант
Для калия (К)
Это активный щелочной металл.
Металл
Самый мягкий металл.
Входит в состав бронзы.
На внешнем энергетическом уровне 2 электрона.
Металл взаимодействует с водой.
Металл не взаимодействует с водой.
Вытесняет железо из растворов его солей.
Слайд 8Графический диктант
Металлом можно воспользоваться для получения серебра из его соли.
Может вытеснять
В реакциях с галогенами является окислителем.
При хранении на открытом воздухе быстро окисляется.
Раствор соли этого металла используют для борьбы с вредителями сада.
Легко режется ножом.
Проверяем.
Слайд 9Ключ для проверки
I вариант:
II вариант:
Без ошибок
1-2 ошибки – «4»;
3-5 ошибок - «3».
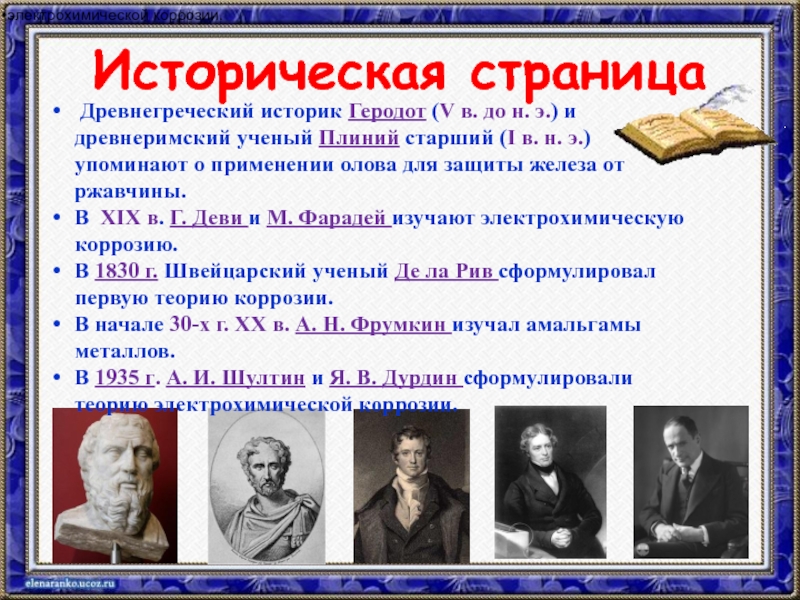
Слайд 10Историческая страница
электрохимической коррозии.
Древнегреческий историк Геродот (V в. до н. э.) и древнеримский ученый Плиний старший (I в. н. э.) упоминают о применении олова для защиты железа от ржавчины.
В ХIХ в. Г. Деви и М. Фарадей изучают электрохимическую коррозию.
В 1830 г. Швейцарский ученый Де ла Рив сформулировал первую теорию коррозии.
В начале 30-х г. ХХ в. А. Н. Фрумкин изучал амальгамы металлов.
В 1935 г. А. И. Шултин и Я. В. Дурдин сформулировали теорию электрохимической коррозии.
Слайд 11Информационная
страница
КОРРОЗИЯ – это разрушение металлов и сплавов под действием внешней
Коррозия – от латинского corrodere – разъедать.
Слайд 15Интересные факты
О том, сколь коварна и прожорлива коррозия, знают все автомобилисты.
Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение.
Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет
Слайд 16Информационная
страница
КОРРОЗИЯ – это окислительно-восстановительный процесс, при котором атомы металла переходят
Fe0 - 2e → Fe2+
Cu0 - 2e → Cu2+
Слайд 18Химическая коррозия
Газовая
В жидких
не электролитах
В нефти
В сере
В органических веществах
4Fe + 3O2 + 6H2O = 2Fe(OH)3
Слайд 29Гипотеза исследования
Коррозия металлов – химическая реакция, значит на её скорость может
Слайд 31Что делали
1 стакан: Fe + H2O
2 стакан: Fe + р-р NaCl
3
4 стакан: Fe, Zn + р-р NaCl
5 стакан: Fe + р-р (NaCl + NaOH)
Слайд 33Что наблюдали
Стакан №1.
Железо слабо прокорродировало, в чистой воде коррозия идет медленнее,
Слайд 34Стакан №2.
Скорость коррозии выше, чем в первом случае, следовательно, NaCl
Слайд 35Стакан №3.
Железный гвоздь в контакте с медной проволокой, опущенный в раствор
Слайд 37
Стакан №5.
Железный гвоздь, опущенный в раствор NaCl, к которому добавили NaOH,
Слайд 38Вывод
Действительно, мы увидели, что скорость коррозии меняется в зависимости
Из наблюдений можно сделать вывод, что алюминий для протекторной защиты использовать нельзя, так как железо все равно разрушается.
Слайд 43Ингибиторы –
это вещества, способные в малых количествах замедлять протекание химических процессов
Слайд 46 Способы защиты металлов от коррозии:
Нанесение защитных покрытий:
Неметаллических
Практическая
страница
Слайд 47 Способы защиты металлов от коррозии:
Нанесение защитных покрытий:
металлических
Например никелирование, лужение, хромирование.
Практическая
страница
Слайд 48 Способы защиты металлов от коррозии:
Нанесение защитных покрытий:
Химических:
Воронение,
Оксидные пленки,
Полимерные пленки
И другие…
Практическая
страница
Слайд 49 Способы защиты металлов от коррозии:
Электрохимические методы
Протекторная защита
Практическая
страница
Слайд 50 Способы защиты металлов от коррозии:
Электрохимические методы:
Катодная защита
Практическая
страница
Слайд 51 Способы защиты металлов от коррозии:
Обработка среды
(В котельных
Практическая
страница
Слайд 53Shewanella oneidensis — грамотрицательнаяграмотрицательная, факультативно анаэробнаяграмотрицательная, факультативно анаэробная бактерия
Слайд 54«Стоп! Красный свет!»
Вопросы:
Что такое коррозия?
Какие виды коррозии вы знаете?
Когда и кем
Когда и кем была сформулирована теория электрохимической коррозии?
Как можно замедлить коррозию?
Слайд 55Задача
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии
Слайд 56Задача
Человек поставил на зуб золотую коронку, по истечении
некоторого времени
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?
Слайд 57Задача
Определите массу оксида серы (VI), которую можно получить при окислении
Слайд 58Задача
Определите объем водовода, который образуется при растворении в соляной кислоте
Слайд 61Рефлексия
Сегодня на уроке я узнал(а)…
Было интересно…
Было трудно…
Я выполнял(а) задания…
Я понял(а), что…
Теперь
Меня удивило…
Урок дал мне для жизни…
Мне захотелось…