- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение вещества. Строение атома и периодическая система элементов презентация
Содержание
- 1. Строение вещества. Строение атома и периодическая система элементов
- 2. Главное квантовое число n 1,2,3,4,5,6,7, …
- 3. Магнитное квантовое число –l,…, 0,…,+ l;
- 4. Принцип Паули. В атоме не может быть
- 5. Правило Гунда. На атомной орбитали
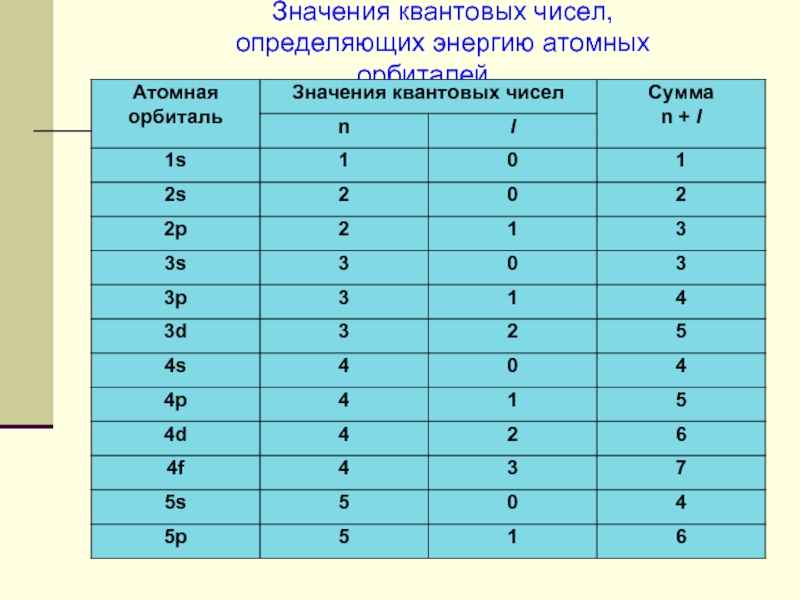
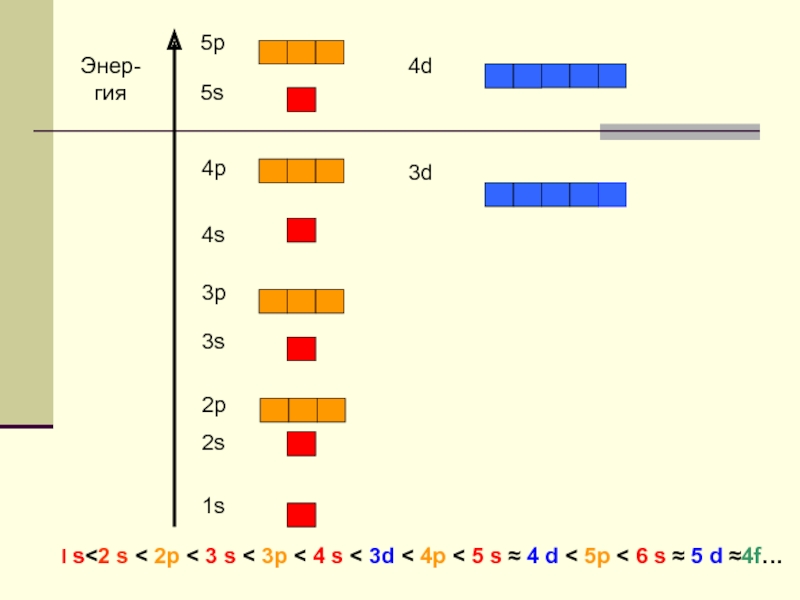
- 6. Значения квантовых чисел, определяющих энергию атомных орбиталей
- 8. Электронные формулы и распределение валентных электронов
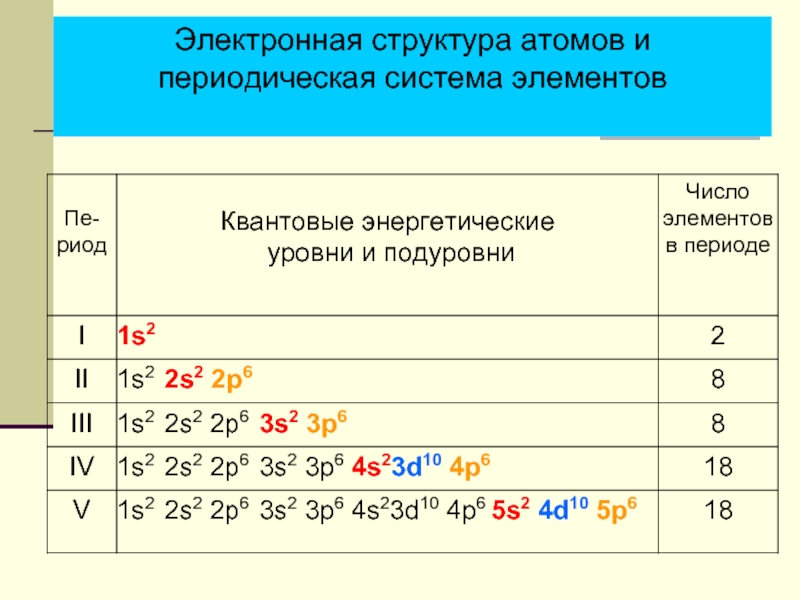
- 9. Электронная структура атомов и периодическая система элементов
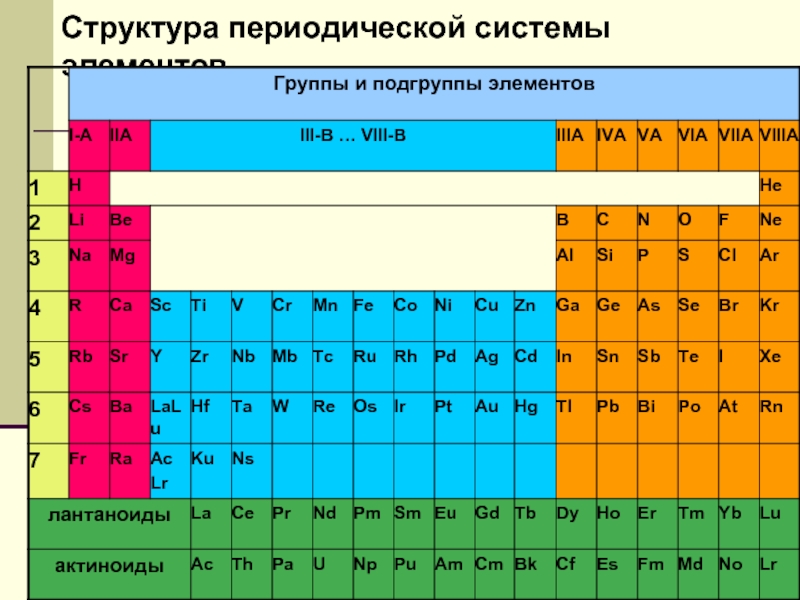
- 10. Структура периодической системы элементов
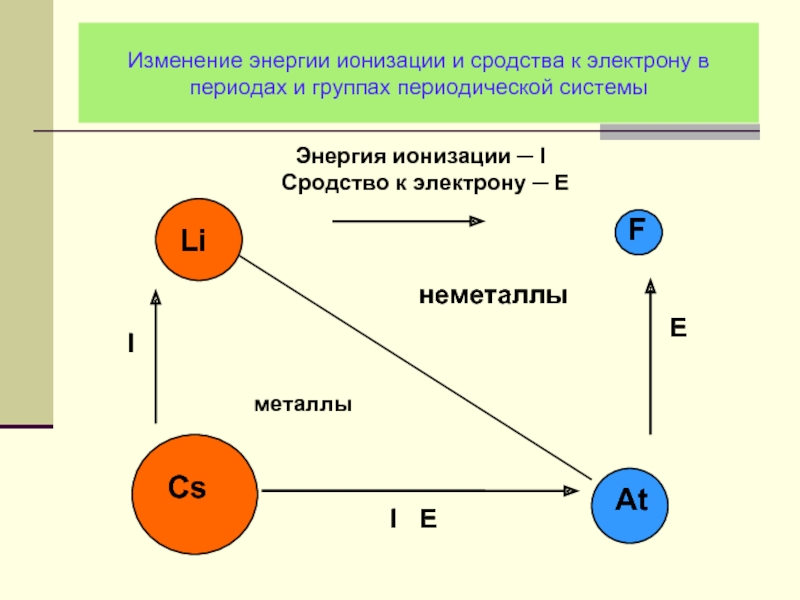
- 11. Изменение энергии ионизации и сродства к электрону в периодах и группах периодической системы
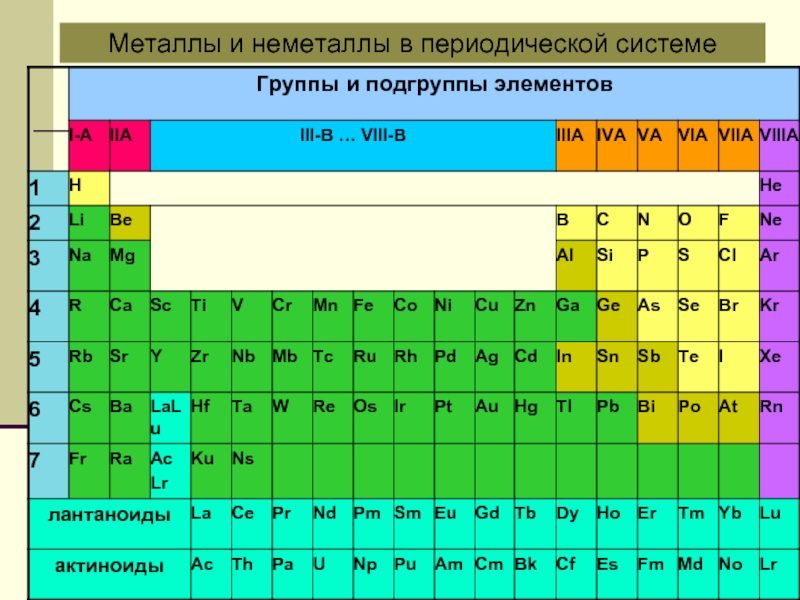
- 12. Металлы и неметаллы в периодической системе
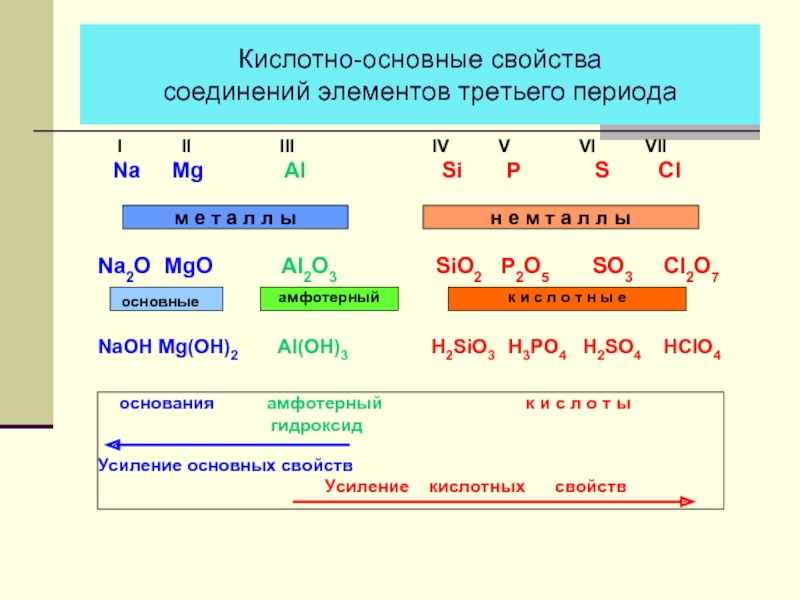
- 13. Кислотно-основные свойства соединений элементов третьего периода
- 14. Химическая связь Литература Коровин Н.В. Общая
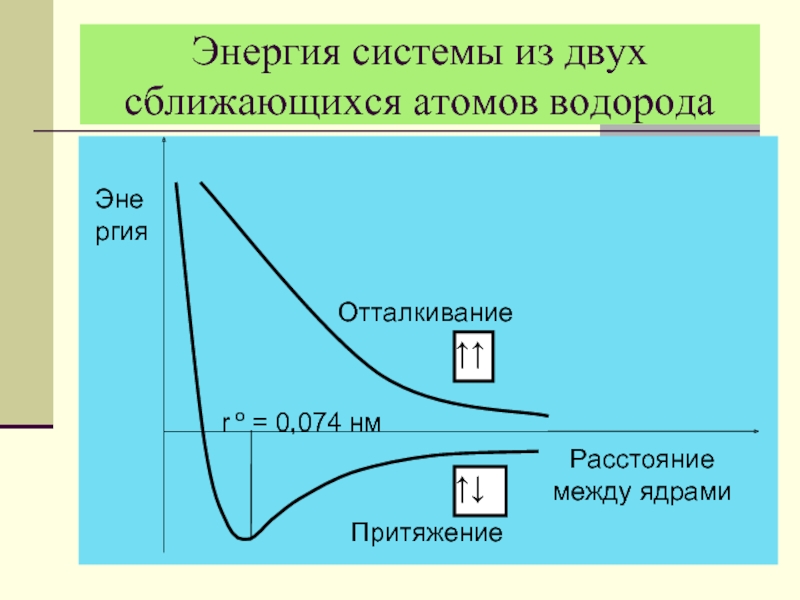
- 15. Энергия системы из двух сближающихся атомов водорода
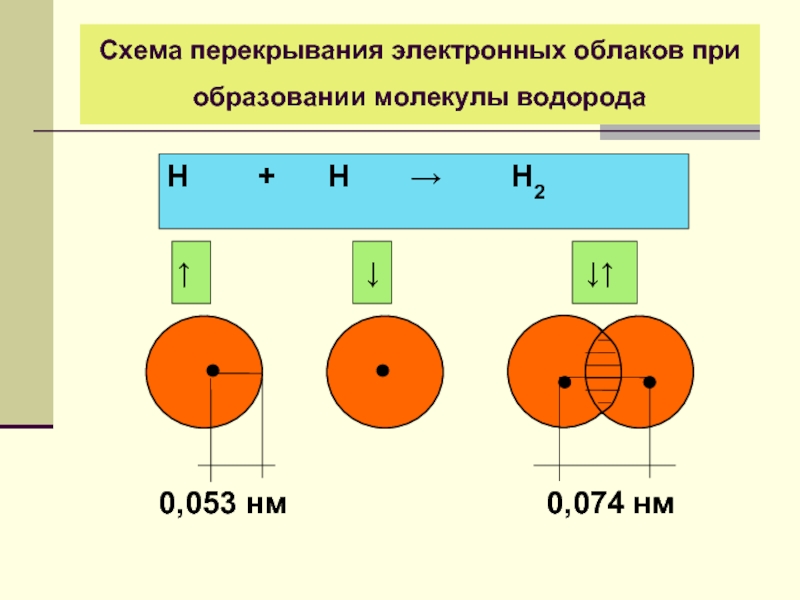
- 16. Схема перекрывания электронных облаков при образовании молекулы водорода
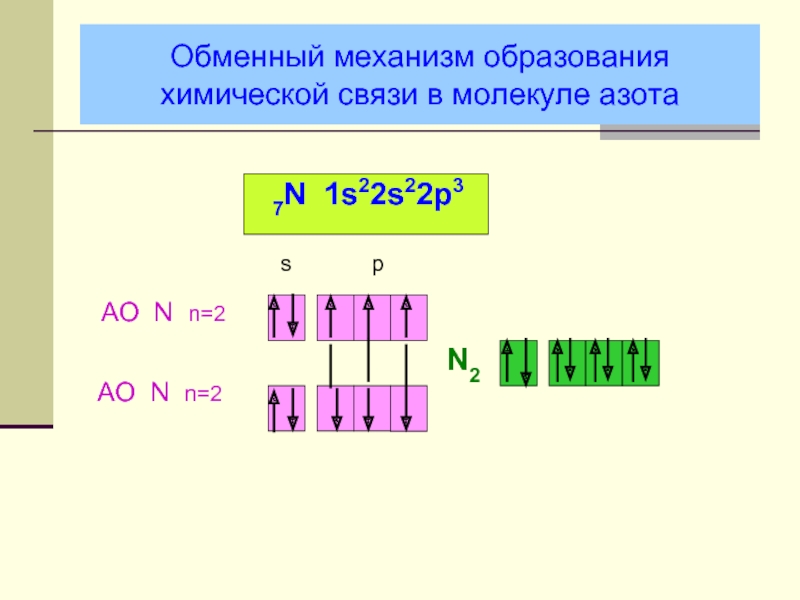
- 17. Обменный механизм образования химической связи в молекуле азота
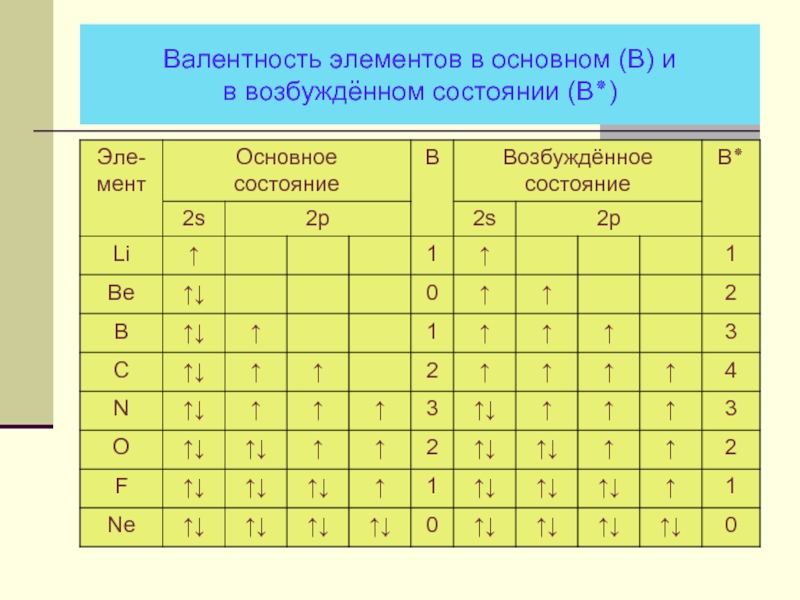
- 18. Валентность элементов в основном (В) и в возбуждённом состоянии (В٭)
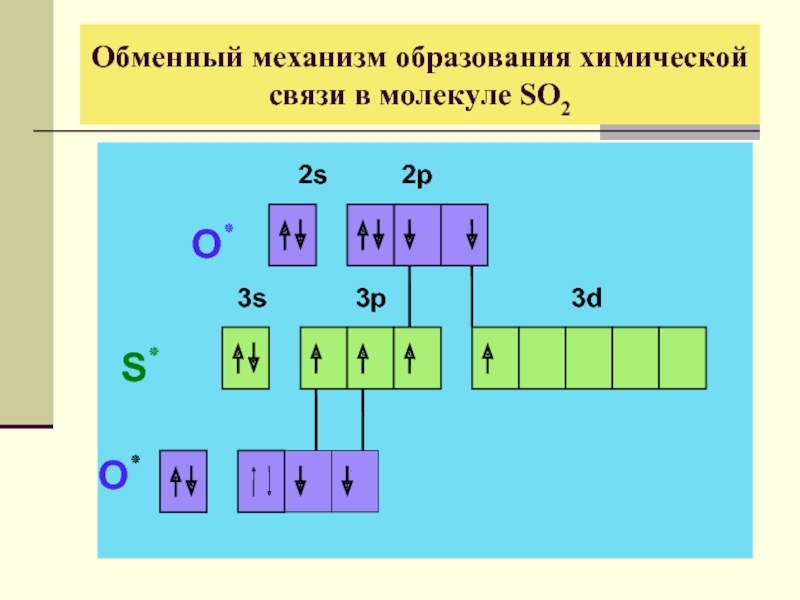
- 19. Обменный механизм образования химической связи в молекуле SO2
- 20. Донорно-акцепторный механизм образования ковалентной связи в ионе [NH4]+
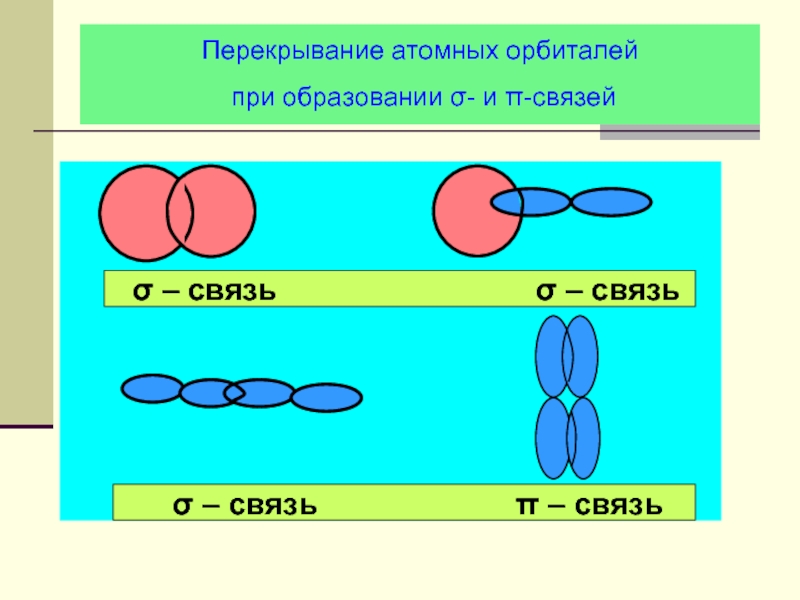
- 21. Перекрывание атомных орбиталей при образовании σ- и π-связей
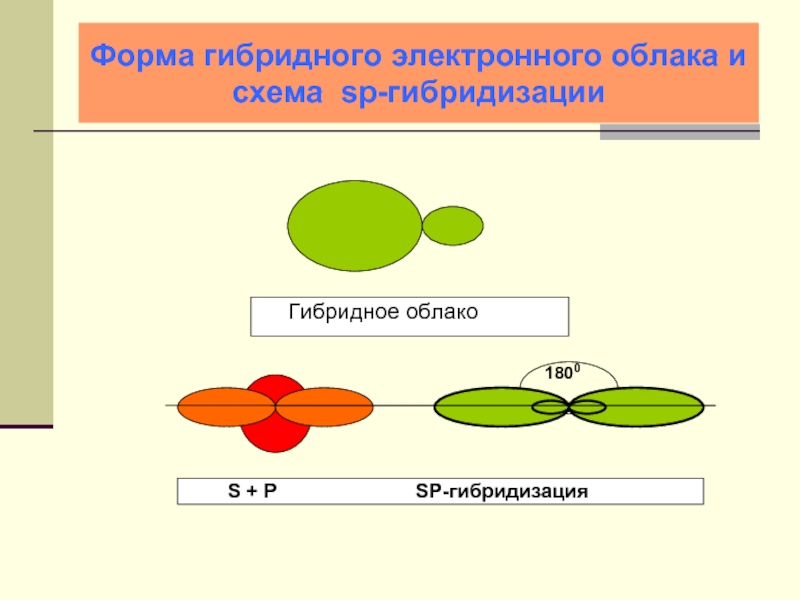
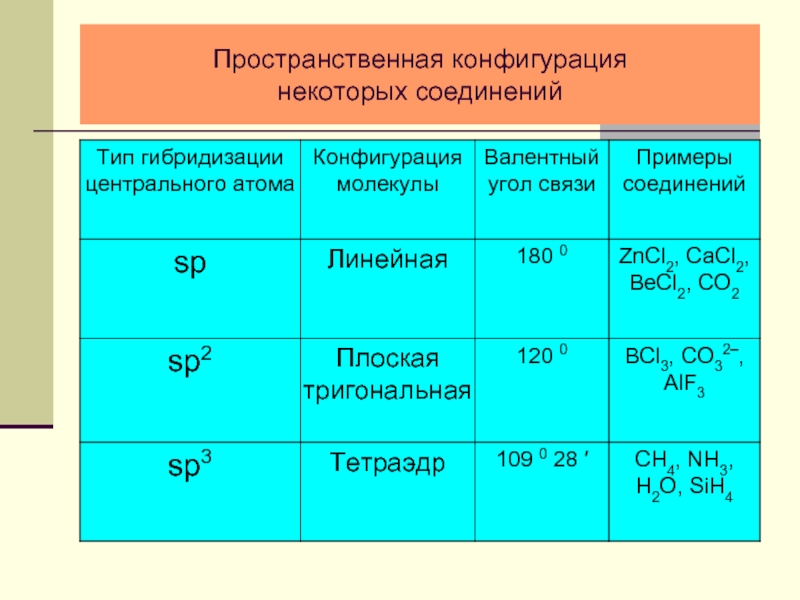
- 22. Форма гибридного электронного облака и схема sp-гибридизации
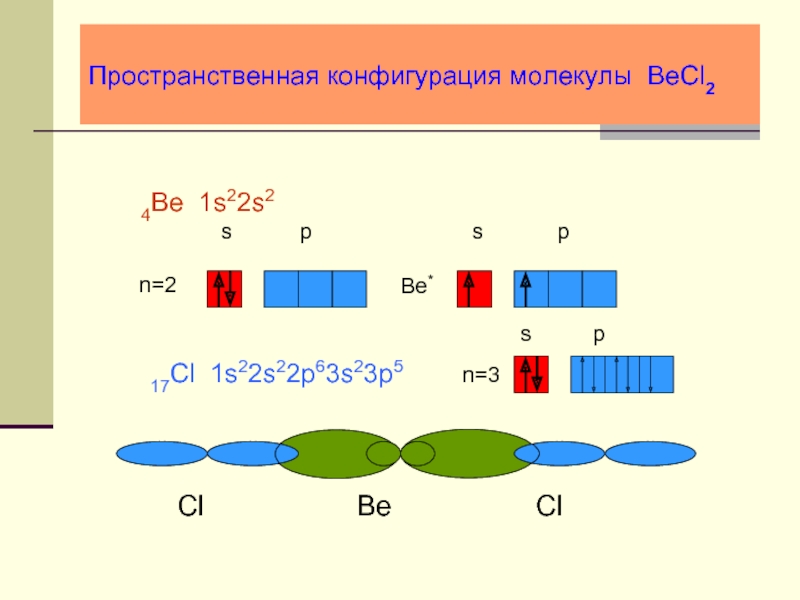
- 23. Пространственная конфигурация молекулы BeCl2
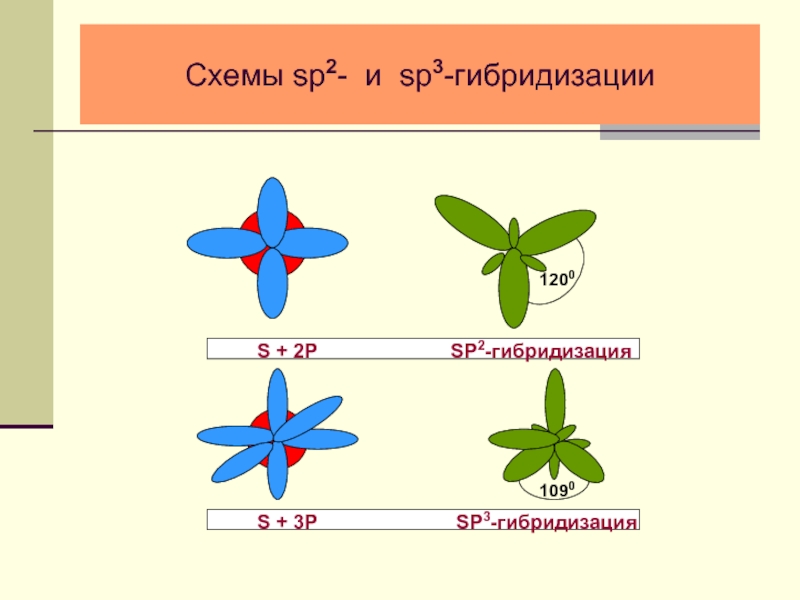
- 24. Схемы sp2- и sp3-гибридизации
- 25. Пространственная конфигурация некоторых соединений
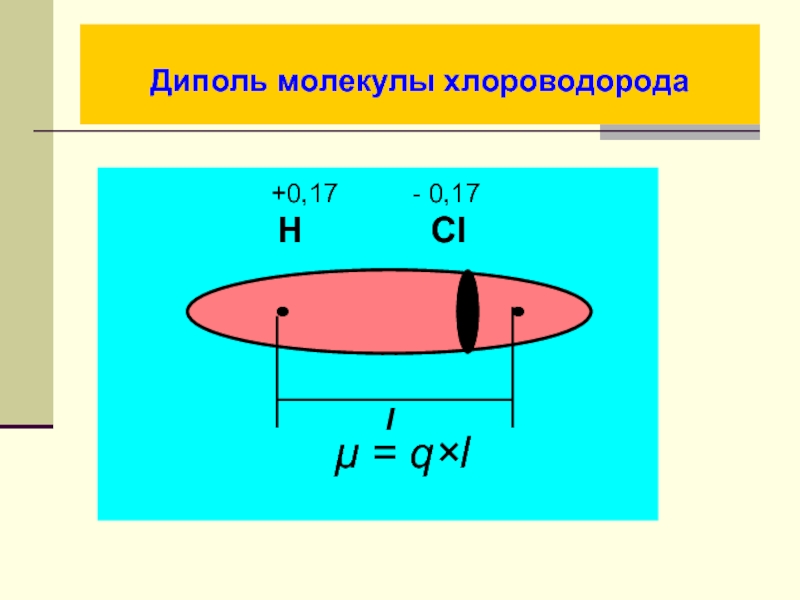
- 26. Диполь молекулы хлороводорода
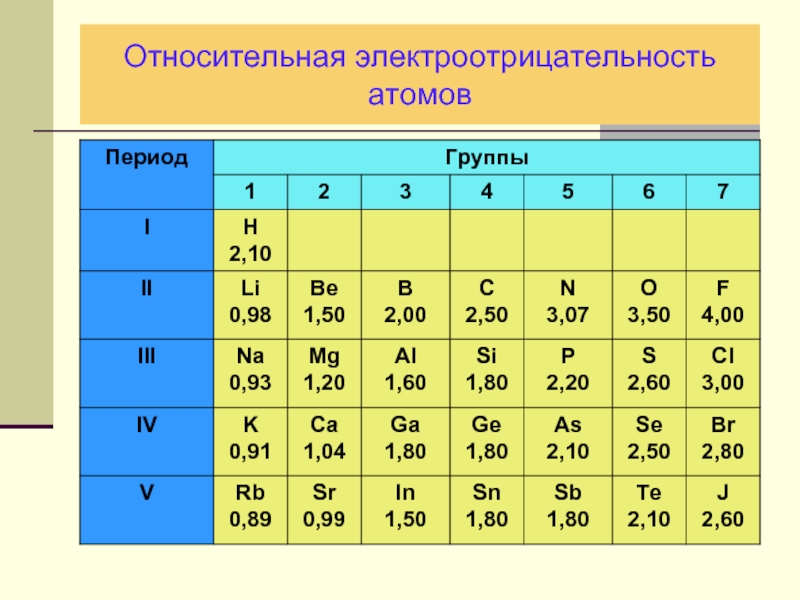
- 27. Относительная электроотрицательность атомов
- 28. Изменение энергии ионизации и сродства к электрону в периодах и группах периодической системы
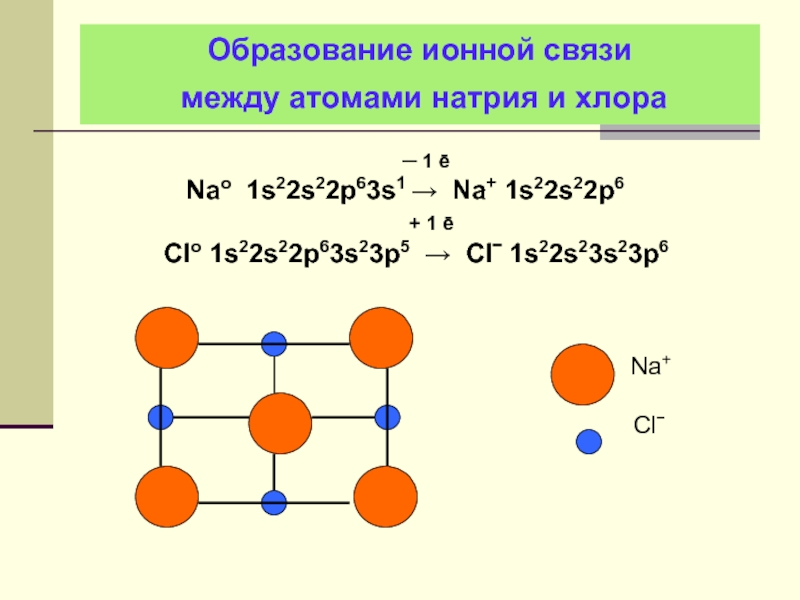
- 29. Образование ионной связи между атомами натрия и хлора
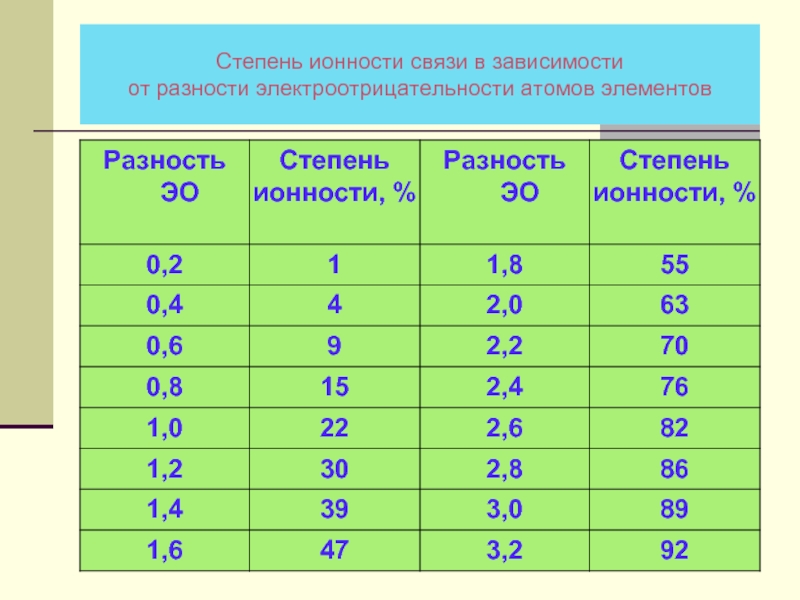
- 30. Степень ионности связи в зависимости от разности электроотрицательности атомов элементов
- 31. Линейная комбинация АО (метод ЛКАО)
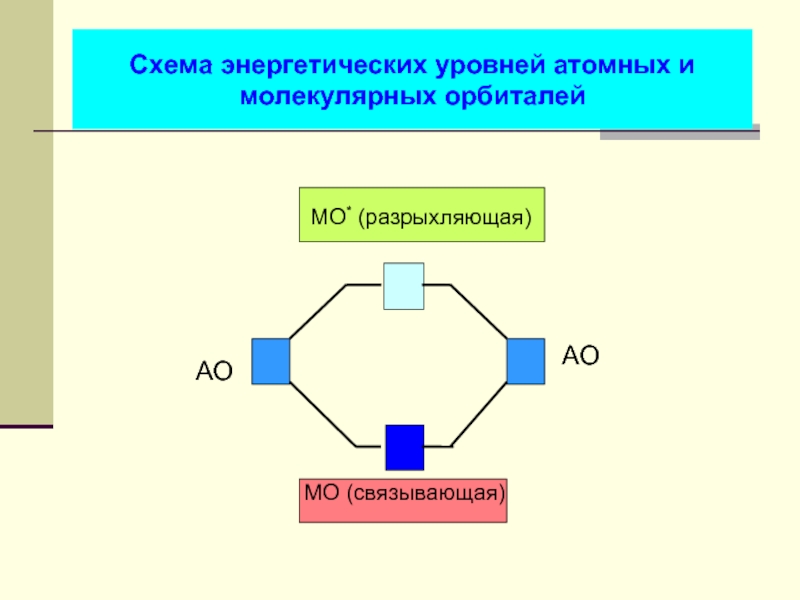
- 32. Схема энергетических уровней атомных и молекулярных орбиталей
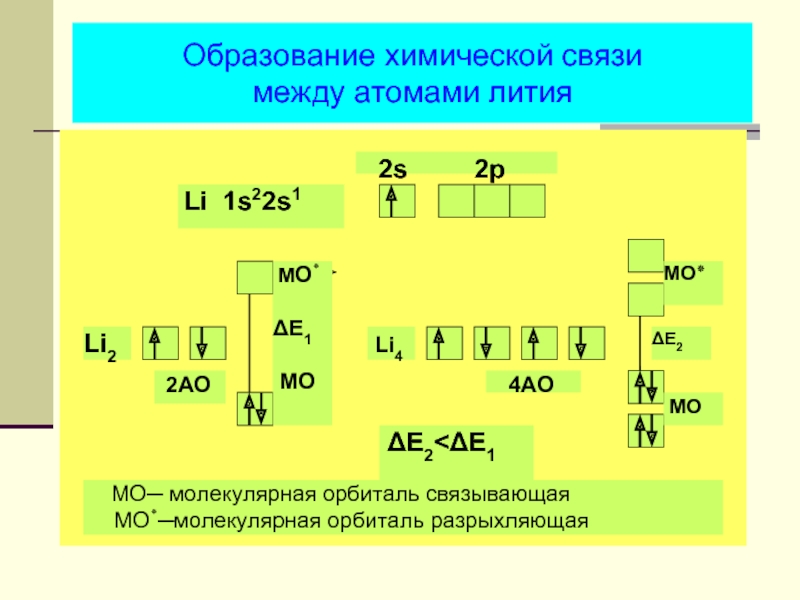
- 33. Образование химической связи между атомами лития
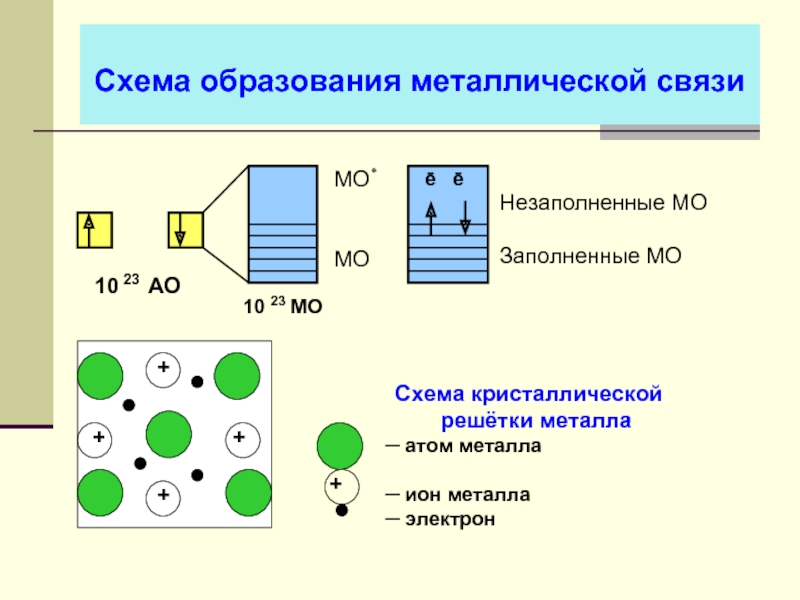
- 34. Схема образования металлической связи
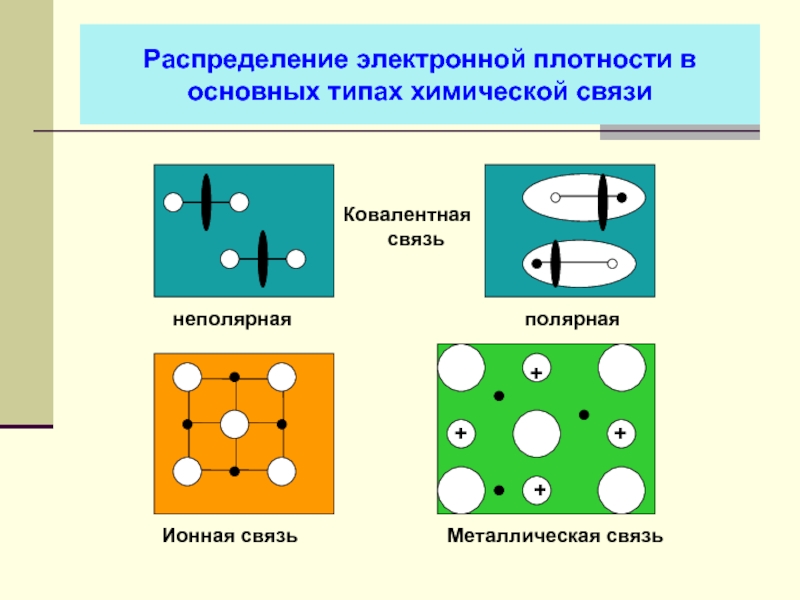
- 35. Распределение электронной плотности в основных типах химической связи
Слайд 1СТРОЕНИЕ ВЕЩЕСТВА
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Литература
Коровин Н.В. Общая
https://yadi.sk/d/iK3eIO3kkvvHj
Страничка «в контакте» https://vk.com/public131559854
Адрес электронной почты
lgkkn@rambler.ru
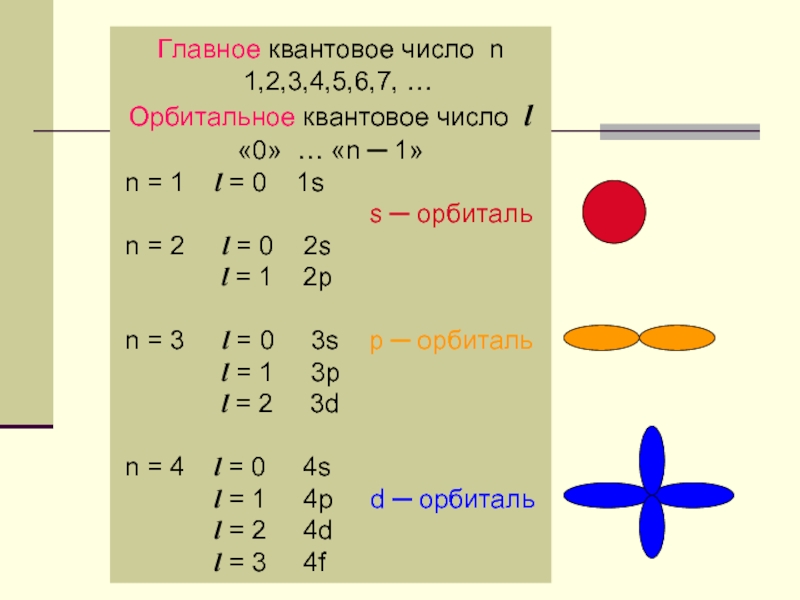
Слайд 2Главное квантовое число n
1,2,3,4,5,6,7, …
Орбитальное квантовое число l
«0» … «n
n = 1 l = 0 1s
s ─ орбиталь
n = 2 l = 0 2s
l = 1 2p
n = 3 l = 0 3s p ─ орбиталь
l = 1 3p
l = 2 3d
n = 4 l = 0 4s
l = 1 4p d ─ орбиталь
l = 2 4d
l = 3 4f
Слайд 3Магнитное квантовое число
–l,…, 0,…,+ l; N(ml) = (2 l +
l = 0 ml = 0
l = 1 ml = ─ 1; 0; +1
l = 2 ml = ─ 2; ─ 1; 0; +1; +2
l = 3 ml = ─ 3; ─ 2; ─ 1; 0; +1; +2; +3
s-орбиталь р -орбиталь d -орбиталь
Спиновое квантовое число
ms = + ½; ─ ½
Слайд 4Принцип Паули. В атоме не может быть двух электронов,
АО 1s: n=1 l =0 ml =0 ms= –½; +½
AO 3p: n=3 l =1 ml = –1; 0; +1 ms= –½; +½
На одной АО максимально может быть только два электрона
2 (2 l + 1)
s-орбиталь: 2 электрона
р-орбиталь: 6 электронов
d-орбиталь: 10 электронов
f-орбиталь: 14 электронов
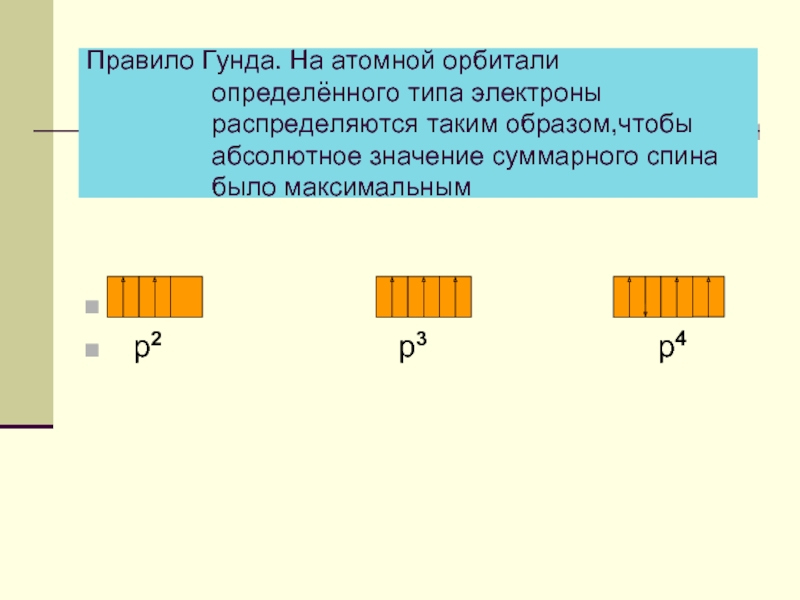
Слайд 5Правило Гунда. На атомной орбитали
р2 р3 р4
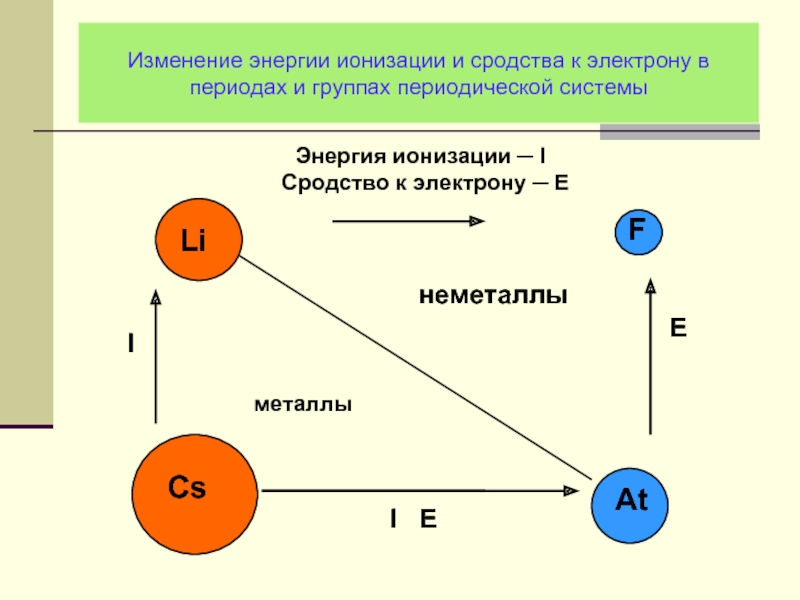
Слайд 11Изменение энергии ионизации и сродства к электрону в периодах и группах
Слайд 14Химическая связь
Литература
Коровин Н.В. Общая химия. – М.: Высш. шк., 2000.
Слайд 28Изменение энергии ионизации и сродства к электрону в периодах и группах
Слайд 31Линейная комбинация АО (метод ЛКАО)
ψАВ = аψА ±
ψАВ ─ волновая функция электрона в молекуле
ψА, ψВ ─ волновая функция атомов «А» и «В»
а, b ─ коэффициенты, учитывающие долю
каждой АО в образовании МО





![Донорно-акцепторный механизм образования ковалентной связи в ионе [NH4]+](/img/tmb/3/246134/809c2c6f2ca5a5e2f3f4cb72a2f79bf8-800x.jpg)