- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спирти. Одноатомні насичені спирти (алканоли) презентация
Содержание
- 1. Спирти. Одноатомні насичені спирти (алканоли)
- 2. ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ) Їх загальна
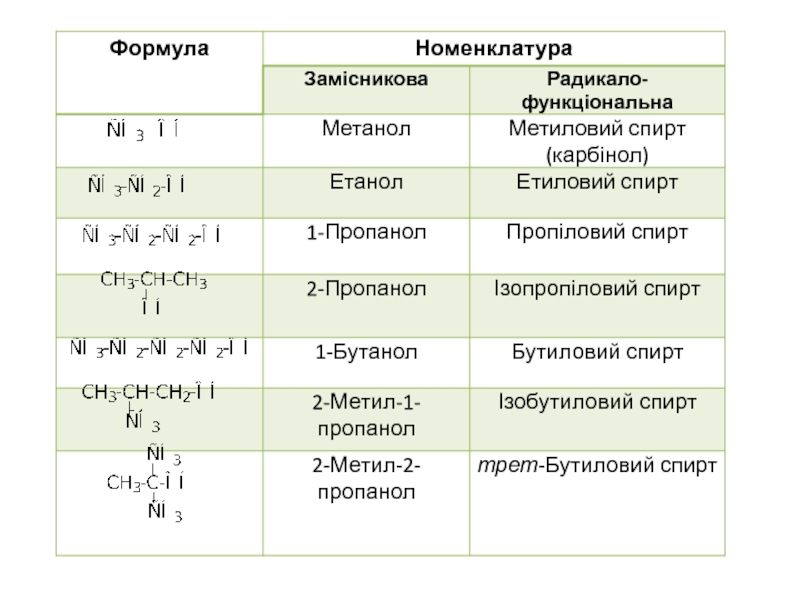
- 3. За замісниковою номенклатурою назву одноатомних насичених
- 4.
- 5. МЕТОДИ ДОБУВАННЯ До головних
- 6. ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ Гідратація алкенів
- 7. Естери також утворюють первинні
- 8. Синтез вищих спиртів
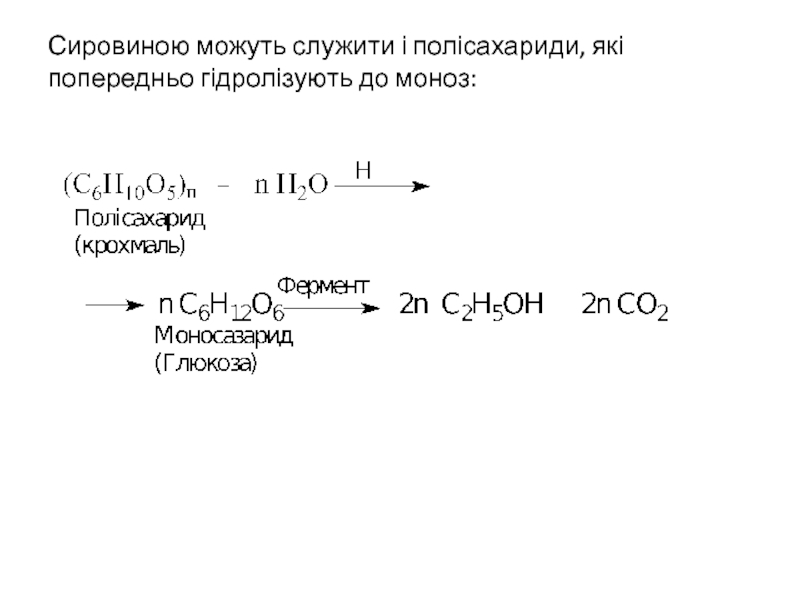
- 9. Сировиною можуть служити і полісахариди, які попередньо
- 10. ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ Гідроліз галогеноалкілів Гідроборування – окиснення алкенів.
- 11. ФІЗИЧНІ ВЛАСТИВОСТІ Спирти С1-С10- рідини, починаючи
- 12. ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості
- 13. Кислотно-основні властивості спиртів Зв’язок ОН
- 14. Поряд з кислотними властивостями, спирти проявляють
- 15. Заміщення гідроксильної групи на галоген
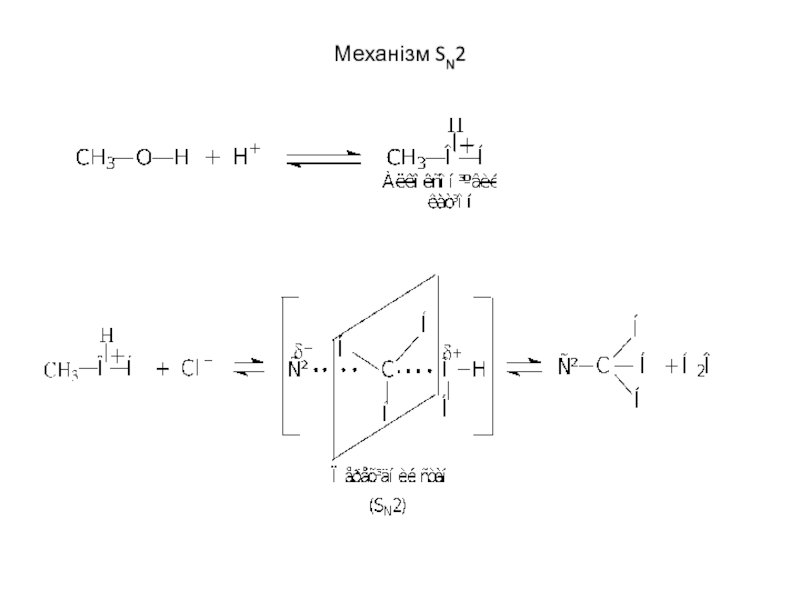
- 16. Механізм SN2
- 17. Взаємодія з галогеннуклеофілами PCl5,
- 18. Реакція утворення естерів (ацилювання спиртів)
- 19. Дегідратація спиртів (реакція Е) Реакцією
- 20. Окиснення спиртів Спирти окиснюються
- 21. ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ) Ненасиченими називаються
- 22. Найпростіший представник - вініловий спирт у вільному
- 23. Спирти Назарова - третинні вінілацетиленові (енінові) спирти,
- 24. ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ)
- 26. СПОСОБИ ДОБУВАННЯ Гідроліз дигалогенопохідних
- 27. ФІЗИЧНІ ВЛАСТИВОСТІ Гліколі мають більшу в’язкість
- 28. ХІМІЧНІ ВЛАСТИВОСТІ За своїми хімічними властивостями
- 29. З гідроксидами важких металів, наприклад (СuОН)2 такі
- 30. Естери утворюються при естерифікації гліколів мінеральними або
- 32. Міжмолекулярна дегідратація У випадку міжмолекулярної дегідратації можуть
- 33. ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТРИОЛИ) Спирти, що
- 34. ОДЕРЖАННЯ ГЛІЦЕРОЛУ 1. Гідроліз рослинних і тваринних
- 35. З пропену (головний промисловий метод одержання синтетичного
- 36. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Гліцерол за
- 37. 2. Утворення естерів Практичне значення має повний
- 38. 3. Дегідратація гліцеролу У присутності водовідщеплюючих
Слайд 1СПИРТИ
Спирти похідні вуглеводнів, у молекулах яких один або декілька атомів водню
Число гідроксильних груп визначає атомність спиртів. Одноатомні спирти містять у молекулі одну ОН-групу (С2Н5ОН), двоатомні - дві ОН-групи (СН2ОН-СН2ОН), триатомні - три ОН групи (СН2ОН-СНОН-СН2ОН).
Слайд 2ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ)
Їх загальна формула
R-ОН
Залежно від природи вуглеводневого радикалу, з
СН3
│
СН3—СН2—ОН СН3—СН—СН3 СН3—С—ОН
│ │
ОН СН3
Первинний спирт Вторинний спирт Третинний спирт
Слайд 3
За замісниковою номенклатурою назву одноатомних насичених спиртів утворюють від назви відповідного
Широкого розповсюдження набули також назви за радикало-функціональною номенклатурою. Для утворення назви спирту називають вуглеводневий залишок, сполучений з ОН-групою, додають суфікс –овий і слово спирт.
Слайд 5МЕТОДИ ДОБУВАННЯ
До головних промислових методів добування відносяться:
гідратація алкенів,
гідрування карбонільних
реакція оксосинтезу,
ферментативна переробка вуглеводів.
Крім цього, існують лабораторні методи одержання спиртів: гідроліз галогеноалкілів та синтез за допомогою металоорганічних сполук.
Слайд 6ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ
Гідратація алкенів
2-Пропанол
Гідрування карбонільних сполук (альдегідів, кетонів, естерів)
Так, альдегіди утворюють
Кетони утворюють вторинні спирти:
Слайд 7 Естери також утворюють первинні спирти (реакція Буво-Блана):
Етиловий естер
карбонової кислоти
Гідрування оксиду вуглецю або оксосинтез
Суміш оксиду вуглецю і водню (синтез-газ) залежно від умов процесу (природа каталізатора, температура, співвідношення компонентів) може утворювати різні спирти:
Суміш спиртів (синтол)
Слайд 8Синтез вищих спиртів
Ферментативна переробка вуглеводів
Ферментативне розщеплення вуглеводів (спиртове бродіння) здавна служить
Моносахарид
(глюкоза, фруктоза,
маноза)
Слайд 11ФІЗИЧНІ ВЛАСТИВОСТІ
Спирти С1-С10- рідини, починаючи з С11 - тверді речовини. Одноатомні
Температура кипіння спиртів вища, ніж у алкілгалогенідів і алканів з тим же числом вуглецевих атомів. Це пояснюється наявністю водневих зв’язків між молекулами спирту, які ведуть до утворення асоціатів.
Слайд 12
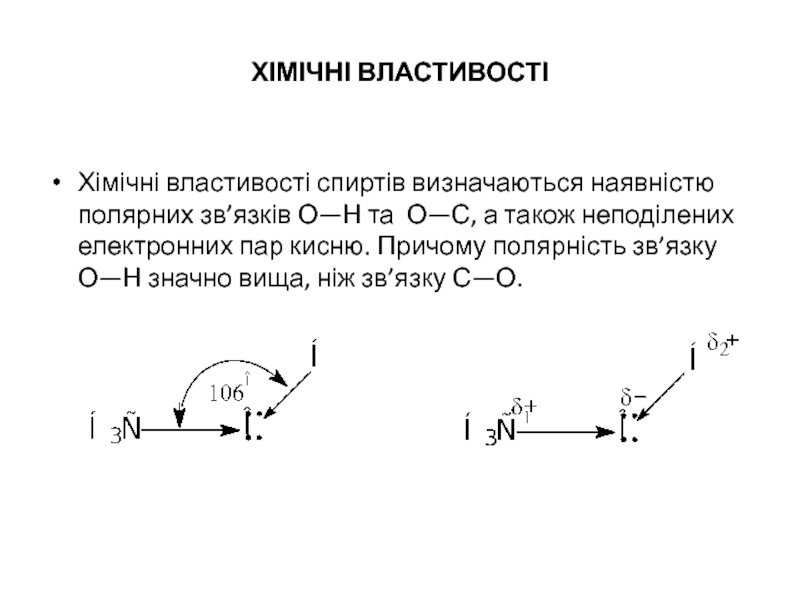
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічні властивості спиртів визначаються наявністю полярних зв’язків О—Н та О—С,
Слайд 13 Кислотно-основні властивості спиртів
Зв’язок ОН у спиртах досить полярний, тому
Кислотність спиртів підтверджується взаємодією їх з лужними металами (К, Na, тощо). При цьому утворюються алкоголяти, R—ОNa.
У водному середовищі алкоголяти легко гідролізують, тому одержати їх взаємодією спирту з лугом неможливо
Однак, спирти є слабшими кислотами, ніж вода і їх кислотність зменшується в ряді: первинний > вторинний > третинний.
Слайд 14
Поряд з кислотними властивостями, спирти проявляють основні властивості за рахунок наявності
Основність спиртів, на відміну від кислотності, зростає від первинних до третинних.
Спирти доволі легко протонуються з утворенням алкоксоніевих йонів.
Утворені алкоксонієві йони можуть легко відщеплювати воду, перетворюючись у карбокатіони
Таким чином, спиртам характерні амфотерні властивості: слабка кислотність або основність будуть переважати, залежно від природи спирту. Крім того, наявність неподілених пар електронів на атомі кисню надає їм нуклеофільності. Особливо сильні нуклеофіли алкоксианіони R—O–, які утворюються при дисоціації алкоголятів .
Слайд 15 Заміщення гідроксильної групи на галоген
При взаємодії спиртів з HCl,
Легше всього вступають у реакцію третинні спирти за механізмом SN1
потім вторинні і нарешті первинні (механізм SN2):
Слайд 17 Взаємодія з галогеннуклеофілами PCl5, PCl3, SOCl2, також веде до утворення алкілгалогенідів з
Слайд 18 Реакція утворення естерів (ацилювання спиртів)
При взаємодії спиртів з органічними
Ацилювання спиртів кислотами називають естерифікацією. Естерифікація протікає у присутності каталізаторів – сильних мінеральних кислот (конц.H2SO4, H3PO4 тощо). Реакція естерифікації – оборотна. Зворотна реакція називається гідролізом естеру.
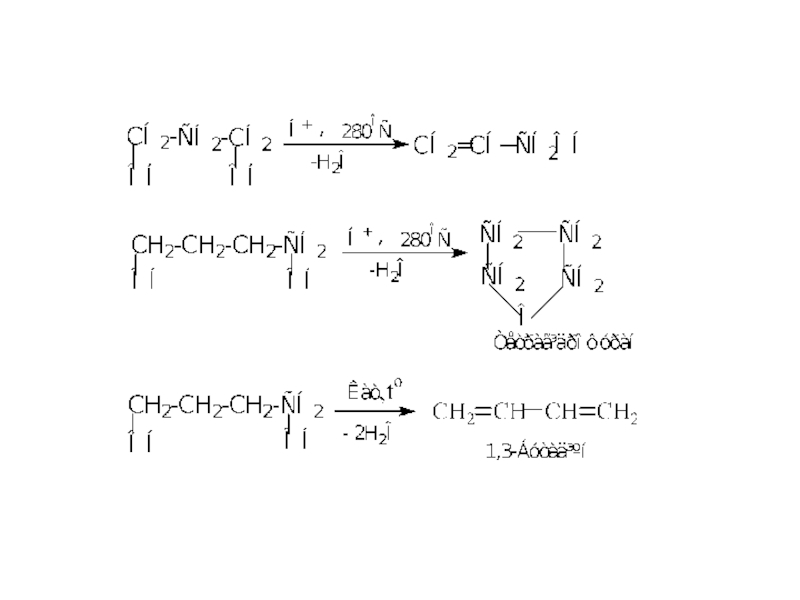
Слайд 19 Дегідратація спиртів (реакція Е)
Реакцією дегідратації зі спиртів отримують алкени
Встановлено, що легше дегідратуються третинні спирти, тоді вторинні і далі первинні .
В результаті міжмолекулярної дегідратації утворюються етери:
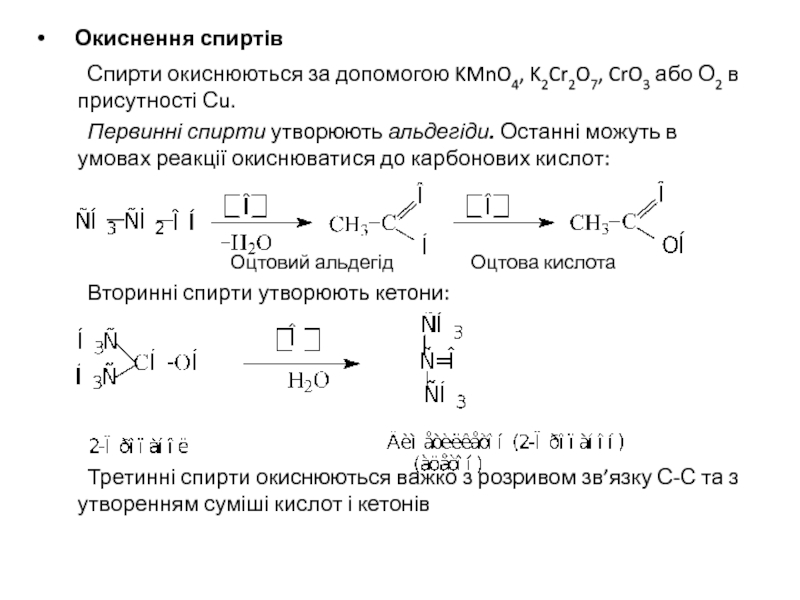
Слайд 20 Окиснення спиртів
Спирти окиснюються за допомогою KMnO4, K2Cr2O7, CrO3
Первинні спирти утворюють альдегіди. Останні можуть в умовах реакції окиснюватися до карбонових кислот:
Оцтовий альдегід Оцтова кислота
Вторинні спирти утворюють кетони:
Третинні спирти окиснюються важко з розривом зв’язку С-С та з утворенням суміші кислот і кетонів
Слайд 21ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ)
Ненасиченими називаються такі спирти, у яких гідроксильна
Нумерацію головного ланцюга починають з того кінця, ближче до якого знаходиться ОН-група.
Назви за радикало-функціональною номенклатурою утворюються аналогічно до назв насичених спиртів .
Етенол або Вініловий спирт
2-Пропен-1-ол або Аліловий спирт
2-Пропін-1-ол
Слайд 22Найпростіший представник - вініловий спирт у вільному вигляді не існує, тому
Натомість етери і естери вінілового спирту стійкі і застосовуються для одержання полімерів, наприклад:
Вінілбутиловий етер Вінілацетат
Аліловий спирт використовують для одержання гліцеролу, акролеїну, акрилової кислоти. Етери алілового спирту застосовують для одержання пластичних мас.
Пропаргіловий спирт використовують в органічному синтезі.
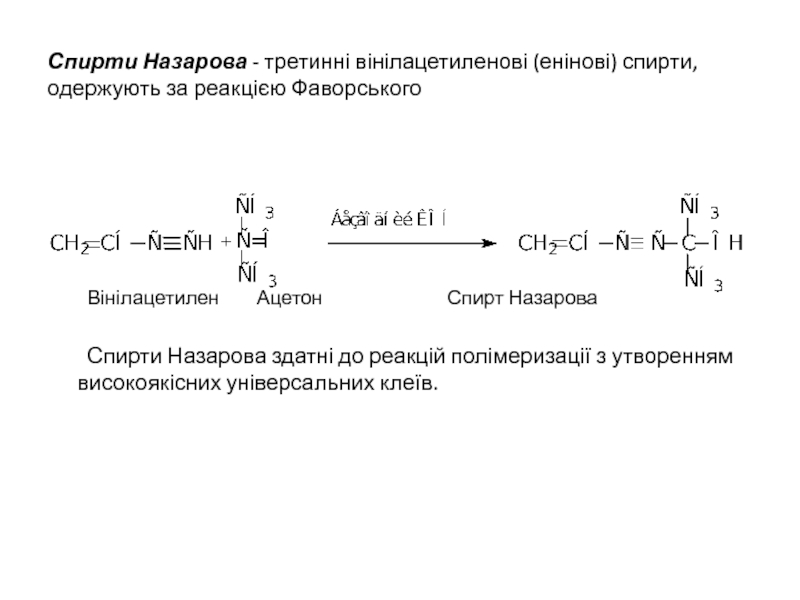
Слайд 23Спирти Назарова - третинні вінілацетиленові (енінові) спирти, одержують за реакцією Фаворського
Вінілацетилен
Спирти Назарова здатні до реакцій полімеризації з утворенням високоякісних універсальних клеїв.
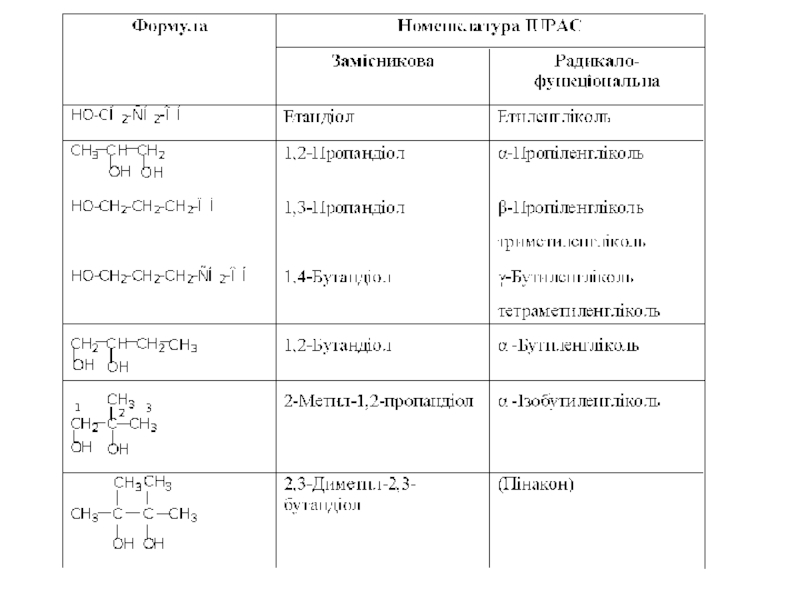
Слайд 24ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ)
Двоатомні насичені спирти або гліколі -
За систематичною замісниковою номенклатурою для утворення назви гліколя до назви відповідного алкану додають закінчення -діол і вказують місце груп ОН в головному ланцюзі. За радикало-функціональною номенклатурою назви діолів утворюють додаючи до назви відповідного двохвалентного радикала, що зв’язаний з двома ОН-групами, суфіксу - гліколь.
Слід відзначити, що гліколі з двома ОН-групами при одному атомі вуглецю не існують тому, що такі продукти одразу втрачають воду і перетворюються в альдегіди або кетони.
Слайд 26СПОСОБИ ДОБУВАННЯ
Гідроліз дигалогенопохідних
Гідратація органічних оксидів (епоксидів )
Окиснення алкенів водним розчином KMnO4
Як окиснювач може застосовуватись пероксид водню Н2О2:
Слайд 27ФІЗИЧНІ ВЛАСТИВОСТІ
Гліколі мають більшу в’язкість і киплять при вищих температурах, ніж
Слайд 28ХІМІЧНІ ВЛАСТИВОСТІ
За своїми хімічними властивостями вони аналогічні одноатомним спиртам. Однак, наявність
Кислотні властивості гліколів
Завдяки наявності другої ОН-групи, що проявляє -І-ефект, кислотність гліколів вища, ніж одноатомних спиртів (особливо гліколів з гідроксильними групами при сусідніх атомах вуглецю). Такі гліколі, на відміну від спиртів, вже здатні реагувати з гідроксидами лужних металів утворюючи відповідні гліколяти.
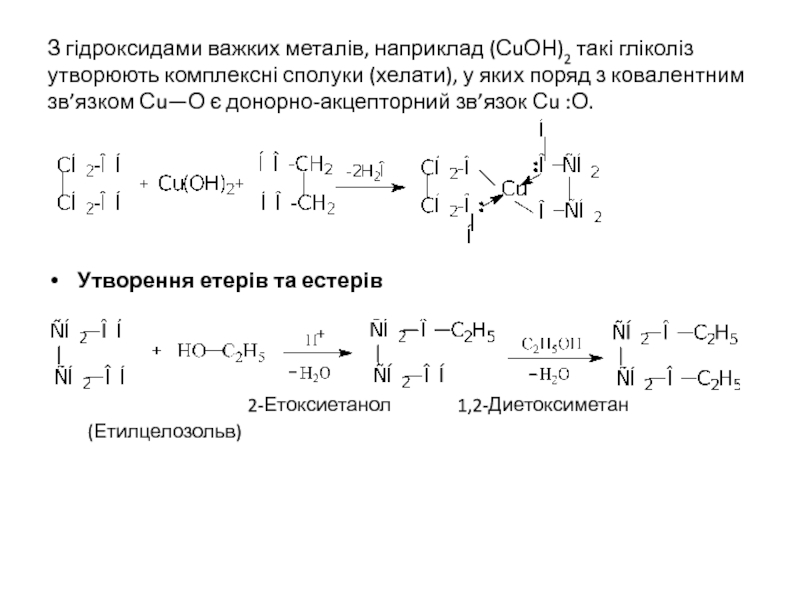
Слайд 29З гідроксидами важких металів, наприклад (СuОН)2 такі гліколіз утворюють комплексні сполуки
Утворення етерів та естерів
2-Етоксиетанол 1,2-Диетоксиметан (Етилцелозольв)
Слайд 30Естери утворюються при естерифікації гліколів мінеральними або органічними кислотами:
Реакції дегідратації
Внутрішньомолекулярна дегідратація
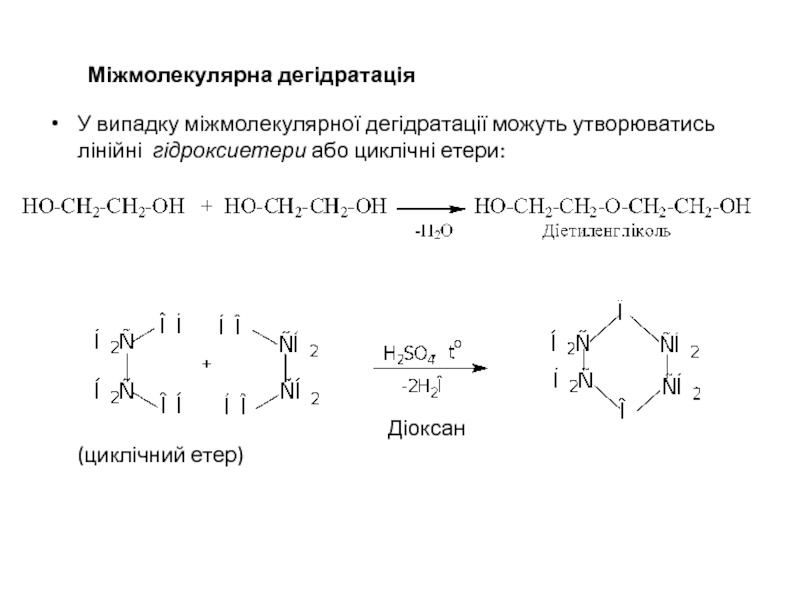
Слайд 32 Міжмолекулярна дегідратація
У випадку міжмолекулярної дегідратації можуть утворюватись лінійні гідроксиетери або циклічні
Діоксан (циклічний етер)
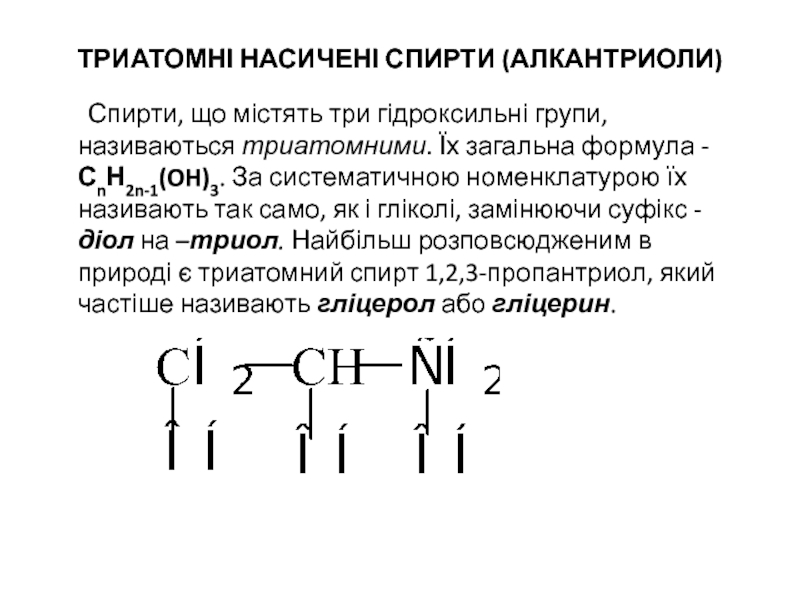
Слайд 33ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТРИОЛИ)
Спирти, що містять три гідроксильні групи, називаються триатомними.
Слайд 34ОДЕРЖАННЯ ГЛІЦЕРОЛУ
1. Гідроліз рослинних і тваринних жирів
Жири є естерами гліцеролу та
де (R=C15C17). У присутності лужних або кислотних каталізаторів протікає реакція гідролізу, яку інколи не зовсім правильно називають омиленням, тому що в такий спосіб добувають мило:
Слайд 35З пропену (головний промисловий метод одержання синтетичного гліцеролу)
Через алілхлорид.
Інколи застосовують оприєднання
Слайд 36
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Гліцерол за своїми властивостями нагадує гліколі. Це в’язка
1. Кислотні властивості
За кислотністю гліцерол перевищує гліколь внаслідок взаємного індуктивного впливу (-І-еф.) трьох гідроксильних груп. Так, з гідроксидами важких металів утворюються комплексні сполуки - гліцерати:
Слайд 372. Утворення естерів
Практичне значення має повний естер гліцеролу та нітратної кислоти
Взаємодією гліцеролу з карбоновими кислотами або їх ангідридами також одержують відповідні естери:
Слайд 383. Дегідратація гліцеролу
У присутності водовідщеплюючих засобів або каталізаторів при нагріванні протікає
Гліцерол використовується в виробництві пластичних мас нітрогліцерину в текстильній промисловості, в шкіропереробній галузі,– при виправці шкір і наданні їм мякості; в харчовій промисловості та при виробництві парфюмерно-косметичних засобів.