назад хоть кто-нибудь?
В дороге ничего не оставляйте –
Обратно не удастся повернуть
О. Хайям
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли серной кислоты презентация
Содержание
- 1. Соли серной кислоты
- 2. Соли серной кислоты Сульфаты (от лат. sulphur, sulfur
- 3. Урок №53. Сульфати
- 4. Соли серной кислоты
- 5. Соли серной кислоты
- 6. Соли серной кислоты
- 7. Соли серной кислоты Na2SO4 CuSO4·5Н2О NiSO4·7Н2О FeSO4·7H2O MnSO4·5Н2О MgSO4 Fe2(SO4)3·5H2O
- 8. Ce(SO4)2·4H2O CoSO4·7H2O FeSO4·7H2O MnSO4·H2O VOSO4·xH2O
- 9. Соли серной кислоты CuSO4·5H2O CuSO4 [Cu(NH3)4SO4]·H2O
- 10. Соли серной кислоты NiSO4·6H2O NiSO4
- 11. Fe (NH4)2(SO4)2·6H2O Соль Мора
- 12. Соли серной кислоты KAl(SO4)2·12H2O KCr(SO4)2·12H2O
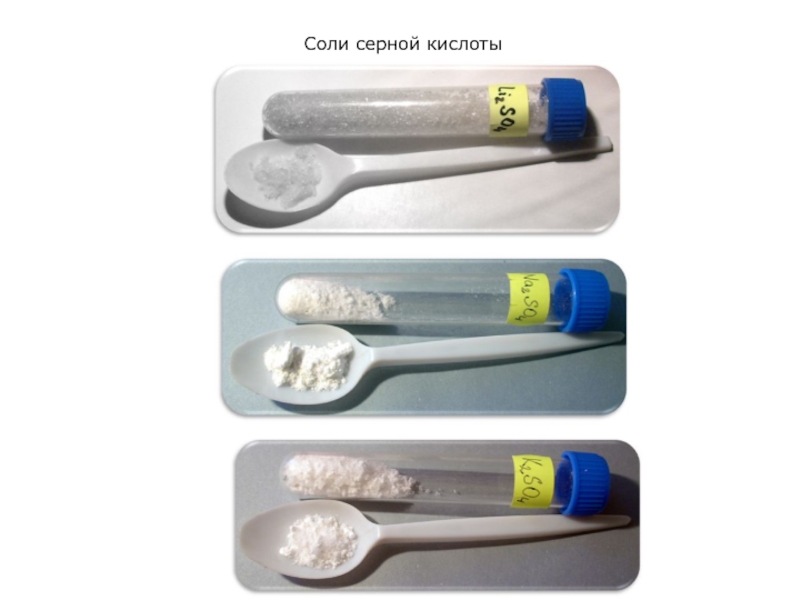
Слайд 2Соли серной кислоты
Сульфаты (от лат. sulphur, sulfur – сера), сернокислые соли, соли
серной кислоты H2SO4. Имеются два ряда сульфатов – средние (нормальные) общей формулы M2SO4 и кислые (гидросульфаты) – MHSO4, где М – одновалентный металл.
Сульфаты – кристаллические вещества, бесцветные (если катион бесцветен), в большинстве случаев хорошо растворимые в воде. Малорастворимые сульфаты встречаются в виде минералов: гипса CaSO4·2H2O, целестина SrSO4, англезита PbSO4 и др.
Практически нерастворимы барит BaSO4 и RaSO4.
Кислые сульфаты выделены в твёрдом состоянии лишь для наиболее активных металлов – Na, K и др. Они хорошо растворимы в воде, легко плавятся.
Нормальные сульфаты можно получить растворением металлов в H2SO4, действием H2SO4 на окиси, гидроокиси, карбонаты металлов и др.
Гидросульфаты получают нагреванием нормальных сульфатов с концентрированной H2SO4: K2SO4 + H2SO4 = 2KHSO4.
Кристаллогидраты сульфатов некоторых тяжёлых металлов называются купоросами.
Широкое применение во многих отраслях промышленности находят природные сульфаты.
Сульфаты – кристаллические вещества, бесцветные (если катион бесцветен), в большинстве случаев хорошо растворимые в воде. Малорастворимые сульфаты встречаются в виде минералов: гипса CaSO4·2H2O, целестина SrSO4, англезита PbSO4 и др.
Практически нерастворимы барит BaSO4 и RaSO4.
Кислые сульфаты выделены в твёрдом состоянии лишь для наиболее активных металлов – Na, K и др. Они хорошо растворимы в воде, легко плавятся.
Нормальные сульфаты можно получить растворением металлов в H2SO4, действием H2SO4 на окиси, гидроокиси, карбонаты металлов и др.
Гидросульфаты получают нагреванием нормальных сульфатов с концентрированной H2SO4: K2SO4 + H2SO4 = 2KHSO4.
Кристаллогидраты сульфатов некоторых тяжёлых металлов называются купоросами.
Широкое применение во многих отраслях промышленности находят природные сульфаты.







![Соли серной кислотыCuSO4·5H2OCuSO4[Cu(NH3)4SO4]·H2O](/img/tmb/2/178992/c0d19224b43aead0673161b15b8ffb34-800x.jpg)








