- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли аммония презентация
Содержание
- 1. Соли аммония
- 2. СОСТАВ солей аммония Соли аммония - это сложные
- 4. Физические свойства солей аммония Кристаллические вещества,
- 5. Химические свойства солей аммония ОБЩИЕ С
- 6. Химические свойства солей аммония ОБЩИЕ С
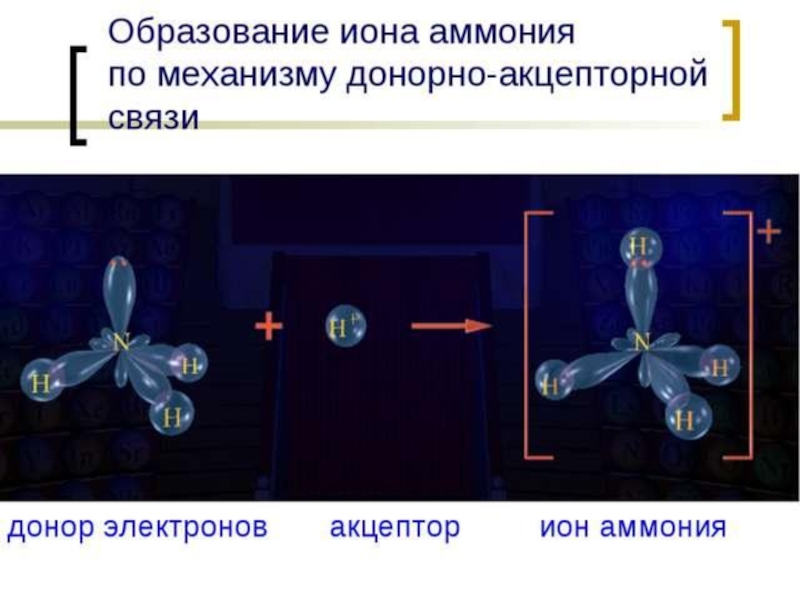
- 7. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 1.
- 8. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2.
- 9. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2.
- 10. Получение солей аммония Получают взаимодействием NH3 или
- 11. Применение солей аммония Русский химик Д.Н Прянишников
- 12. Роль азотных соединений в жизни человека и
- 13. Применение солей аммония
- 14. Применение солей аммония
- 15. Применение солей аммония
- 16. Применение солей аммония
- 17. Соли аммония Полезные, важные, Превращают пустыни в
- 18. Задания на оценку (выполнить в тетради) 1.
- 19. 2. Определите вещество (назовите его, приведя все
- 20. Распечатайте для дальнейшей работы лист по лабораторным способам получения газов. (Не заполнять!)
Слайд 2СОСТАВ солей аммония
Соли аммония - это сложные вещества, в состав которых входят
(NH4+ )хКО-х
ЗАДАНИЕ: составьте формулы солей аммония
карбонат аммония, хлорид аммония,
фосфат аммония, гидросульфат аммония,
сульфид аммония, гидрокарбонат аммония
Слайд 4Физические свойства солей аммония
Кристаллические
вещества,
хорошо растворимые
в воде
По строению, цвету
соли калия., т. к.
Радиусы ионов
NH4+ и К+
практически равны
Слайд 5Химические свойства солей аммония
ОБЩИЕ С ДРУГИМИ СОЛЯМИ
1) Диссоциируют в водных
NH4Cl ↔ NH4 ++ Cl-
ЗАДАНИЕ: напишите уравнения диссоциации следующих солей
(NH4) 2CO3 , (NH4)2SO4 , NH4НSO4
2) Взаимодействуют с кислотами (реакция обмена):
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2 ↑
2NH4+ +CO32- +2H+ +2Cl- →2NH4+ +2Cl- +Н2O +CO2↑
CO32- + 2H+ → Н2O + CO2 ↑
Слайд 6Химические свойства солей аммония
ОБЩИЕ С ДРУГИМИ СОЛЯМИ
3) Взаимодействуют с другими
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ +SO42- +Ba2+ +2NO3-→BaSO4 ↓+2NH4+ +2NO3-
Ba2+ + SO42- → BaSO4 ↓
Слайд 7Химические свойства солей аммония
СПЕЦИФИЧЕСКИЕ
1. При нагревании со щелочами выделяется аммиак
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Задание: Определите, в какой из трех пробирок находится сульфат аммония. Объясните этапы деятельности. Запишите качественную реакцию на обнаружения иона аммония.
Слайд 8Химические свойства солей аммония
СПЕЦИФИЧЕСКИЕ
2. Разлагаются при нагревании:
a) если кислота летучая
NH4Cl → NH3 ↑ + HCl ↑
(NH4) 2CO3 →
NH4HCO3 →
Слайд 9Химические свойства солей аммония
СПЕЦИФИЧЕСКИЕ
2. Разлагаются при нагревании:
б) если анион проявляет
t
NH4NО3 → N2 ↑ + 2H2О
или
t
NH4NO3 → N2O + 2Н2O
t
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O
Слайд 10Получение солей аммония
Получают взаимодействием NH3 или NH4OH с
кислотами:
NH3 + HNO3→NH4NO3
2NH4OH +
NH3 + HCl = NH4Сl (дым без огня)
ЗАДАНИЕ: напишите уравнения получения следующих солей
(NH4) 2CO3 , (NH4)3РО4 , NH4НSO4
Слайд 11Применение солей аммония
Русский химик Д.Н Прянишников выяснил что растения предпочитают ионы
Самое эффективное азотное удобрение – NH4NО3 нитрат аммония (аммиачная селитра). Сульфат аммония (NH4)2SO4 — дешёвое азотное удобрение
Слайд 12Роль азотных соединений в жизни человека и общества велика, а применение
Азот – основа жизни на земле.
На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония, нитраты, могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого. В белках содержится 18% азота.
«Жизнь – есть способ существования белковых тел» Ф. Энгельс
Без азота → нет белка →без белка →нет жизни.
Слайд 13Применение солей аммония
Нитрат аммония NH4NО3 в смеси с порошками алюминия
Слайд 14Применение солей аммония
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
Слайд 15Применение солей аммония
Хлорид аммония NH4Cl используют при паянии и лужении металлов,
В гальванических элементах (сухих батареях) в качестве электролита
Слайд 17Соли аммония
Полезные, важные,
Превращают пустыни в оазисы,
Реагируют, как все соли, с солями,
Разлагаются.
В сельском хозяйстве применяются.
СИНКВЕЙН
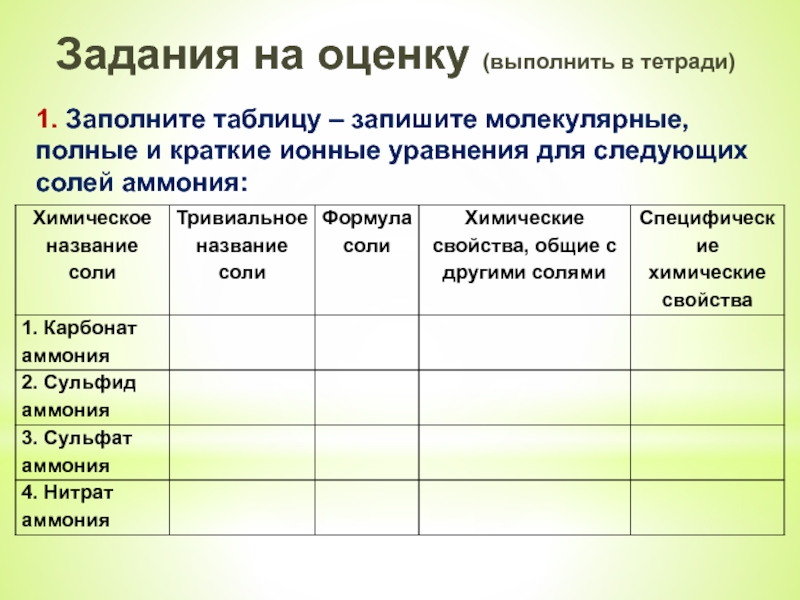
Слайд 18Задания на оценку (выполнить в тетради)
1. Заполните таблицу – запишите молекулярные,
Слайд 192. Определите вещество (назовите его, приведя все возможные названия; напишите формулу).
3. Сравните содержание азота в хлориде, сульфате и нитрате аммония. Какое из перечисленных соединений представляет большую ценность для минерального питания растений?
4. Решите задачу (по желанию на дополнительную оценку): При взаимодействии нитрата аммония с гидроксидом натрия образовалось 3,4 г газа. Найдите массу прореагировавшего раствора гидроксида натрия, если массовая доля гидроксида натрия в растворе 30%
Задания на оценку (выполнить в тетради)