Соединения галогенов.
Получение и применение галогеноводородов.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения галогенов презентация
Содержание
- 1. Соединения галогенов
- 2. * Водолазская О.А. * Водолазская О.А. Тема
- 3. * Водолазская О.А. * Водолазская О.А. Галогены
- 4. * Водолазская О.А. * Водолазская О.А. HF
- 5. * Водолазская О.А. * Водолазская О.А. Свойства
- 6. * Водолазская О.А. * Водолазская О.А.
- 7. * Водолазская О.А. * Водолазская О.А. Получение
- 8. * Водолазская О.А. * Водолазская О.А. Получение
- 9. * Водолазская О.А. * Водолазская О.А. Соли
- 10. * Водолазская О.А. Применение главная
- 11. * Водолазская О.А. * Водолазская О.А. Природные
- 12. * Водолазская О.А. * Водолазская О.А. Домашнее
- 13. * Водолазская О.А. * Водолазская О.А. Спасибо
Слайд 1Водолазская Ольга Анатольевна
МОУ "СОШ № 3 с. Алакуртти" Мурманской области
Слайд 2*
Водолазская О.А.
*
Водолазская О.А.
Тема урока: Соединения галогенов. Получение и применение.
Цель урока:
1.Рассмотреть свойства и
применение важнейших соединений
галогенов.
2.Изучить качественные реакции на
галогенид –ионы.
4.Рассмотреть природные соединения
галогенов.
3.Познакомиться со способами
получения галогеноводородов.
Слайд 3*
Водолазская О.А.
*
Водолазская О.А.
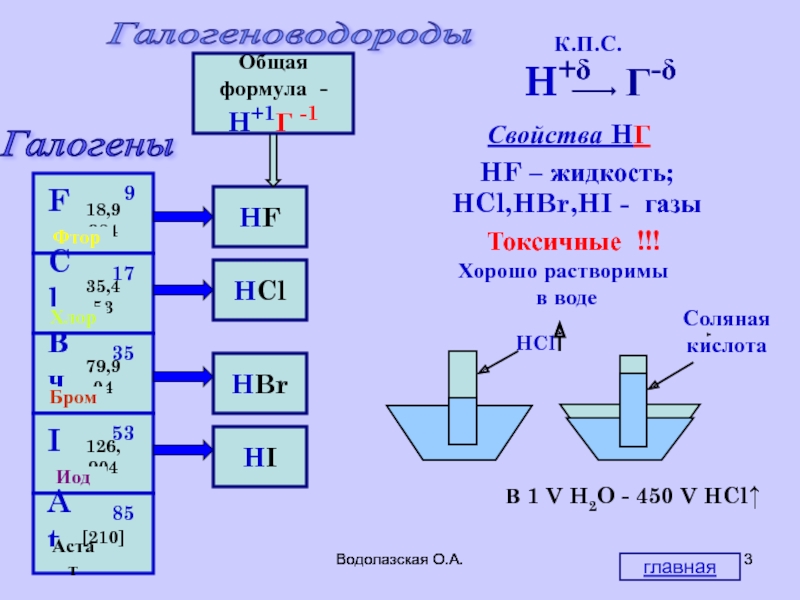
Галогены
Галогеноводороды
HF
HCl
HBr
HI
Общая
формула -
H+1Г -1
К.П.С.
Свойства HГ
Токсичные !!!
Хорошо растворимы
В 1 V H2O - 450 V HCl↑
HF – жидкость;
HCl,HBr,HI - газы
главная
Слайд 4*
Водолазская О.А.
*
Водолазская О.А.
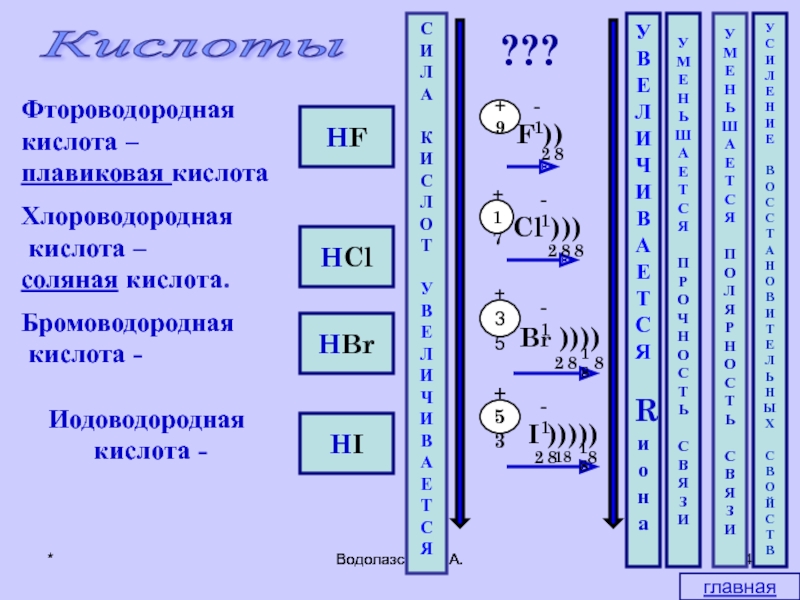
HF
HCl
HBr
HI
Кислоты
Фтороводородная
кислота –
плавиковая кислота
Хлороводородная
кислота –
соляная кислота.
Бромоводородная
кислота
Иодоводородная
кислота -
С
И
Л
А
К
И
С
Л
О
Т
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
???
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
R
и
о
н
а
У
М
Е
Н
Ь
Ш
А
Е
Т
С
Я
П
Р
О
Ч
Н
О
С
Т
Ь
С
В
Я
З
И
У
М
Е
Н
Ь
Ш
А
Е
Т
С
Я
П
О
Л
Я
Р
Н
О
С
Т
Ь
С
В
Я
З
И
главная
У
С
И
Л
Е
Н
И
Е
В
О
С
С
Т
А
Н
О
В
И
Т
Е
Л
Ь
Н
Ы
Х
С
В
О
Й
С
Т
В
Слайд 5*
Водолазская О.А.
*
Водолазская О.А.
Свойства
1.Изменяет
цвет
индикаторов
2.Ме(до Н2)
5.Соли
(более слабых
кислот)
4.Основания
3.Основные
оксиды
Домашнее задание:
Составить уравнения реакций,
подтверждающие
свойства соляной кислоты
Лакмус – красный
Метиловый оранжевый - розовый
Бесцветная жидкость, с резким
запахом, дымит на воздухе
Мч = ?
HCl
главная
Слайд 6*
Водолазская О.А.
*
Водолазская О.А.
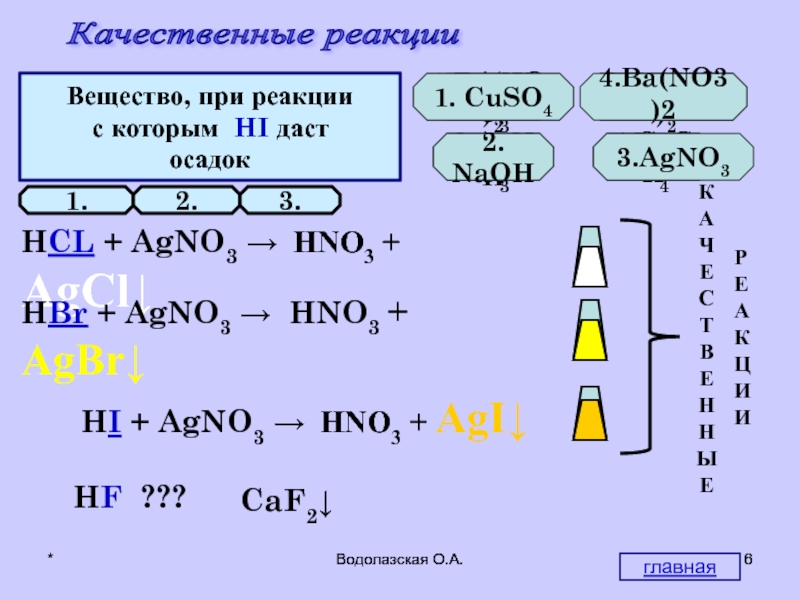
Качественные реакции
Вещество, при реакции
с которым HCl даст
осадок
1.AgNO3
2.NaOH
3.Ba(NO3)2
4.CuSO4
1.
Вещество,
с которым HBr даст
осадок
1.Ba(NO3)2
2.AgNO3
3.CuSO4
4.NaOH
2.
Вещество, при реакции
с которым HI даст
осадок
1. CuSO4
2. NaOH
3.AgNO3
4.Ba(NO3)2
3.
HCL + AgNO3 → HNO3 + AgCl↓
HBr + AgNO3 → HNO3 + AgBr↓
HI + AgNO3 → HNO3 + AgI↓
HF ???
CaF2↓
главная
Слайд 7*
Водолазская О.А.
*
Водолазская О.А.
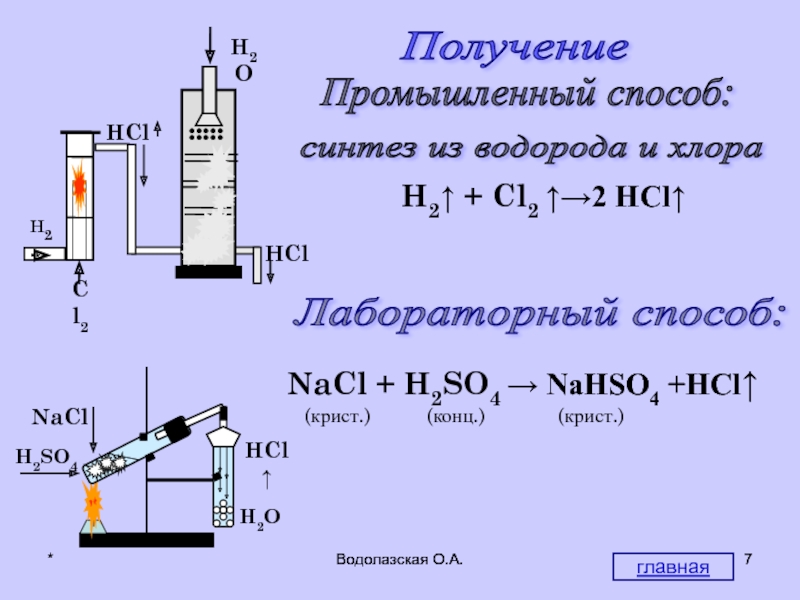
Получение
H2↑ + Cl2 ↑→2 HCl↑
Лабораторный способ:
NaCl +
(крист.) (конц.) (крист.)
главная
Слайд 8*
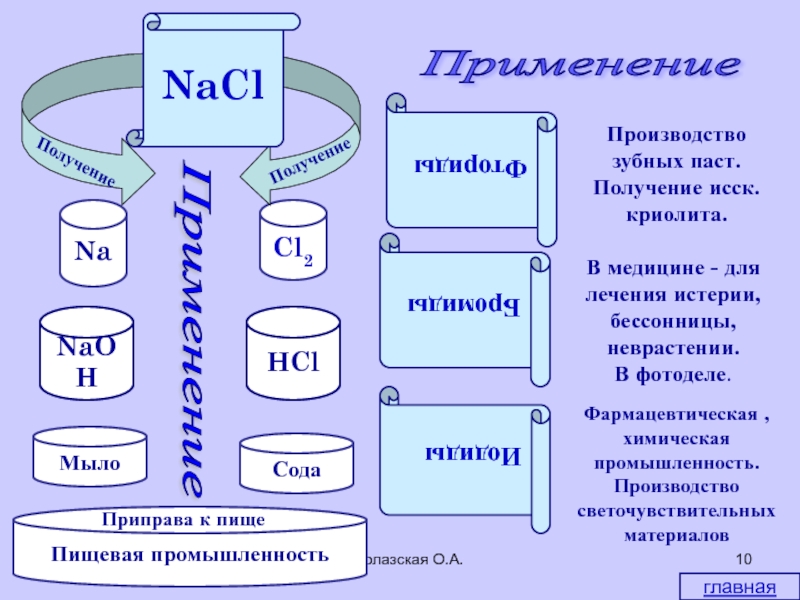
Водолазская О.А.
*
Водолазская О.А.
Получение
солей
При паянии
Производство
красок
Производство
пластмасс,
синтетических
материалов
Очистка
поверхности
металлов в
гальваностегии
Приготовление
лекарств
главная
Слайд 9*
Водолазская О.А.
*
Водолазская О.А.
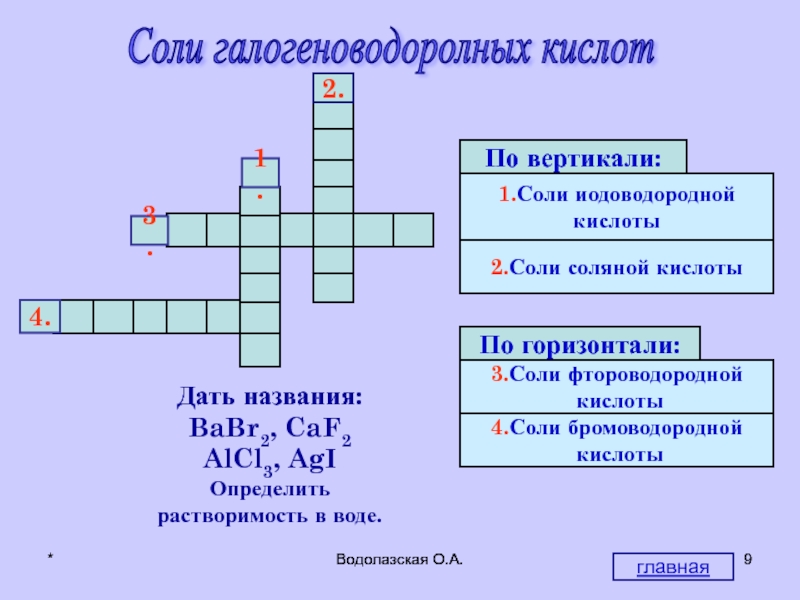
Соли галогеноводоролных кислот
М
И
И
Р
О
Ф
Т
Д
Ы
Д
И
И
Л
О
Р
Ы
Д
Ы
Д
Б
Р
О
Х
главная
1.
2.
4.
3.
Дать названия:
BaBr2, CaF2
AlCl3, AgI
Определить
растворимость в воде.
Слайд 11*
Водолазская О.А.
*
Водолазская О.А.
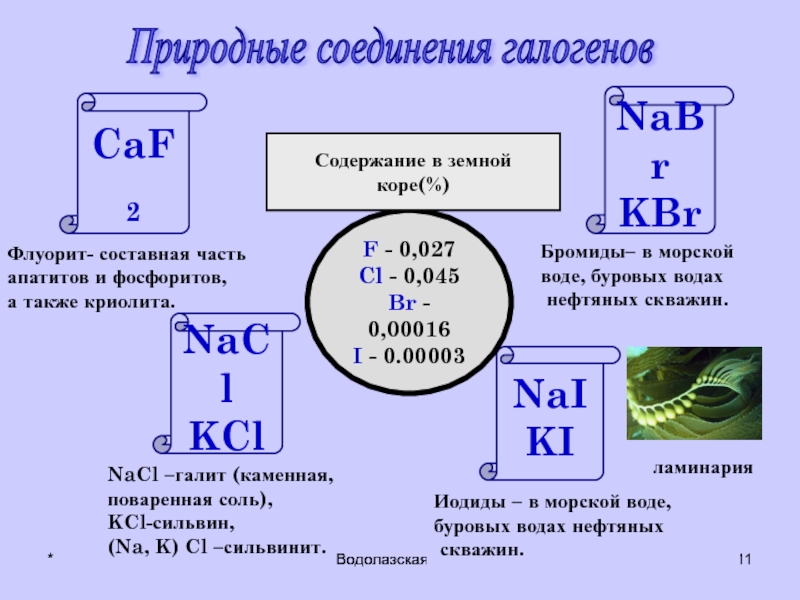
Природные соединения галогенов
главная
NaCl
KCl
CaF2
NaBr
KBr
NaI
KI
Флуорит- составная часть
апатитов и фосфоритов,
а также
NaCl –галит (каменная,
поваренная соль),
KCl-сильвин,
(Na, K) Cl –сильвинит.
Иодиды – в морской воде,
буровых водах нефтяных
скважин.
Бромиды– в морской
воде, буровых водах
нефтяных скважин.
ламинария
Слайд 12*
Водолазская О.А.
*
Водолазская О.А.
Домашнее задание:
Составить уравнения реакций,
подтверждающие химические
свойства соляной кислоты.
§18,
главная