Сабит Сания ТФП13-004-2
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром презентация
Содержание
- 1. Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
- 2. Структурной основой природных и синтетических пенициллинов является
- 3. ПЕННИЦИЛИНЫ Специфическая биологическая активность обусловлена наличием
- 4. ПОЛУЧЕНИЕ При промышленном производстве пенициллинов сначала
- 5. ПОЛУЧЕНИЕ На основе 6-АПК синтезировано большое
- 6. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ 1.Бензилпенициллина натриевая
- 7. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ 3.Бензилпенициллина новокаиновая соль Benzylpenicillinum novocainum
- 8. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ N,N’ - дибензилэтилендиаминовая соль бензилпенициллина 4.Бензатин-бензилпенициллин Benzathinum Benzylpenicillinum
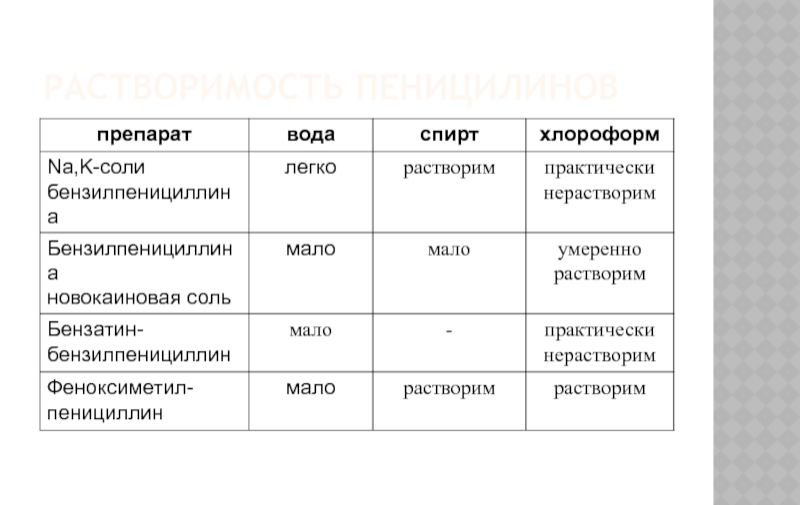
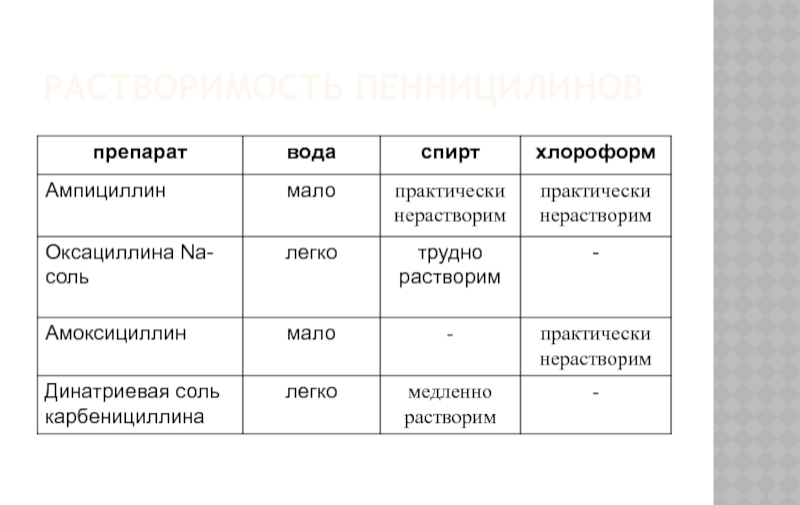
- 9. РАСТВОРИМОСТЬ ПЕНИЦИЛИНОВ
- 10. ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ 1.Ампициллина тригидрат Ampicillinum trihydratum
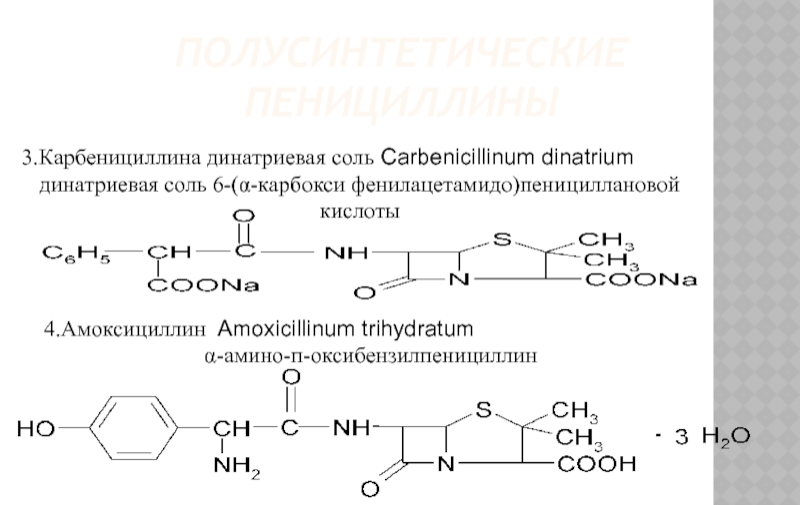
- 11. ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ 3.Карбенициллина динатриевая соль
- 12. РАСТВОРИМОСТЬ ПЕННИЦИЛИНОВ
- 13. ОБЩИЕ РЕАКЦИИ ДЛЯ ГРУППЫ Β - ЛАКТАМИДОВ
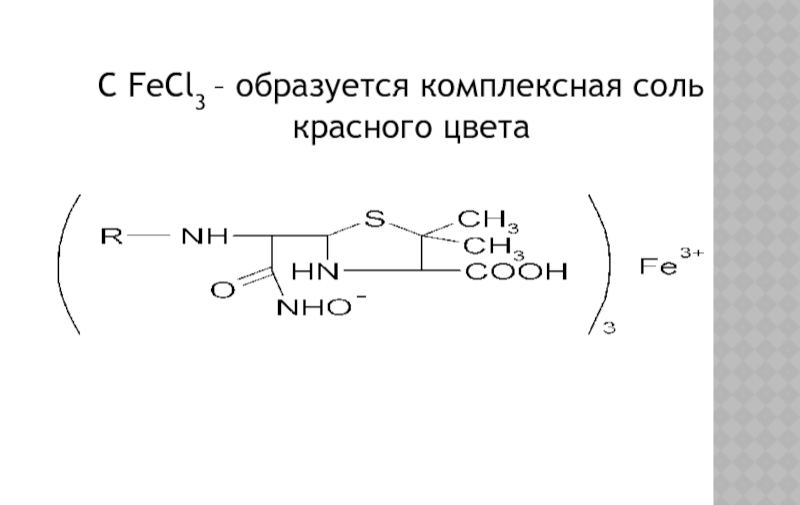
- 14. C FeCl3 – образуется комплексная соль красного цвета
- 15. ПРОБА ЛАССЕНЯ ДЛЯ ОБНАРУЖЕНИЯ N И S
- 16. ОКИСЛИТЕЛЬНАЯ МИНЕРАЛИЗАЦИЯ а) сплавление со щелочью
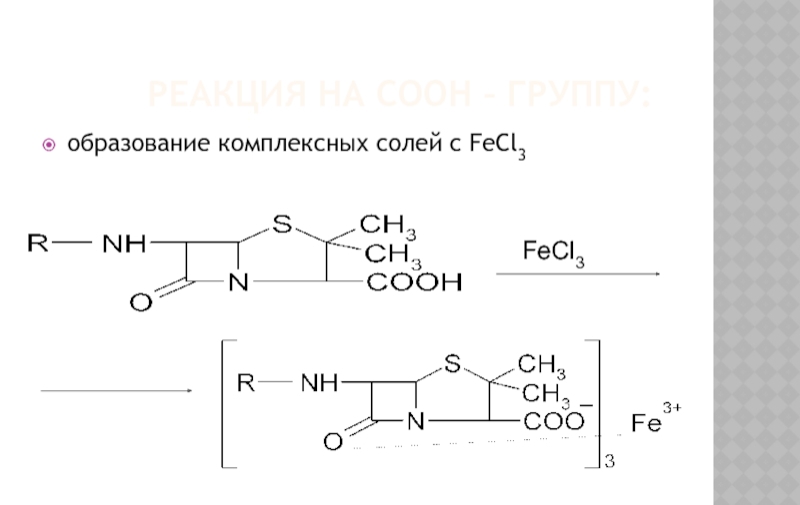
- 17. РЕАКЦИЯ НА СООН – ГРУППУ: образование комплексных
- 18. ампициллин – желтое окрашивание; бензилпенициллин (Na, K) – желтый осадок; феноксиметилпенициллин – желто-зеленый осадок.
- 19. ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ
- 20. ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ
- 21. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ Состоит из двух этапов:
- 22. H+ пенициламин пенальдиновая кислота + динатриевая соль пенициллоиновой кислоты NaOH
- 23. пенальдиновая кислота пенициламин пенициламиновая кислота Избыток
- 24. 2. МЕРКУРИМЕТРИЧЕСКИЙ МЕТОД ПОСЛЕ ПОСЛЕДОВАТЕЛЬНОГО ЩЕЛОЧНОГО И
- 25. Применение: антибактериальные препараты. Совместимость: пенициллины нельзя
- 26. ЦЕФАЛОСПОРИНЫ Структурная основа – конденсированная система,
- 27. Описание: белые кристаллические порошки, практически не растворимы
- 28. ПОЛУЧЕНИЕ Природный цефалоспорин С – продукт
- 29. ПОЛУЧЕНИЕ Антибиотики цефалоспориновой группы син-тезируются на
- 30. ПОЛУЧЕНИЕ
- 31. ЦЕФАЛОСПОРНИЫ
- 32. ЦЕФАЛОСПОРИНЫ Цефалотина натриевая соль Cefalotinum natrium
- 33. 1.Цефалексин - на аминокислоту: нингидриновая проба и
- 34. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: 1. Обратная йодометрия 2. Меркуриметрия.
Слайд 1СИНТЕТИЧЕСКИЕ МЕТОДЫ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ГЕТЕРОЦИКЛИЧЕСКОГО РЯДА АНТИБИОТИКИ С ЧЕТЫРЕХЧЛЕННЫМ АЗЕТИДИНОВЫМ
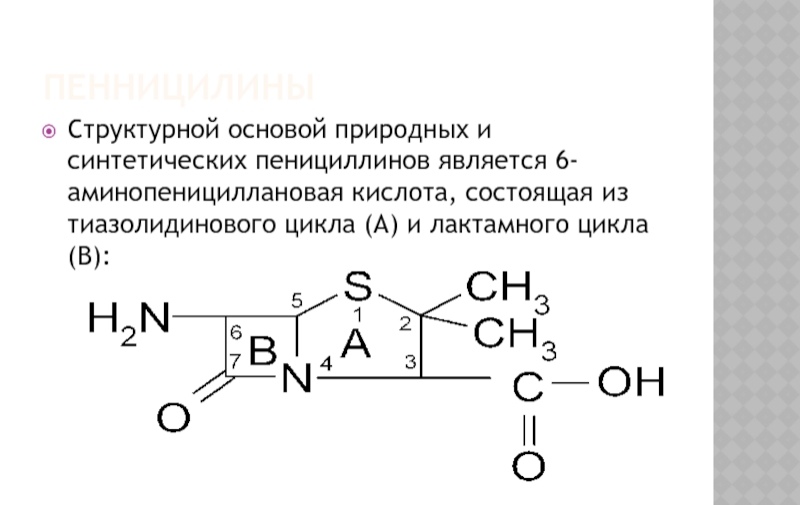
Слайд 2Структурной основой природных и синтетических пенициллинов является 6-аминопенициллановая кислота, состоящая из
ПЕННИЦИЛИНЫ
Слайд 3ПЕННИЦИЛИНЫ
Специфическая биологическая активность обусловлена наличием тиазолидинового и лактамного колец, а
Биосинтез природных пенициллинов осуществляется отобранными промышленными штаммами плесени, инкубированными в питательной среде, содержащей аминокислоты, углеводы, жиры и обязательно предшественников для формирования радикала в 6-ом положении.
Для выделения и очистки пенициллинов используют хроматографию, ионообменную сорбцию.
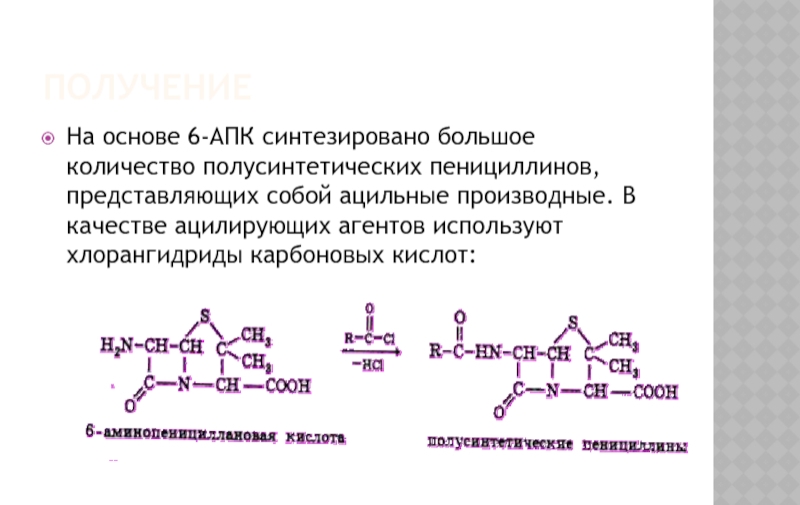
Природные пенициллины имеют серьезный недостаток – они легко разрушаются под действием фермента пенициллиназы (β-лактамазы). Это послужило предпосылкой для синтеза полусинтетических пенициллинов на основе 6-амино-пенициллановой кислоты (6-АПК), которую чаще всего ацилируют по аминогруппе в 6-ом положении.
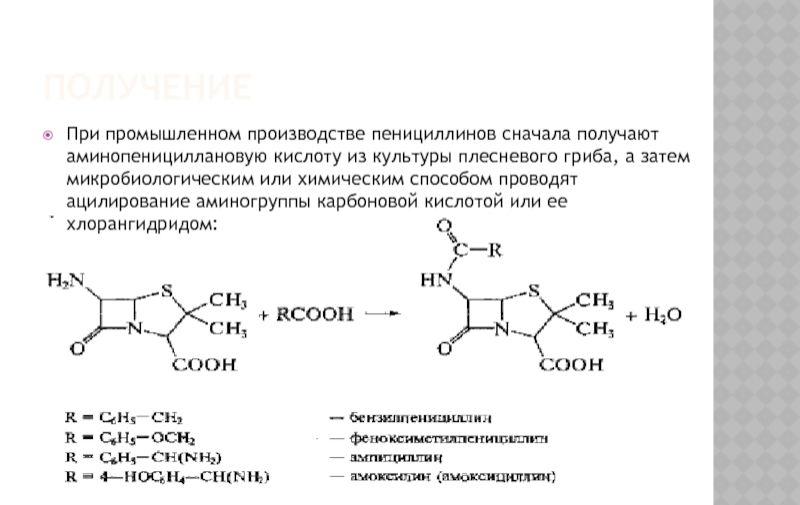
Слайд 4ПОЛУЧЕНИЕ
При промышленном производстве пенициллинов сначала получают аминопенициллановую кислоту из культуры
Слайд 5ПОЛУЧЕНИЕ
На основе 6-АПК синтезировано большое количество полусинтетических пенициллинов, представляющих собой
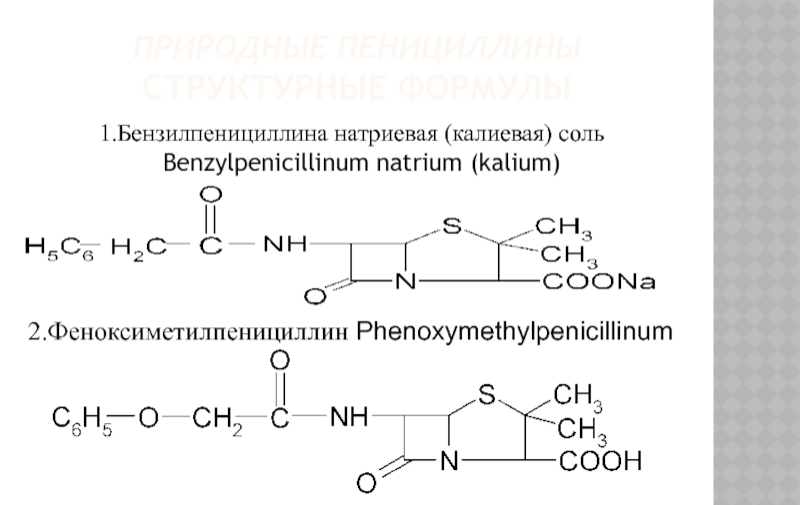
Слайд 6ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ
СТРУКТУРНЫЕ ФОРМУЛЫ
1.Бензилпенициллина натриевая (калиевая) соль Benzylpenicillinum natrium (kalium)
2.Феноксиметилпенициллин Phenoxymethylpenicillinum
Слайд 7ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ
СТРУКТУРНЫЕ ФОРМУЛЫ
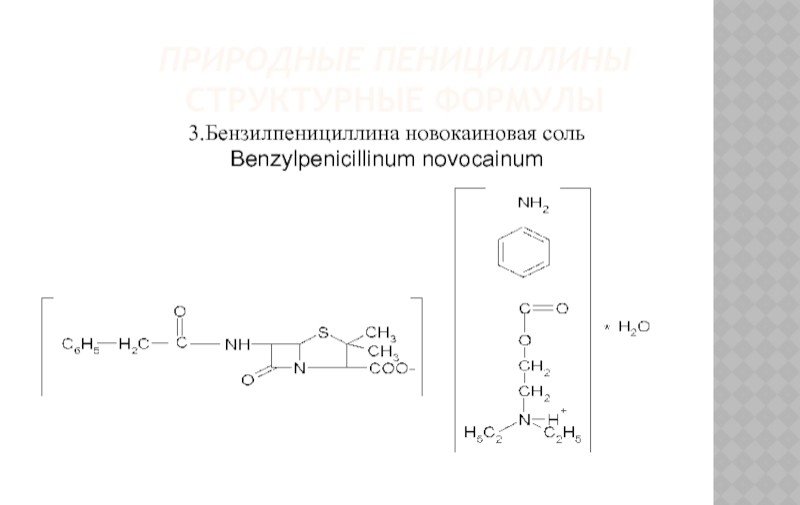
3.Бензилпенициллина новокаиновая соль
Benzylpenicillinum novocainum
Слайд 8ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ
СТРУКТУРНЫЕ ФОРМУЛЫ
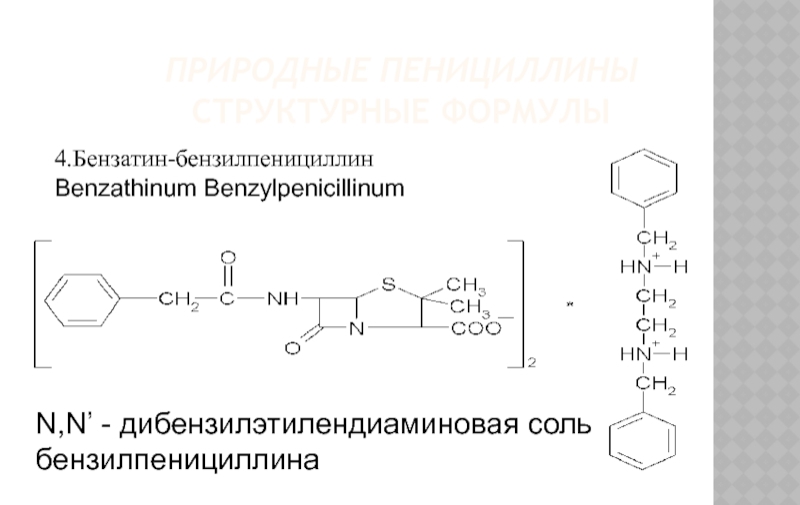
N,N’ - дибензилэтилендиаминовая соль бензилпенициллина
4.Бензатин-бензилпенициллин
Benzathinum Benzylpenicillinum
Слайд 10ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ
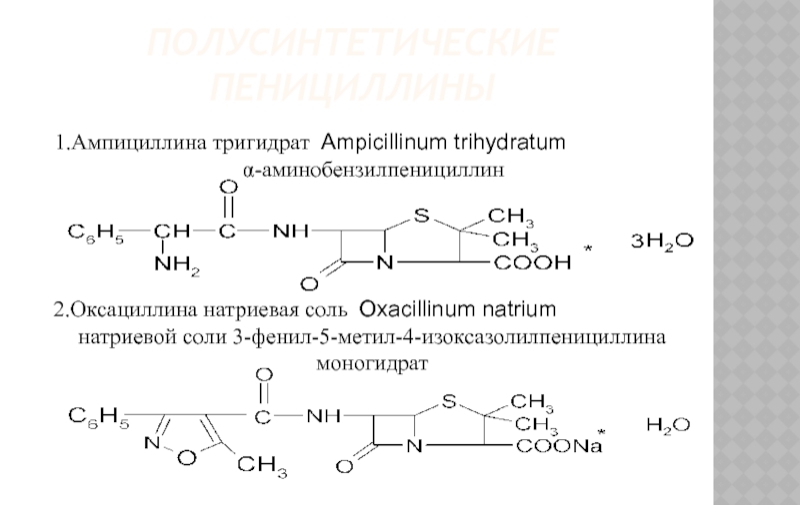
1.Ампициллина тригидрат Ampicillinum trihydratum
α-аминобензилпенициллин
2.Оксациллина натриевая соль Oxacillinum natrium
натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина
Слайд 11ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ
3.Карбенициллина динатриевая соль Carbenicillinum dinatrium
динатриевая соль 6-(α-карбокси фенилацетамидо)пенициллановой кислоты
4.Амоксициллин Amoxicillinum
α-амино-п-оксибензилпенициллин
Слайд 13ОБЩИЕ РЕАКЦИИ ДЛЯ ГРУППЫ Β - ЛАКТАМИДОВ
Разрыв β–лактамного кольца
NH2OH
NaOH
Cu2+
Зеленый осадок
Слайд 15ПРОБА ЛАССЕНЯ ДЛЯ ОБНАРУЖЕНИЯ N И S
Препарат прокаливают с солями Na,
а) к части фильтрата добавляют FeSO4, затем при подкислении приливают FeCl3. Образуется синий осадок – берлинская лазурь.
6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4;
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl
б) часть фильтрата нагревают с соляной кислотой, образуется H2S, который обнаруживается по почернению бумаги пропитанной Pb(CH3COO)2.
Слайд 16ОКИСЛИТЕЛЬНАЯ МИНЕРАЛИЗАЦИЯ
а) сплавление со щелочью с образованием S2- иона:
или с нитропруссидом Na – красно-фиолетовое окрашивание Na4[Fe(CN)5NOS]
б) минерализация в концентрированной азотной кислоте (HNO3) до сульфат – иона:
SO42- + Ba2+ → BaSO4 ↓
Слайд 18ампициллин – желтое окрашивание;
бензилпенициллин (Na, K) – желтый осадок;
феноксиметилпенициллин – желто-зеленый
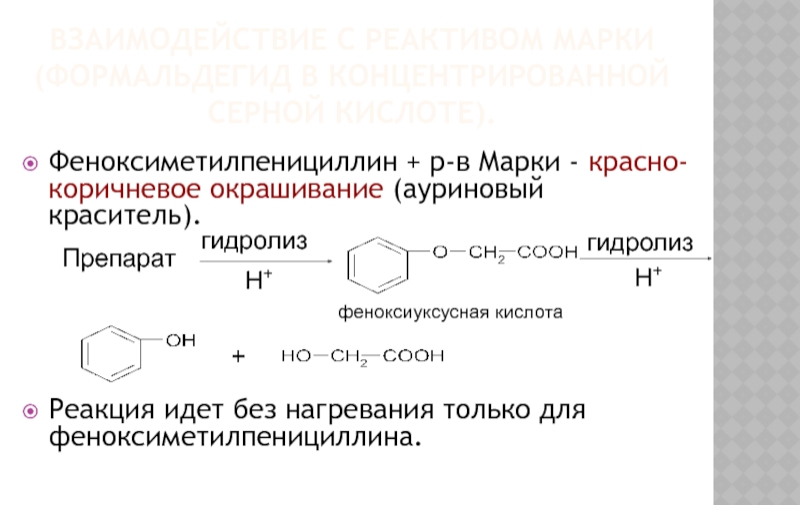
Слайд 19ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ).
Феноксиметилпенициллин + р-в
Реакция идет без нагревания только для феноксиметилпенициллина.
H+
Препарат
гидролиз
H+
гидролиз
феноксиуксусная кислота
+
Слайд 20ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ).
Соли бензилпенициллина +
Ампициллин + р-в Марки - темно-желтое окрашивание
Амоксициллин + р-в Марки - темно-желтое окрашивание
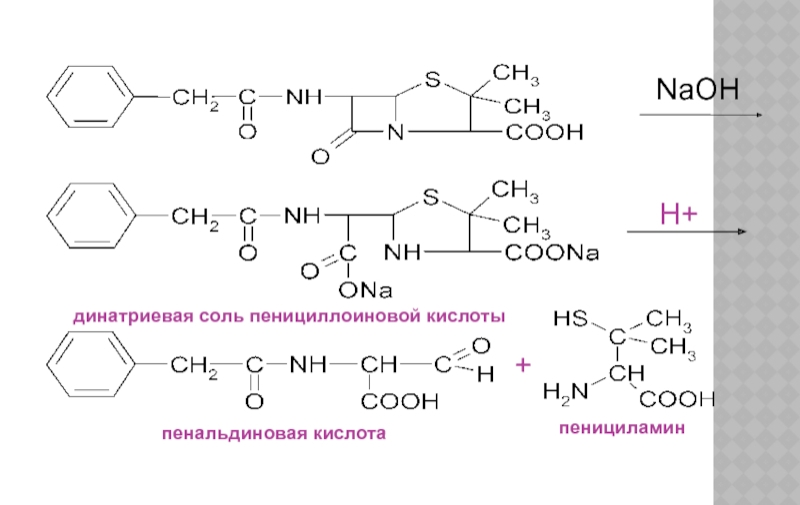
Слайд 21КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Состоит из двух этапов: определение суммы пенициллинов и определение соответствующего
1. Обратная йодометрия (ГФХ)
продукты последовательного щелочного, а затем кислотного гидролиза окисляют избытком стандартного раствора йода J2 при рН 4,5
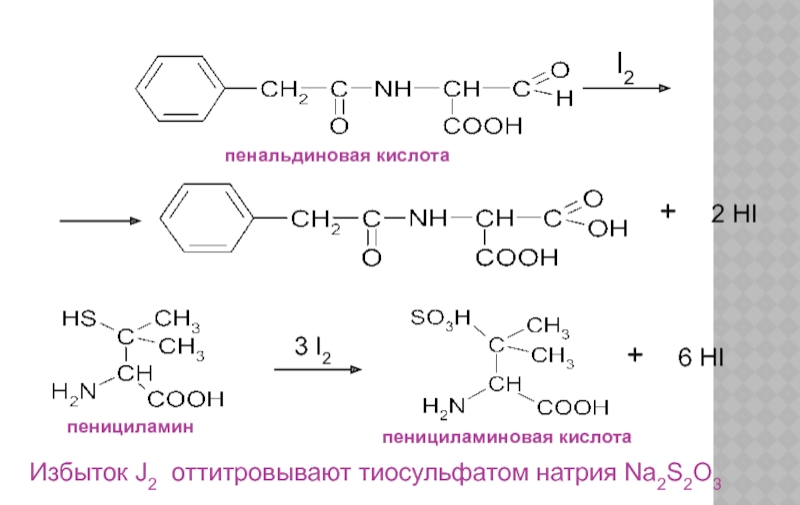
Слайд 23пенальдиновая кислота
пенициламин
пенициламиновая кислота
Избыток J2 оттитровывают тиосульфатом натрия Na2S2O3
+
I2
2 HI
+
6 HI
3
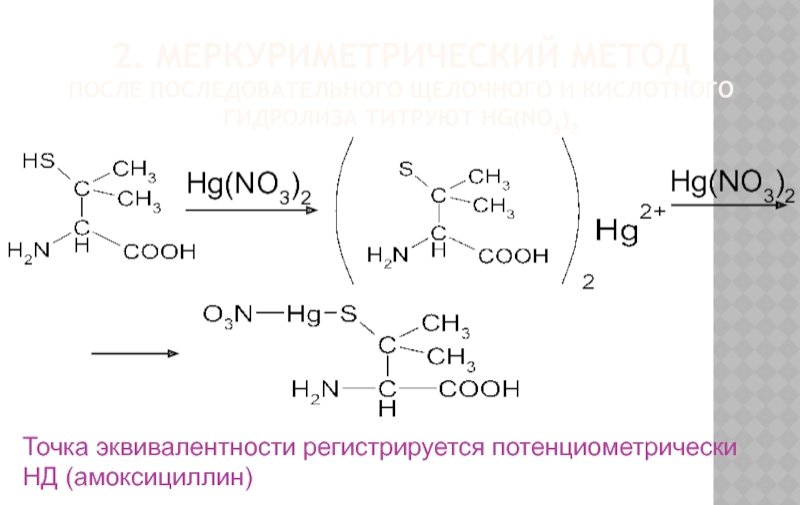
Слайд 242. МЕРКУРИМЕТРИЧЕСКИЙ МЕТОД
ПОСЛЕ ПОСЛЕДОВАТЕЛЬНОГО ЩЕЛОЧНОГО И КИСЛОТНОГО ГИДРОЛИЗА ТИТРУЮТ HG(NO3)2
Точка эквивалентности
НД (амоксициллин)
Hg(NO3)2
Hg(NO3)2
Слайд 25Применение: антибактериальные препараты.
Совместимость: пенициллины нельзя объединять с аминогликозидами в одном шприце,
Хранение: в сухом месте при комнатной температуре, флаконы.
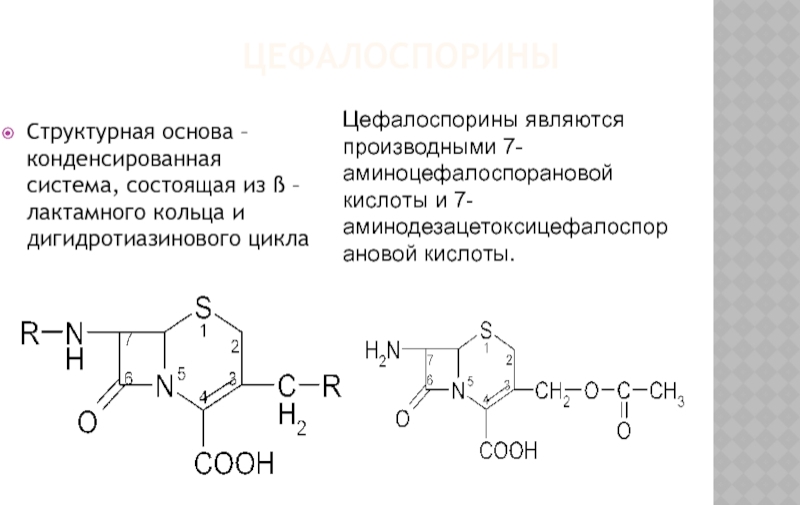
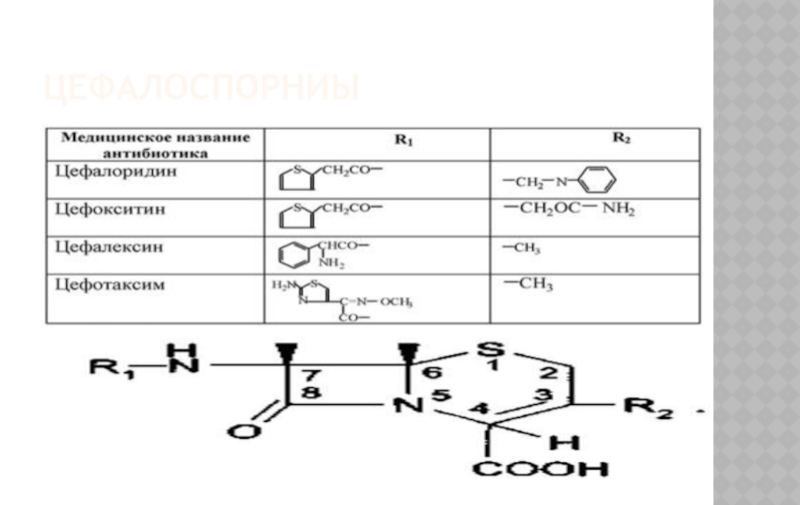
Слайд 26ЦЕФАЛОСПОРИНЫ
Структурная основа – конденсированная система, состоящая из ß – лактамного
Цефалоспорины являются производными 7-аминоцефалоспорановой кислоты и 7-аминодезацетоксицефалоспорановой кислоты.
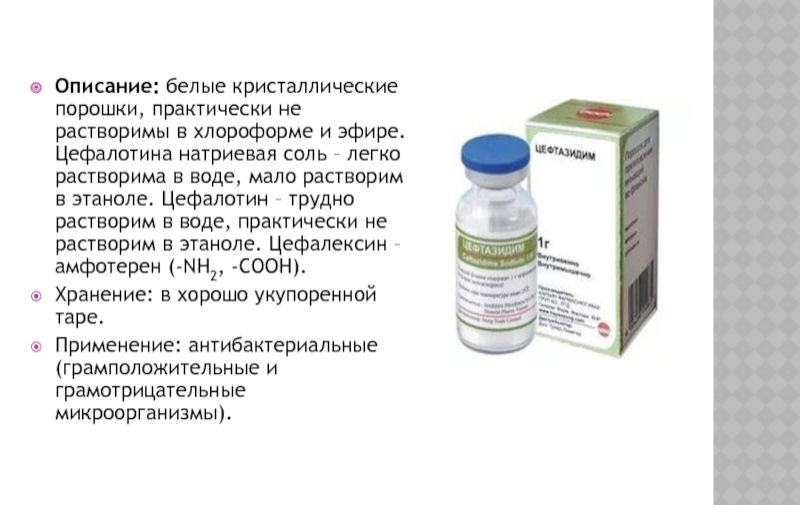
Слайд 27Описание: белые кристаллические порошки, практически не растворимы в хлороформе и эфире.
Хранение: в хорошо укупоренной таре.
Применение: антибактериальные (грамположительные и грамотрицательные микроорганизмы).
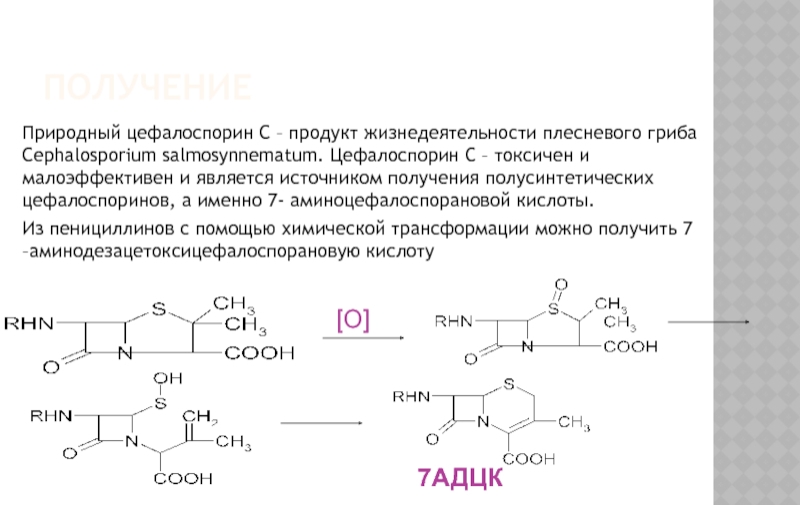
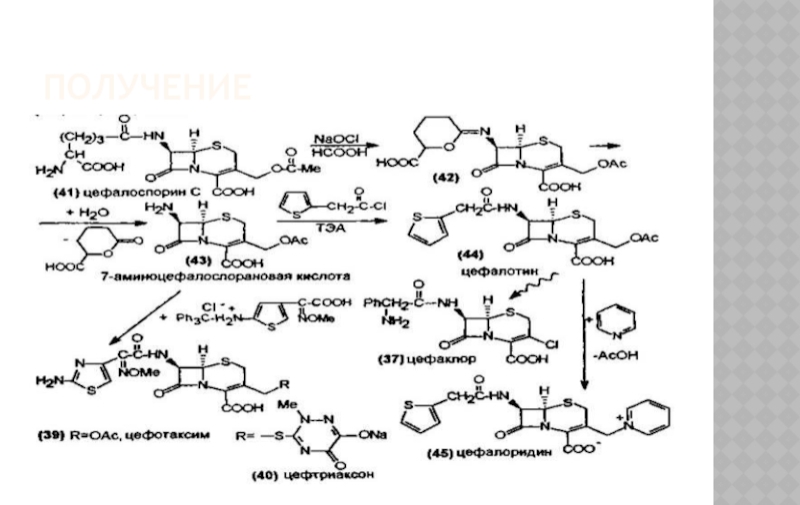
Слайд 28ПОЛУЧЕНИЕ
Природный цефалоспорин С – продукт жизнедеятельности плесневого гриба Cephalosporium salmosynnematum.
Из пенициллинов с помощью химической трансформации можно получить 7 –аминодезацетоксицефалоспорановую кислоту
[O]
7АДЦК
Слайд 29ПОЛУЧЕНИЕ
Антибиотики цефалоспориновой группы син-тезируются на основе цефалоспорина С , получаемого
Слайд 32ЦЕФАЛОСПОРИНЫ
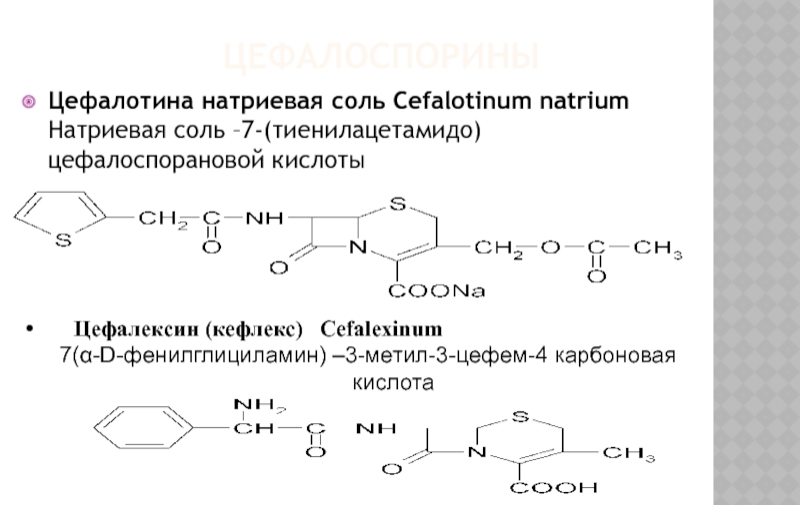
Цефалотина натриевая соль Cefalotinum natrium Натриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты
Цефалексин
7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая кислота
Слайд 331.Цефалексин - на аминокислоту: нингидриновая проба и реакция комплексообразования с ионами
2. Со смесью 80% H2SO4 и 1% HNO3:
цефалексин – желтое окрашивание;
цефалотина натриевая соль – оливково-зеленое окрашивание.
Слайд 34КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
1. Обратная йодометрия
2. Меркуриметрия.
3. Цефалоспорин – неводное титрование:
растворитель – смесь
титрант – диоксановый раствор HClO4;
точка эквивалентности регистрируется потенциометрически.
4. СФМ.
5. ВЭЖХ.