- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы презентация
Содержание
- 1. Щелочные металлы
- 2. Великие законы мирозданья В сущности наивны и
- 3. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был
- 4. Натрий и калий были впервые получены английским
- 5. Й. Берцелиус предложил назвать один новый элемент
- 6. Рубидий был открыт по характерным линиям в
- 7. Цезий был первым элементом, открытым с помощью
- 8. Франций был открыт в 1939г француженкой
- 9. ❄Щелочные металлы находятся в ❄Строение внешнего энергетического
- 10. В РЯДУ ЩЕЛОЧНЫХ МЕТАЛЛОВ Na K Li
- 11. Содержание щелочных металлов в природе
- 12. Соединения щелочных металлов в
- 13. Н а х о ж д
- 14. Минералы натрия и калия NaСl, галит КСl, сильвин
- 15. Б и о л о г и
- 16. Содержание ионов щелочных металлов в
- 17. Na
- 18. К
- 19. Li
- 20. Металлический цезий в ампуле Металлический рубидий в
- 21. Х И М И Ч Е С
- 22. Все щелочные металлы активно реагируют с
- 24. Окраска пламени ионами щелочных металлов Li+ Rb+
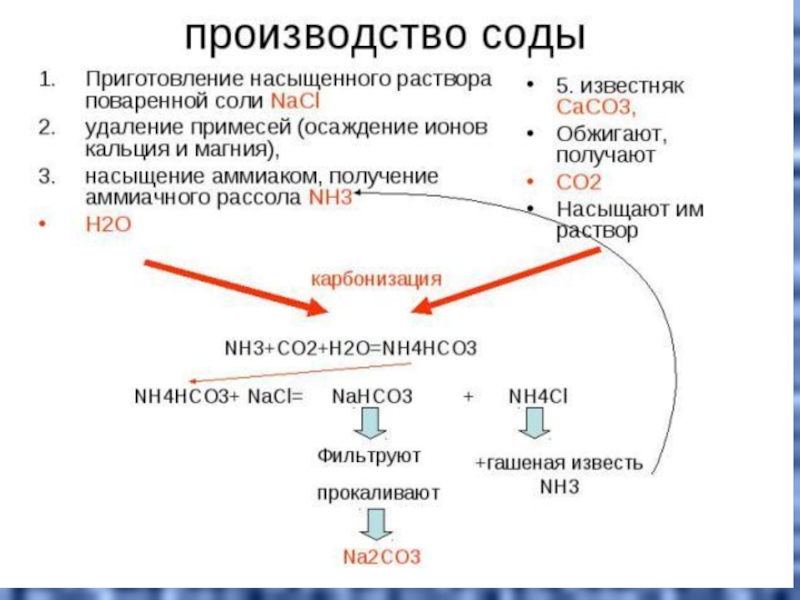
- 29. Сода NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
- 31. Получение щелочных металлов 1) Электролиз расплавов
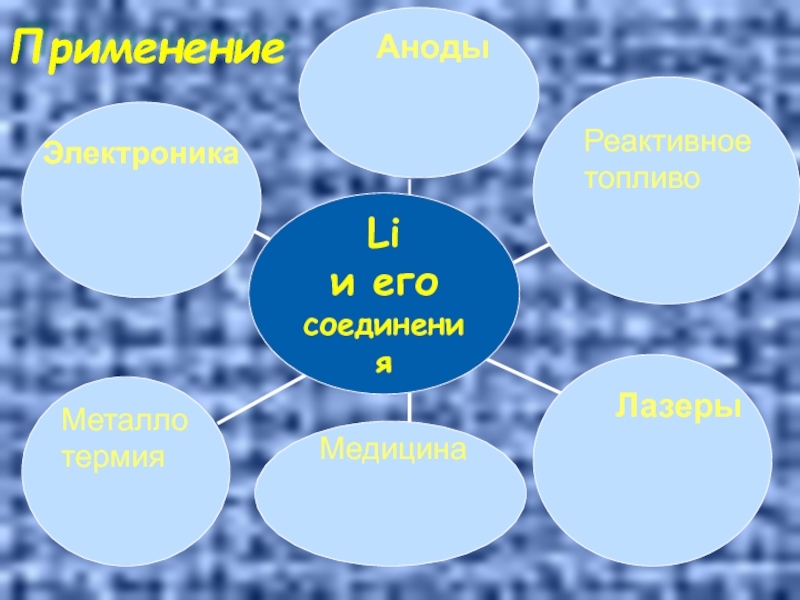
- 32. Применение Аноды Реактивное топливо Лазеры Медицина Электроника Металло термия
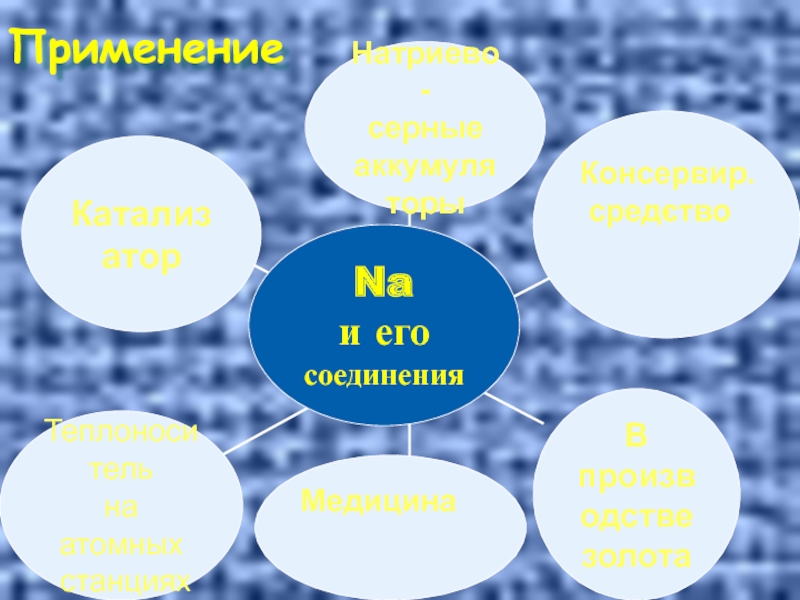
- 33. Применение Консервир. средство Медицина
- 34. Применение Медицина
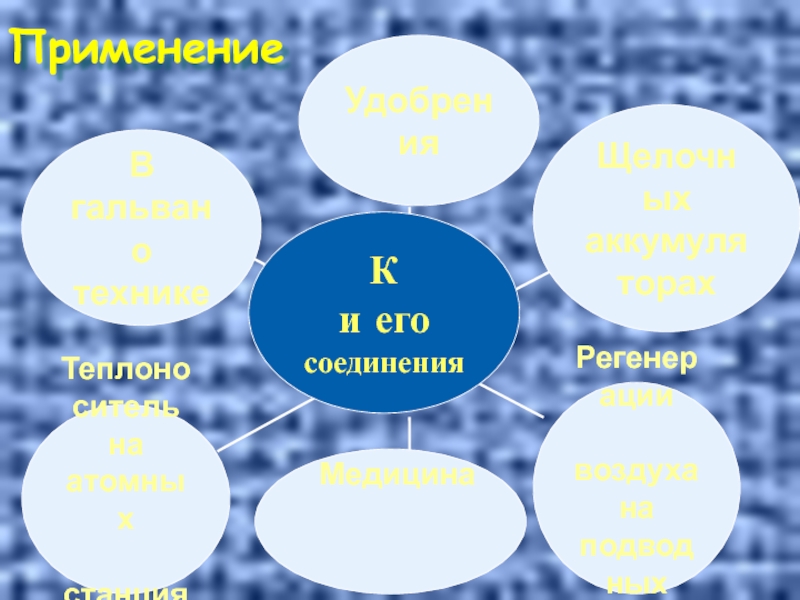
- 35. Применение
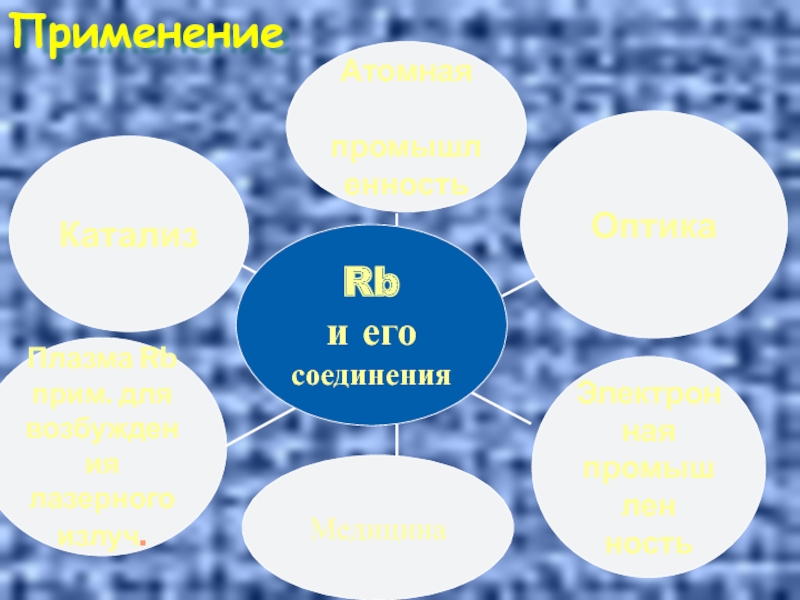
- 36. Применение
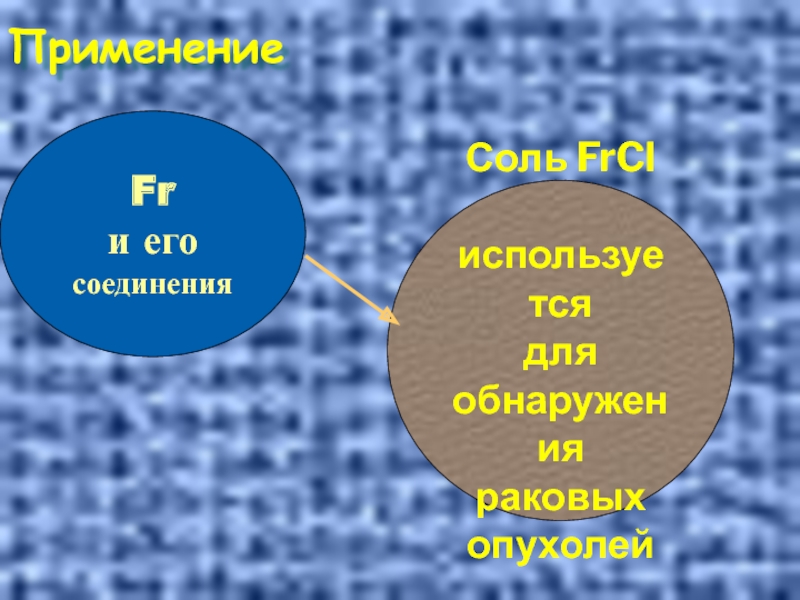
- 37. Применение Fr и его соединения
- 38. Щелочные металлы - серебристо–белые
Слайд 2Великие законы мирозданья
В сущности наивны и просты.
И порой Вам не хватает
Для разгадки этой простоты.
Эпиграф урока
Слайд 3ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Литий был открыт
шведским химиком
Й. Арфведсоном
По предложению Й.Берцелиуса
назван литием (от греч.
литос – камень).
АРФВЕДСОН
Юхан Август
12.01.1792 г. –
28.11 1841 г.
Слайд 4Натрий и калий были впервые получены английским химиком и физиком Г.
Гемфри Дэви
(1778 – 1829)
Слайд 5Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун
Йенс-Якоб Берцелиус (1779–1848)
Слайд 6Рубидий был открыт по характерным линиям в длинноволновой области спектра в
Г. Киргофом. Цвет этих линий определил и название элемента. По латыни «рубидис» - тёмно-красный. В 1863г. Бунзен получил рубидий в чистом виде.
Бунзен (Bunsen)
Роберт Вильгельм
Световой спектр
Слайд 7Цезий был первым элементом, открытым с помощью метода спектрального анализа. В
Густав Роберт Кирхгоф
(1824-1887)
металлический цезий
в ампуле
Слайд 8Франций был открыт в 1939г француженкой
М. Пере. Она доказала, что
Слайд 9❄Щелочные металлы находятся в
❄Строение внешнего энергетического уровня
❄ Максимальная
степень окисления
+1
ns1
IA-группе
ПС
I
❄Валентность
Слайд 10В РЯДУ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Na
K
Li
Fr
r атомов увеличивается
увеличиваются восст. св-ва
уменьшение tпл. и tкип.
уменьшение прочн. хим. связи
энергия ионизации
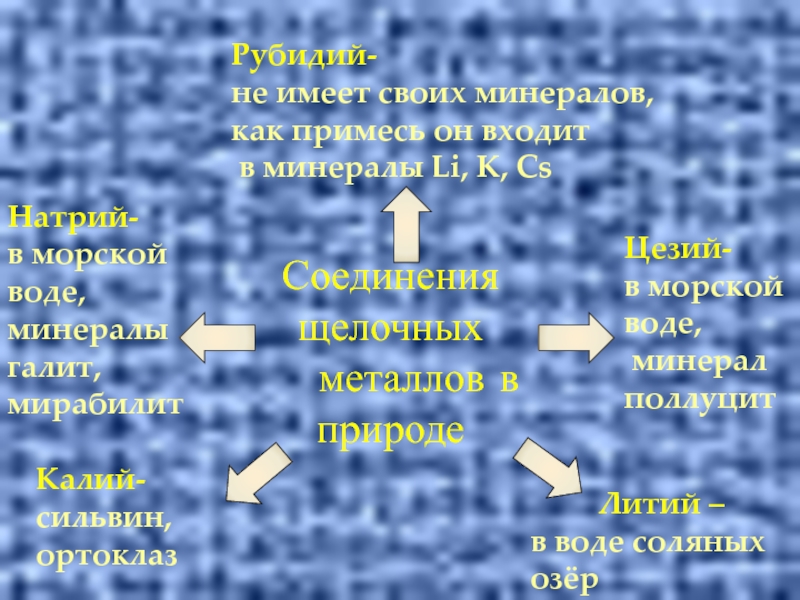
Слайд 12Соединения щелочных
металлов в природе
Литий –
в воде соляных
Натрий-
в морской воде,
минералы галит,
мирабилит
Калий-
сильвин,
ортоклаз
Рубидий-
не имеет своих минералов,
как примесь он входит
в минералы Li, K, Cs
Цезий-
в морской
воде,
минерал
поллуцит
Слайд 13
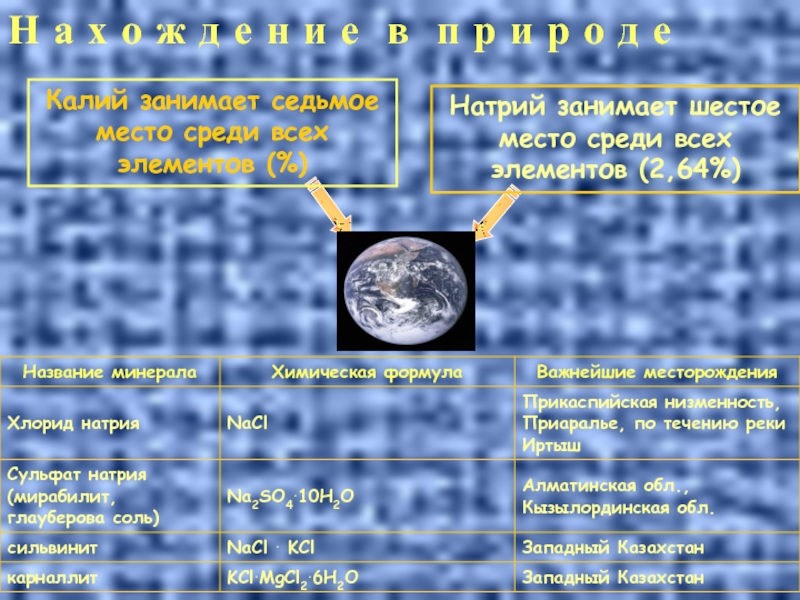
Н а х о ж д е н и е в
Натрий занимает шестое место среди всех элементов (2,64%)
Калий занимает седьмое место среди всех элементов (%)
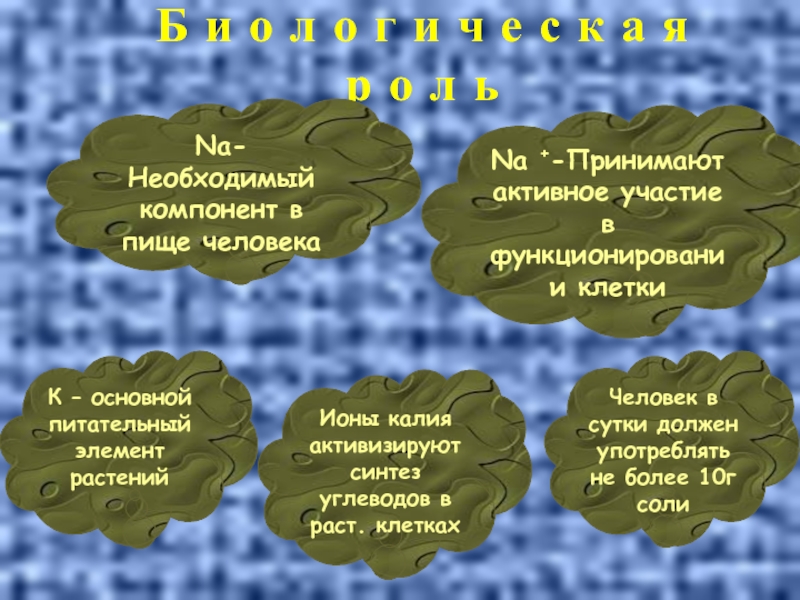
Слайд 15Б и о л о г и ч е с к
К – основной питательный элемент растений
Na-Необходимый компонент в пище человека
Ионы калия активизируют синтез углеводов в раст. клетках
Человек в сутки должен употреблять не более 10г соли
Na +-Принимают активное участие в функционировании клетки
Слайд 16
Содержание ионов щелочных металлов в человеческом организме
Na
K 0,23%
Li 10 %
Rb 10 %
Cs 10 %
-4
-4
-5
макроэлементы
микроэлементы
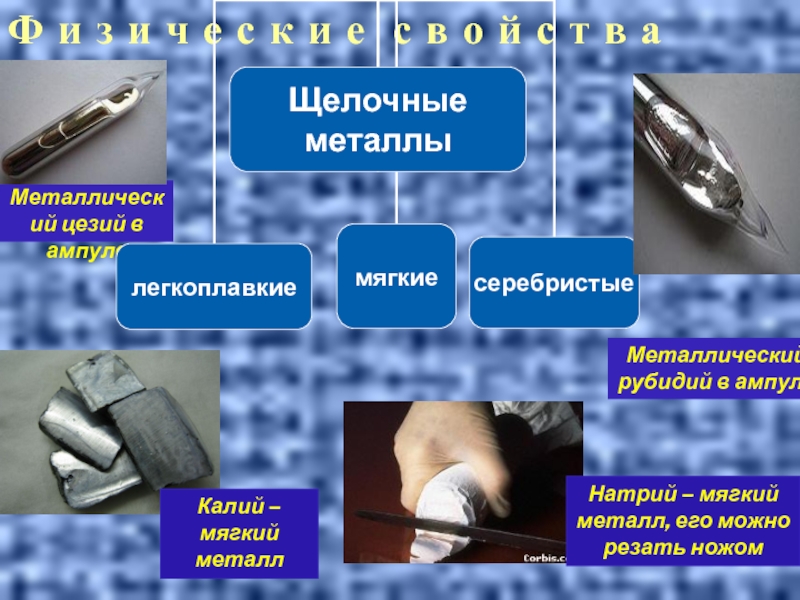
Слайд 20Металлический цезий в ампуле
Металлический рубидий в ампуле
Натрий – мягкий металл, его
Ф и з и ч е с к и е с в о й с т в а
Калий – мягкий металл
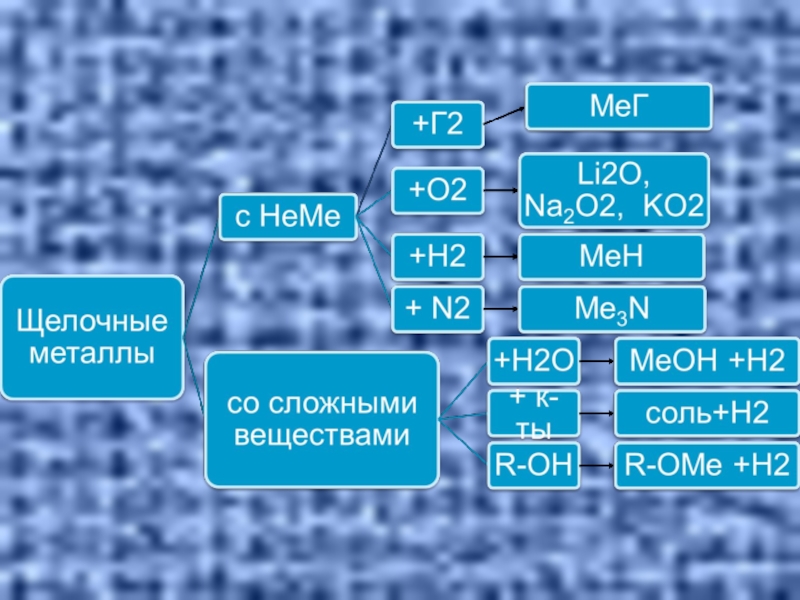
Слайд 21Х И М И Ч Е С К И Е С
Щелочные металлы активно взаимодействуют почти со всеми неметаллами
2М0 + Н20 = 2М+1Н-1 (гидрид)
2М0 + Cl20 = 2M+1Cl-1 (хлорид)
2М0 + S0 = M+12S (сульфид)
С кислородом натрий и калий образуют не оксиды, а пероксиды:
2М0 + О20 = М+12О−12 пероксид
Слайд 22Все щелочные металлы
активно реагируют с водой,
образуя щелочи и
восстанавливая воду
водорода:
2М0 + 2Н2О = 2М+1ОН + Н2↑
Скорость взаимодействия
щелочного металла с водой
увеличивается от лития к
цезию.
Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Слайд 24Окраска пламени ионами щелочных металлов
Li+
Rb+
Na+
Cs+
К+
Li+ - карминово-красный
K+
Cs+ - фиолетово-синий
Na+ - желтый
Rb + - красный
Слайд 25 Химические свойства оксидов Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам:
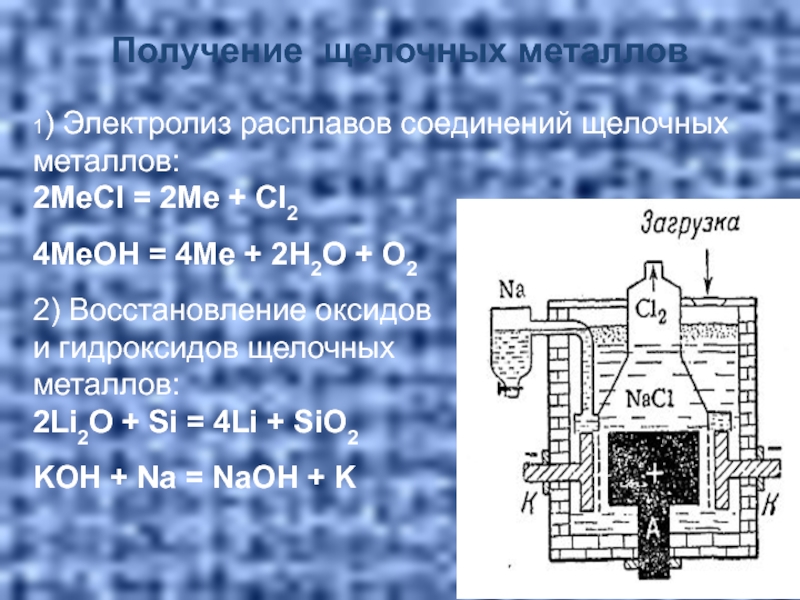
Слайд 31Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме +
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов
и гидроксидов щелочных
металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Слайд 38 Щелочные металлы - серебристо–белые вещества, за исключением цезия