- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сероводородная кислота презентация
Содержание
- 1. Сероводородная кислота
- 2. История: Сероводород (Н2S) -бесцветный газ с запахом
- 3. Физические свойства: Сернистый газ, или диоксид серы
- 4. Химические свойства: Кислота реагирует с : а)
- 5. Получение: Реакция разбавленной соляной кислоты с сульфидом
- 6. Применение: В аналитической химии сероводород и сероводородная
- 7. Спасибо за просмотр!☺
Слайд 2История:
Сероводород (Н2S) -бесцветный газ с запахом тухлых яиц. При — 60
град. С он переходит в жидкое состояние, а при — 86 град. С затвердевает. В 1 л воды при комнатной температуре растворяется около 2,5 л сероводорода. Он очень ядовит. Признаки отравления сероводородом — потеря обоняния, головные боли и тошнота. Противоядие — свежий воздух.
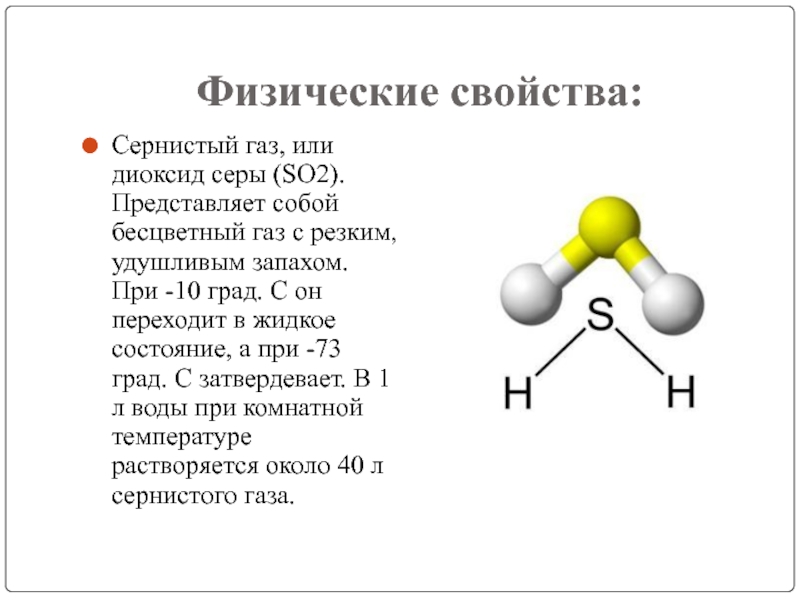
Слайд 3Физические свойства:
Сернистый газ, или диоксид серы (SO2). Представляет собой бесцветный газ
с резким, удушливым запахом. При -10 град. С он переходит в жидкое состояние, а при -73 град. С затвердевает. В 1 л воды при комнатной температуре растворяется около 40 л сернистого газа.
Слайд 4Химические свойства:
Кислота реагирует с :
а) оснόвными оксидами (СаО);
б) основаниями (NaOH);
в)
солями (CuSO4);
г) металлами (Са):
1) H2S + CaO = CaS + H2O;
2) H2S + NaOH = NaHS + H2O; H2S + 2NaOH = Na2S + H2O
3) H2S + CuSO4 = CuS↓ + H2SO4; г) H2S + Cа = CaS + H2
г) металлами (Са):
1) H2S + CaO = CaS + H2O;
2) H2S + NaOH = NaHS + H2O; H2S + 2NaOH = Na2S + H2O
3) H2S + CuSO4 = CuS↓ + H2SO4; г) H2S + Cа = CaS + H2
Слайд 5Получение:
Реакция разбавленной соляной кислоты с сульфидом железа (II)
FeS + 2HCl =
FeCl2 + H2S
Взаимодействие сульфида алюминия с холодной водой
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Прямой синтез из элементов происходит при пропускании водорода над расплавленной серой:
H2 + S = H2S.
Нагревание смеси парафина с серой.
Взаимодействие сульфида алюминия с холодной водой
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Прямой синтез из элементов происходит при пропускании водорода над расплавленной серой:
H2 + S = H2S.
Нагревание смеси парафина с серой.
Слайд 6Применение:
В аналитической химии сероводород и сероводородная вода используются как реагенты для
осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.