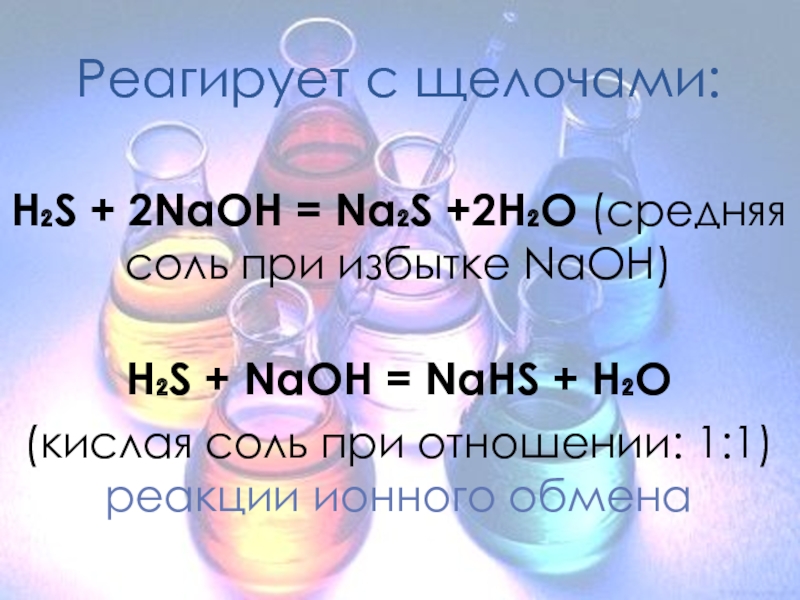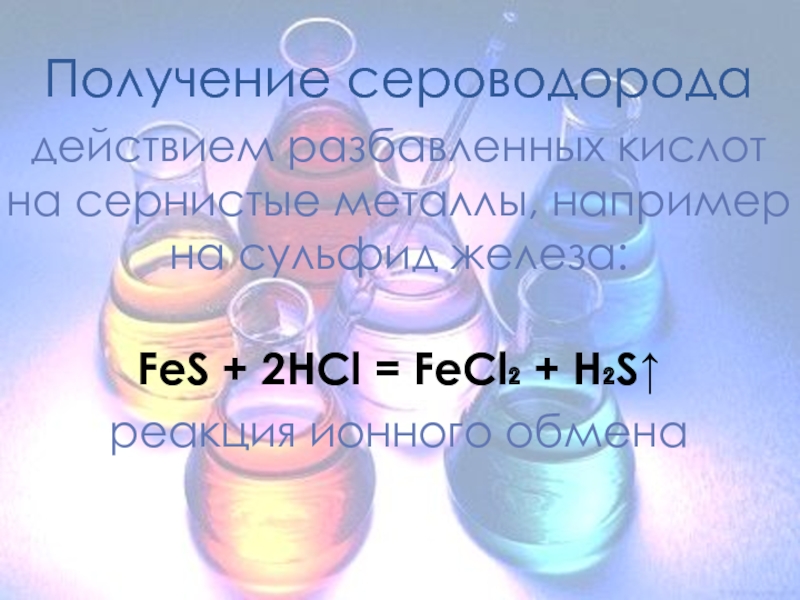водах минеральных источников, например,
в Нижне-Ивкино
Растворен в глубоких слоях (ниже 150 - 200 м) Черного моря
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
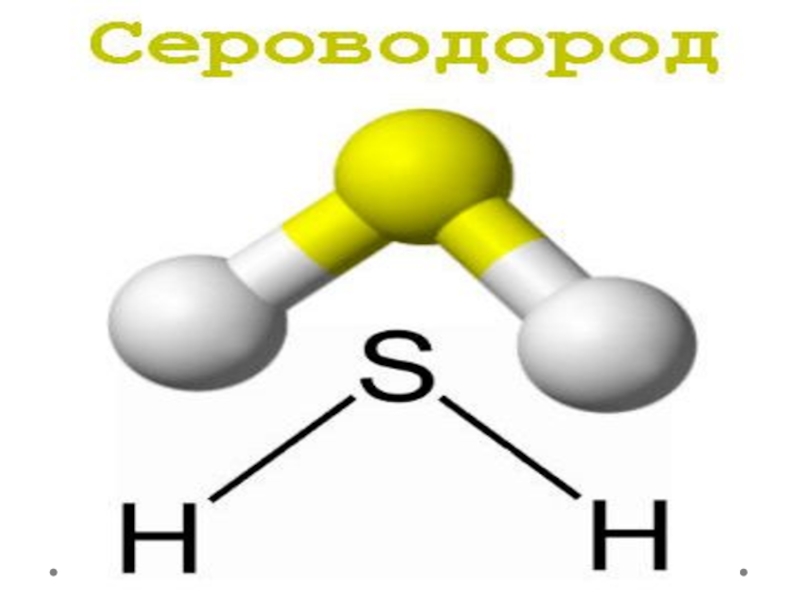
Сероводород. Физические и химические свойства презентация
Содержание
- 2. Нахождение в природе В вулканических газах,
- 3. Физические свойства Бесцветный газ с характерным запахом
- 5. Окисление до свободной серы, оседающей на чашке
- 6. При высокой температуре сера взаимодействует с
- 7. Реагирует с щелочами: H₂S +
- 8. Сероводород реагирует также со многими другими
- 9. Взаимодействие с солями свинца H₂S
- 10. Получение сероводорода действием разбавленных кислот на
- 11. Применение сероводорода H₂S В аналитической химии сероводород
Слайд 3Физические свойства
Бесцветный газ с характерным запахом гниющего белка
В полтора раза тяжелее
воздуха
Снижается при температуре -60,3 ºС
Затвердевает при -80,6 ºС
Легко воспламеняется, смесь с воздухом взрывает
Снижается при температуре -60,3 ºС
Затвердевает при -80,6 ºС
Легко воспламеняется, смесь с воздухом взрывает
Слайд 4
6е
2Н₂S+3O₂=2H₂O+2SО₂ (при избытке кислорода)
S
(-2) ? S (+4) - восстановитель (отдаёт 6 электронов)
O₂ (0) ? O₂ (-2) - окислитель (принимает 4 электрона)
O₂ (0) ? O₂ (-2) - окислитель (принимает 4 электрона)
Химические свойства
Слайд 5Окисление до свободной серы, оседающей на чашке в виде желтого налета:
4е
2Н₂S+O₂=2H₂O+2S (при недостатке кислорода)
S (-2) ? S (0) - восстановитель (отдаёт 2 электрона)
O₂ (0) ? 2O (-2) - окислитель (принимает 4 электрона)
2Н₂S+O₂=2H₂O+2S (при недостатке кислорода)
S (-2) ? S (0) - восстановитель (отдаёт 2 электрона)
O₂ (0) ? 2O (-2) - окислитель (принимает 4 электрона)
Слайд 6
При высокой температуре сера взаимодействует с водородом, образуя газ сероводород:
2е
S+H₂=H₂S↑
S (0)
? S (-2) окислитель(принимает 2 электрона)
Н₂ (0) ? Н₂ (+) - восстановитель (отдаёт 2 электрона)
Н₂ (0) ? Н₂ (+) - восстановитель (отдаёт 2 электрона)
Слайд 7
Реагирует с щелочами:
H₂S + 2NaOH = Na₂S +2H₂O (средняя соль при
избытке NaOH)
H₂S + NaOH = NaHS + H₂O
(кислая соль при отношении: 1:1) реакции ионного обмена
H₂S + NaOH = NaHS + H₂O
(кислая соль при отношении: 1:1) реакции ионного обмена
Слайд 8
Сероводород реагирует также со многими другими окислителями:
3H₂S + 4HClO₃ = 3H₂SO₄
реакция
ионного обмена
2H₂S + SO₂ = 2H₂O +2S
S (-2) ? S (0) - восстановитель (принимает 2 электрона)
S (+4) ? S (0) - окислитель (отдает 4 электрона)
реакция диспропорционирования
2H₂S + SO₂ = 2H₂O +2S
S (-2) ? S (0) - восстановитель (принимает 2 электрона)
S (+4) ? S (0) - окислитель (отдает 4 электрона)
реакция диспропорционирования
Слайд 9
Взаимодействие с солями свинца
H₂S + Pb(NO₃)₂=PbS + 2HNO₃
сульфид свинца
(чёрный осадок)
Качественная реакция на сероводородную кислоту
(чёрный осадок)
Качественная реакция на сероводородную кислоту
Слайд 10
Получение сероводорода
действием разбавленных кислот на сернистые металлы, например на сульфид железа:
FeS
+ 2HCl = FeCl₂ + H₂S↑
реакция ионного обмена
реакция ионного обмена
Слайд 11Применение сероводорода H₂S
В аналитической химии сероводород и сероводородная вода используются как
реагенты для осаждения тяжелых металлов, сульфиды которых очень слаборастворимы.
В медицине: в составе природных и искусственных сероводородных ванн, а также некоторых минеральных вод.
Применяют для получения серной кислоты, элементной серы, сульфидов.
В последние годы рассматривается возможность использования в качестве энергетического и химического сырья.
В медицине: в составе природных и искусственных сероводородных ванн, а также некоторых минеральных вод.
Применяют для получения серной кислоты, элементной серы, сульфидов.
В последние годы рассматривается возможность использования в качестве энергетического и химического сырья.