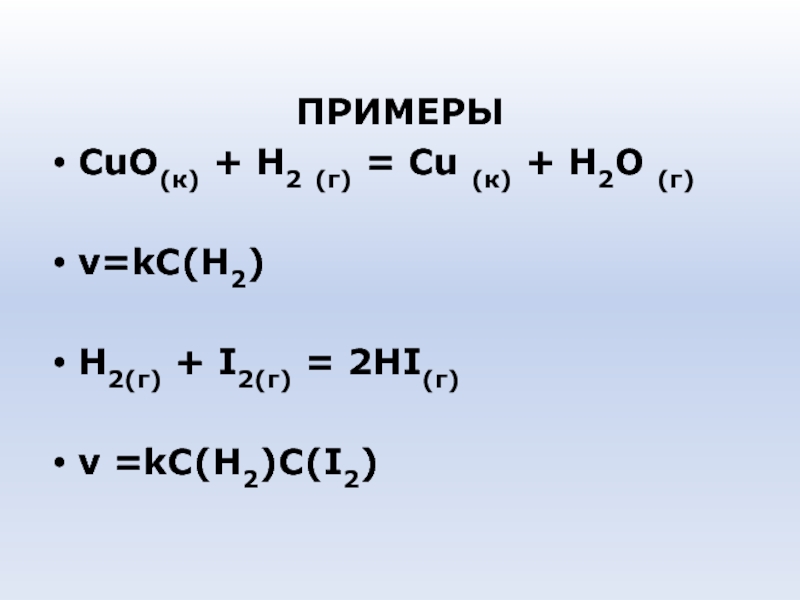- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия. Лекция 1. Термодинамика и кинетика презентация
Содержание
- 1. Химия. Лекция 1. Термодинамика и кинетика
- 2. Литература 1. Попков В.А., Пузаков С.А. Общая
- 3. 3. Литвинова Т.Н. Сборник задач по общей
- 4. Интернет-источники http://www.chemlib.ru http://http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/
- 5. I. Элементы химической термодинамики
- 6. Термодинамика - наука, изучающая
- 7. К настоящему времени термодинамика содержит два основных
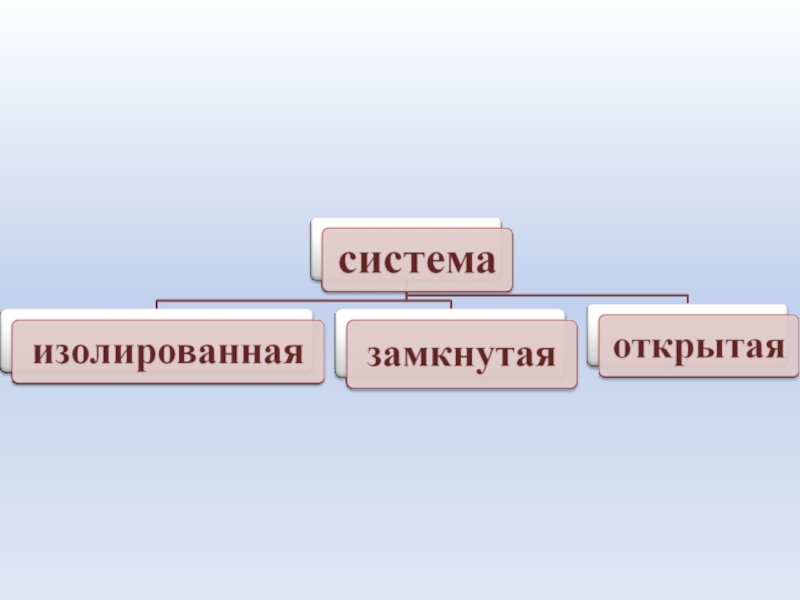
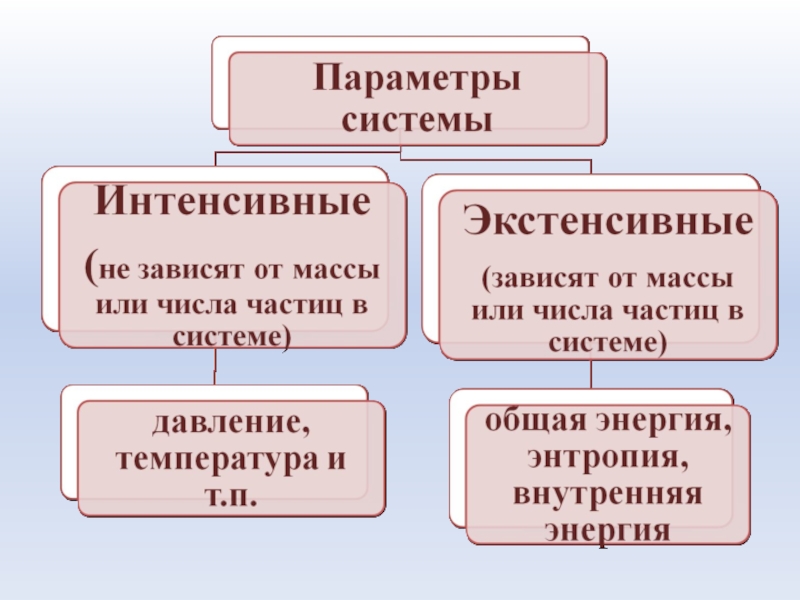
- 8. Система – это совокупность материальных объектов (тел),
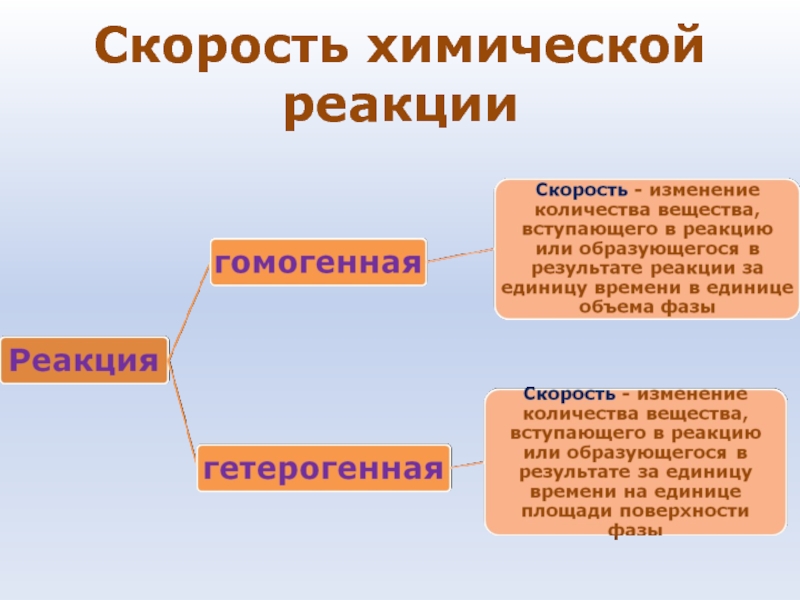
- 9. Термодинамические системы: • Гомогенная – система, в
- 11. Изолированная система – система , которая не
- 12. Открытая система – система, которая обменивается с окружающей средой и энергией, и веществом.
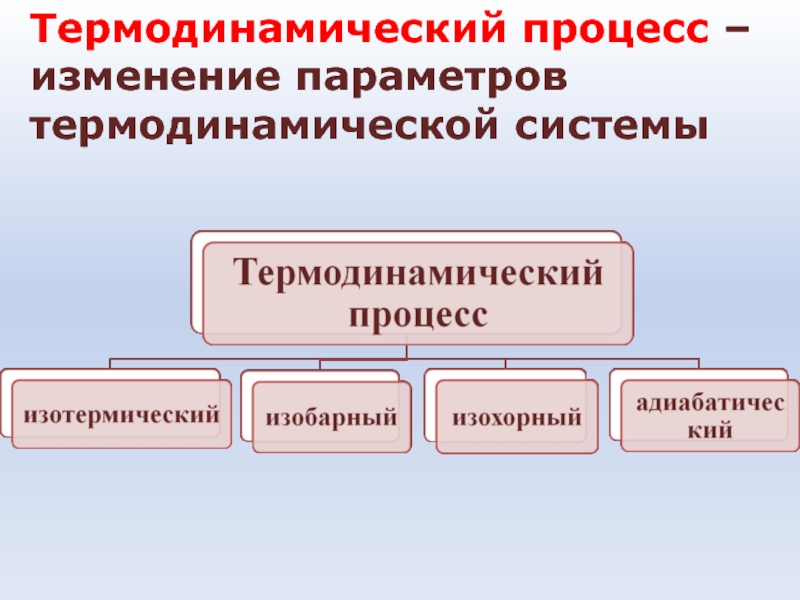
- 14. Термодинамический процесс – изменение параметров термодинамической системы
- 15. Энергия системы (W) - совокупность
- 16. Первое начало термодинамики термодинамическая система (например, пар
- 17. Энтальпия (Н) Qp= ΔU +
- 18. Энтальпия Н - внутреннее теплосодержание системы Для экзотермических реакций Q>0, ΔH
- 19. Количество теплоты, выделяющееся или поглощающееся
- 20. Закон Гесса: Тепловой эффект химических реакций,
- 21. В термодинамике принята следующая запись теплот химических
- 22. Теплотой сгорания вещества называется тепловой эффект реакции
- 23. Первое следствие закона Гесса: Теплота
- 24. Стандартная теплота образования вещества - тепловой эффект
- 25. Второе следствие закона Гесса: Теплота реакции равна
- 26. Пример: аА + bB→сС + dD
- 27. Второе начало термодинамики Постулат Клаузиуса Единственным результатом
- 28. Постулат Томсона Теплота наиболее холодного из участвующих
- 29. Энтропия – функция состояния термодинамической
- 30. Изменение энтропии определяется отношением количества теплоты, сообщенного
- 31. Если энтропия увеличивается (S > 0), то
- 32. Все самопроизвольные процессы в изолированных системах идут
- 33. Изобарно-изотермический потенциал (Свободная энергия Гиббса) ΔG
- 34. Третье начало термодинамики В. Нернст (1906) (тепловой
- 35. II. ХИМИЧЕСКАЯ КИНЕТИКА
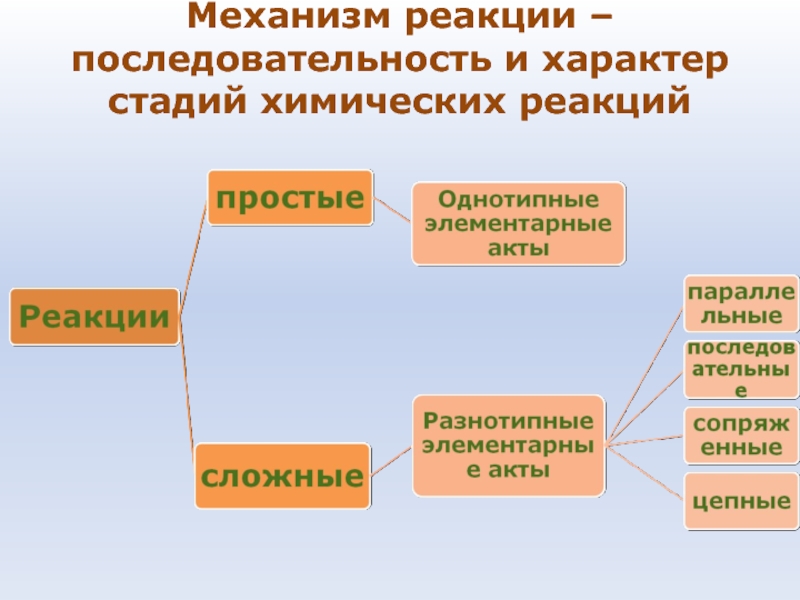
- 36. Химическая кинетика занимается исследованием механизмов реакций и течения их во времени
- 37. Механизм реакции – последовательность и характер стадий химических реакций
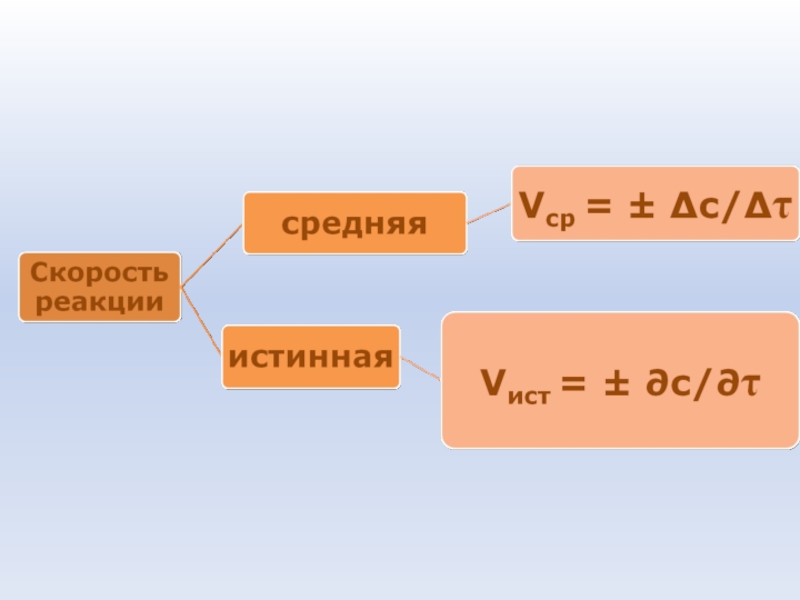
- 38. Скорость химической реакции
- 40. Факторы, влияющие на скорость химической реакции
- 41. Закон действующих масс (К. Гульдберг
- 42. Константа скорости k не зависит от концентраций
- 43. ПРИМЕРЫ СuО(к) + Н2 (г) = Сu
- 44. Молекулярность и порядок реакций Молекулярность реакции
- 45. Реакция первого порядка
- 46. Время, в течение которого прореагировала половина начального
- 47. Зависимость скорости реакции от температуры. Правило
- 48. Температурный коэффициент реакции (γ) -число, показывающее, во
- 49. Уравнение Аррениуса k = A ⋅ e–Ea/RT
- 50. Энергия активации (Еа) - избыточная энергия, которой
- 51. Уравнение Аррениуса позволяет рассчитать константы скорости реакций
- 52. III. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 53. Химическое равновесие — состояние химической системы, в
- 54. Термодинамически химическое равновесие определяется как соотношение концентраций
- 55. Константа химического равновесия mA + nB ↔
- 56. Константа равновесия Кр - частное от деления
- 57. Константа равновесия и энергия Гиббса. Константа
- 58. Смещение химического равновесия. Принцип Ле Шателье:
- 59. Влияние
- 61. Влияние температуры на константу равновесия химической реакции
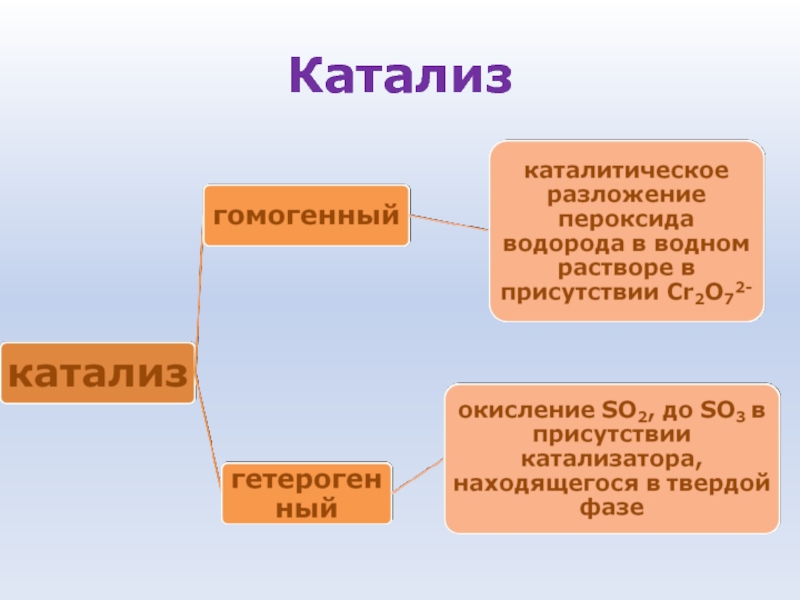
- 62. Катализ Катализ - процесс увеличения скорости реакции
- 63. Особенности катализаторов: • Ускоряют реакцию, присутствуя в очень
- 64. Катализ
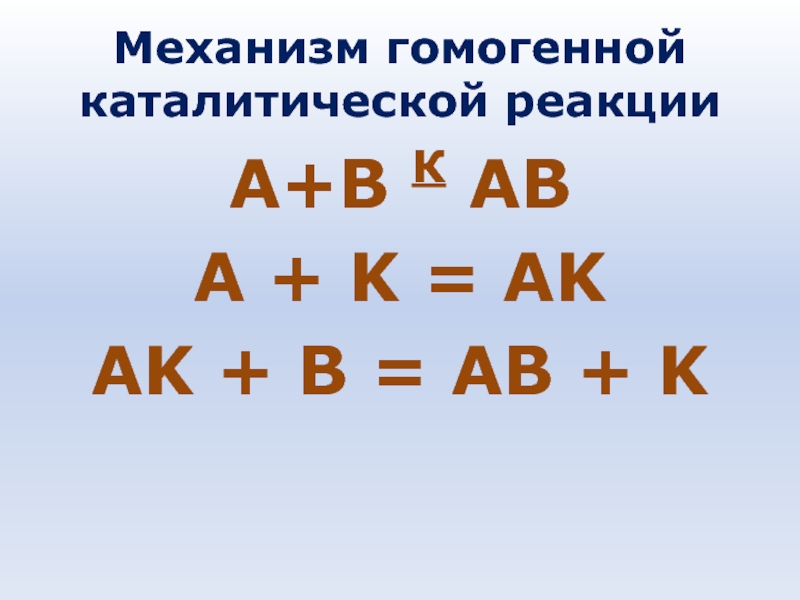
- 65. Механизм гомогенной каталитической реакции А+В К АВ
- 66. Ферменты – биологические катализаторы, ускоряющие биохимические реакции в растениях и животных организмах.
Слайд 2Литература
1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа,
2010. -976 с.
2. Пузаков С.А. Сборник задач и упражнений по общей химии: Учеб. пособие/ С.А. Пузаков, В.А. Попков, А.А. Филиппова.- 2-е изд. испр. и доп. - М.: Высшая школа, 2007. -255 с.
2. Пузаков С.А. Сборник задач и упражнений по общей химии: Учеб. пособие/ С.А. Пузаков, В.А. Попков, А.А. Филиппова.- 2-е изд. испр. и доп. - М.: Высшая школа, 2007. -255 с.
Слайд 33. Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для
студентов мед. вузов. - 3-е изд., перераб./- М.:ООО "Изд-во ОНИКС", 2007. - 244 с.
Слайд 4Интернет-источники
http://www.chemlib.ru
http://http://www.chem.msu.su
http://www.xumuk.ru/
http://www.alhimik.ru/
http://alhimikov.net/
http://chemistry.narod.ru/
http://www.chemport.ru/
Слайд 6
Термодинамика - наука, изучающая общие законы взаимного превращения одной формы
энергии в другую.
Слайд 7 К настоящему времени термодинамика содержит два основных раздела:
1.Равновесная термодинамика (термодинамика изолированных
систем)
2. Неравновесная термодинамика (термодинамика открытых систем)
2. Неравновесная термодинамика (термодинамика открытых систем)
Слайд 8Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от
окружающей среды
Элементы системы - части, обладающие определенными свойствами.
Слайд 9Термодинамические системы:
• Гомогенная – система, в которой каждое ее свойство (параметр)
имеет одно и то же значение во всех точках объема или меняется плавно от точки к точке.
• Гетерогенная –система, которая состоит из нескольких гомогенных систем, отделенных друг от друга поверхностью раздела фаз, на которой свойства меняются скачком.
• Гетерогенная –система, которая состоит из нескольких гомогенных систем, отделенных друг от друга поверхностью раздела фаз, на которой свойства меняются скачком.
Слайд 11Изолированная система – система , которая не обменивается с окружающей средой
ни веществом, ни энергией в форме работы или теплоты.
Закрытая (замкнутая) система – система, которая может обмениваться с окружающей средой лишь энергией и не может обмениваться веществом
Закрытая (замкнутая) система – система, которая может обмениваться с окружающей средой лишь энергией и не может обмениваться веществом
Слайд 12Открытая система – система, которая обменивается с окружающей средой и энергией,
и веществом.
Слайд 15 Энергия системы (W) - совокупность двух частей: зависящей от
движения и положения системы как целого (Wц) и не зависящей от этих факторов (U)
W=Wц+ U
U - внутренняя энергия системы.
W=Wц+ U
U - внутренняя энергия системы.
Слайд 16Первое начало термодинамики
термодинамическая система (например, пар в тепловой машине) может совершать
работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии
Q = ΔU + A
Q = ΔU + A
Слайд 17Энтальпия (Н)
Qp= ΔU + A (1),
где А – работа
по перемещению поршня
Qp= ΔU + p ΔV (2),
где р – давление, ΔV – изменение объёма системы.
Формулу (2) можно переписать в следующем виде:
Qp=(U2 – U1) + p(V2 – V1) (3)
Qp=(U2 + pV2 ) – (U1 + pV1) (4)
В этом выражении параметры в скобках обозначим Н, т.е.
U2 + pV2 = Н2, U1 + pV1=Н1, тогда
Qp= Н2 – Н1 =ΔН.
Qp= ΔU + p ΔV (2),
где р – давление, ΔV – изменение объёма системы.
Формулу (2) можно переписать в следующем виде:
Qp=(U2 – U1) + p(V2 – V1) (3)
Qp=(U2 + pV2 ) – (U1 + pV1) (4)
В этом выражении параметры в скобках обозначим Н, т.е.
U2 + pV2 = Н2, U1 + pV1=Н1, тогда
Qp= Н2 – Н1 =ΔН.
Слайд 18 Энтальпия Н - внутреннее теплосодержание системы
Для экзотермических реакций Q>0, ΔH
реакций Q<0, ΔH>0
Слайд 19 Количество теплоты, выделяющееся или поглощающееся в результате химической реакции, называется тепловым
эффектом химической реакции.
Термохимия – раздел термодинамики, изучающий, теплоты химических реакций.
Слайд 20Закон Гесса:
Тепловой эффект химических реакций, протекающих при постоянном давлении или
при постоянном объёме, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Слайд 21В термодинамике принята следующая запись теплот химических реакций:
С(тв)+О2(г)=СО2(г); ∆НР=-405,8 кДж
в термохимии:
С(тв) + О2(г) = СО2(г) +405,8 кДж
Слайд 22Теплотой сгорания вещества называется тепловой эффект реакции сгорания его
(1 моль) с образованием устойчивых продуктов (для органических веществ это СО2 и Н2О).
Слайд 23 Первое следствие закона Гесса:
Теплота реакции равна сумме теплот сгорания
начальных участников реакции за вычетом суммы теплот сгорания конечных участников реакции с учетом стехиометрических коэффициентов.
где νн, νк - стехиометрические коэффициенты.
Пример для реакции аА + bB→dD
∆Hреакц. = а∆Hсгор(А) + b∆Hсгор(B) - d∆Hсгор(D).
где νн, νк - стехиометрические коэффициенты.
Пример для реакции аА + bB→dD
∆Hреакц. = а∆Hсгор(А) + b∆Hсгор(B) - d∆Hсгор(D).
Слайд 24Стандартная теплота образования вещества - тепловой эффект реакции образования одного моль
вещества из простых веществ в стандартных условиях (ΔН0298)
(Т = 298К и Р = 1 атм)
(Т = 298К и Р = 1 атм)
Слайд 25Второе следствие закона Гесса:
Теплота реакции равна сумме теплот образования конечных веществ
за вычетом суммы теплот образования начальных веществ с учетом стехиометрических коэффициентов.
Или для стандартных условий:
Или для стандартных условий:
Слайд 26Пример:
аА + bB→сС + dD
∆Hреакц. = [с ⋅∆Hобр(С) + d ⋅∆Hобр(D)]
– [а ⋅ ∆Hобр(А) + b ⋅∆Hобр(B)]
Слайд 27Второе начало термодинамики
Постулат Клаузиуса
Единственным результатом любой совокупности процессов не может быть
переход теплоты от менее нагретого тела к более нагретому.
Слайд 28Постулат Томсона
Теплота наиболее холодного из участвующих в процессе тел не может
служить источником работы. (Теплота не может полностью перейти в работу).
Слайд 29 Энтропия – функция состояния термодинамической системы, используемая во втором законе т/д
для выражения через нее возможности или невозможности самопроизвольного протекания процесса
(введена Клаузиусом).
Слайд 30Изменение энтропии определяется отношением количества теплоты, сообщенного системе или отведенного от
нее, к температуре системы:
где знак равенства относится к равновесному процессу, неравенства – к неравновесному.
Т.о. в равновесном процессе:
S = .
где знак равенства относится к равновесному процессу, неравенства – к неравновесному.
Т.о. в равновесном процессе:
S = .
Слайд 31 Если энтропия увеличивается (S > 0), то самопроизвольный неравновесный процесс возможен,
если S < 0 – невозможен.
Слайд 32Все самопроизвольные процессы в изолированных системах идут в сторону увеличения энтропии
до достижения равновесия, где она будет иметь постоянное и максимальное значение.
Слайд 33Изобарно-изотермический потенциал
(Свободная энергия Гиббса)
ΔG = ΔH – T · ΔS
где
ΔH – изменение энтальпии,
Т – абсолютная температура,
ΔS – изменение энтропии.
Если ΔG <0, процесс протекает самопроизвольно ,
если ΔG > 0, то процесс невозможен.
Т – абсолютная температура,
ΔS – изменение энтропии.
Если ΔG <0, процесс протекает самопроизвольно ,
если ΔG > 0, то процесс невозможен.
Слайд 34Третье начало термодинамики
В. Нернст (1906) (тепловой закон Нернста): энтропия S любой
системы стремится к конечному для неё пределу, не зависящему от давления, плотности или фазы, при стремлении температуры (Т) к абсолютному нулю.
Слайд 40Факторы, влияющие на скорость химической реакции
Природа реагирующих веществ
Концентрация реагирующих веществ
Температура
Присутствие катализаторов
Слайд 41
Закон действующих масс
(К. Гульдберг и П. Вааге)
при постоянной
температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ
nА + mВ → gD
v=k CА n ⋅ CВ m
nА + mВ → gD
v=k CА n ⋅ CВ m
Слайд 42Константа скорости k не зависит от концентраций веществ
Закон действующих масс
применим только к газообразным и растворенным веществам
Слайд 44Молекулярность и порядок реакций
Молекулярность реакции - число молекул, участвующих в элементарном
акте химического взаимодействия
Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс
Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс
Слайд 45
Реакция первого порядка
C = C0 ⋅ e–kt или lnC = lnC0
– kt
С – концентрация вещества в данный момент времени,
С0 – исходная концентрация вещества,
k – константа скорости,
t – время протекания реакции.
С – концентрация вещества в данный момент времени,
С0 – исходная концентрация вещества,
k – константа скорости,
t – время протекания реакции.
Слайд 46Время, в течение которого прореагировала половина начального количества вещества, называется временем
полураспада и обозначается τ1/2.
Для реакции первого порядка:
τ1/2=ln 2 / k
Для реакции первого порядка:
τ1/2=ln 2 / k
Слайд 47Зависимость скорости реакции от температуры.
Правило Вант-Гоффа
при повышении температуры на каждые
10° скорость реакции увеличивается примерно в 2—4 раза
v2 = v1 ⋅ γ (ΔТ/10)
k2 = k1 ⋅ γ (ΔТ/10)
v2 = v1 ⋅ γ (ΔТ/10)
k2 = k1 ⋅ γ (ΔТ/10)
Слайд 48Температурный коэффициент реакции (γ) -число, показывающее, во сколько раз увеличивается скорость
данной реакции при повышении температуры на 10°
Слайд 49Уравнение Аррениуса
k = A ⋅ e–Ea/RT
R – универсальная газовая постоянная, 8,314
Дж/моль·К,
Т – температура по шкале Кельвина,
Еа – энергия активации,
А – предэкспоненциальный множитель.
Т – температура по шкале Кельвина,
Еа – энергия активации,
А – предэкспоненциальный множитель.
Слайд 50Энергия активации (Еа) - избыточная энергия, которой должны обладать молекулы для
того, чтобы их столкновение могло привести к образованию нового вещества.
Молекулы, обладающие такой энергией, называются активными молекулами.
Молекулы, обладающие такой энергией, называются активными молекулами.
Слайд 51Уравнение Аррениуса позволяет рассчитать константы скорости реакций при различных температурах:
а так
же при изменении энергии активации
Слайд 53Химическое равновесие — состояние химической системы, в котором обратимо протекает одна
или несколько химических реакций, причём скорости прямой и обратной реакций равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Слайд 54Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов
реакции, при котором энтропия системы имеет максимальное, а изобарно-изотермический потенциал – минимальное значение
Слайд 55Константа химического равновесия
mA + nB ↔ pC + qD
v1= k1
·CАm ·CBn
v2=k2 ·CCp ·CDq
v1=v2
k1 ·CАm ·CBn = k2 ·CCp ·CDq
k1 / k2 = CCp ·CDq/ CАm ·CBn
Kp= CCp ·CDq/ CАm ·CBn
v2=k2 ·CCp ·CDq
v1=v2
k1 ·CАm ·CBn = k2 ·CCp ·CDq
k1 / k2 = CCp ·CDq/ CАm ·CBn
Kp= CCp ·CDq/ CАm ·CBn
Слайд 56Константа равновесия Кр - частное от деления произведения равновесных концентраций продуктов
и исходных веществ реакции (является величиной постоянной)
Слайд 57Константа равновесия и энергия Гиббса.
Константа химического равновесия зависит от природы
реагентов, от температуры и связана с изменением стандартной энергии Гиббса ΔG° химической реакции уравнением
ΔG°= -RT ln Kр
Если ΔG° < 0 в равновесной смеси преобладают продукты взаимодействия.
Если же ΔG° > 0, то в равновесной смеси преобладают исходные вещества.
ΔG°= -RT ln Kр
Если ΔG° < 0 в равновесной смеси преобладают продукты взаимодействия.
Если же ΔG° > 0, то в равновесной смеси преобладают исходные вещества.
Слайд 58Смещение химического равновесия.
Принцип Ле Шателье:
если на систему, находящуюся в
равновесии, воздействовать извне, то в системе усилится то из направлений процесса, которое противодействует данному воздействию.
Слайд 59 Влияние давления
Повышение давления, согласно принципу
Ле-Шателье, должно смещать равновесие в сторону образования меньшего количества моль газообразных продуктов.
Влияние температуры
При повышении температуры химическое равновесие смещается в сторону эндотермической реакции и наоборот.
Влияние температуры
При повышении температуры химическое равновесие смещается в сторону эндотермической реакции и наоборот.
Слайд 60
Влияние концентрации
Если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции. Аналогичный результат может быть достигнут путем удаления из системы продуктов реакции.
Если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции. Аналогичный результат может быть достигнут путем удаления из системы продуктов реакции.
Слайд 61Влияние температуры на константу равновесия химической реакции выражается уравнениями изобары и
изохоры Вант-Гоффа:
где ΔН= QP, ΔU = Qv.
где ΔН= QP, ΔU = Qv.
Слайд 62Катализ
Катализ - процесс увеличения скорости реакции с помощью катализатора
Катализаторы - вещества,
которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству
Слайд 63Особенности катализаторов:
• Ускоряют реакцию, присутствуя в очень малых количествах
• Избирательность действия, то есть
катализатор ускоряет одну реакцию и неэффективен для другой. Особенно это свойство проявляется у биологических катализаторов-ферментов
• Неизменность после реакции и возможность многократного использования
• Катализатор изменяет механизм реакции и направляет ее по такому пути, который характеризуется понижением энергии активации.
• Неизменность после реакции и возможность многократного использования
• Катализатор изменяет механизм реакции и направляет ее по такому пути, который характеризуется понижением энергии активации.
Слайд 66 Ферменты – биологические катализаторы, ускоряющие биохимические реакции в растениях
и животных организмах.






















![Пример: аА + bB→сС + dD∆Hреакц. = [с ⋅∆Hобр(С) + d ⋅∆Hобр(D)] – [а ⋅ ∆Hобр(А)](/img/tmb/4/351163/f03cedb703266066258f272b36ac06f8-800x.jpg)