- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сероводоро́д, сернистый водород (H2S) (физические свойства) презентация
Содержание
- 1. Сероводоро́д, сернистый водород (H2S) (физические свойства)
- 2. Сероводоро́д, сернистый водород (H2S) (физические свойства) Химическая
- 3. Сероводоро́д, сернистый водород (физические свойства) Химическая формула
- 4. Строение молекулы Молекула сероводорода имеет угловую форму,
- 5. Откуда сероводород в Черном море?
- 6. Химические свойства Проявляет все свойства кислот. с
- 7. с солями: CuCl2+ H2S = CuS↓ +
- 8. 2H2S-2 + 3O2 → 2H2O + 2S+4O2↑
- 9. Качественная реакция на сульфид-ион Pb(NO3)2 + Na2S
- 10. Получение В лаборатории обычно получают действием разбавленных
- 11. Применение Сероводород из-за своей токсичности находит ограниченное
- 12. Токсикология Очень токсичен. При высокой концентрации однократное
- 13. "Тогда услышал я (о, диво!), запах
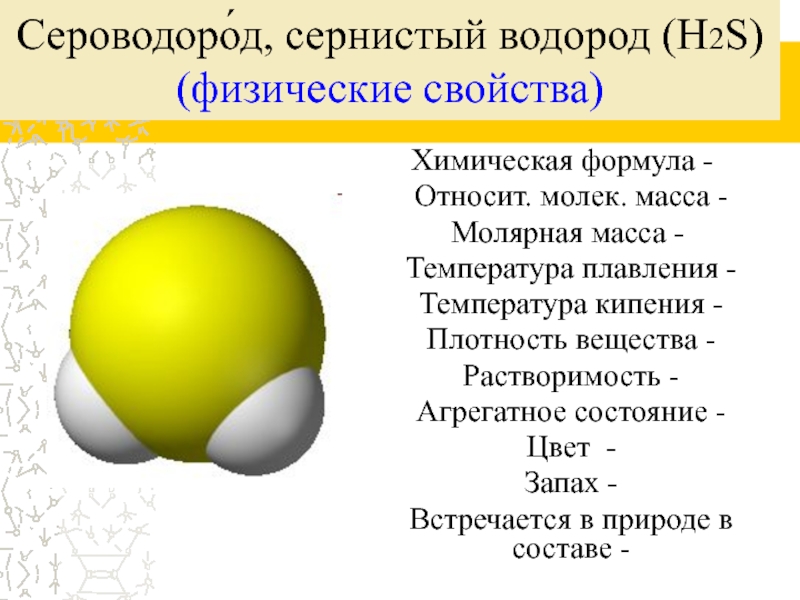
Слайд 2Сероводоро́д, сернистый водород (H2S)
(физические свойства)
Химическая формула -
Относит. молек. масса -
Молярная
масса -
Температура плавления -
Температура кипения -
Плотность вещества -
Растворимость -
Агрегатное состояние -
Цвет -
Запах -
Встречается в природе в составе -
Температура плавления -
Температура кипения -
Плотность вещества -
Растворимость -
Агрегатное состояние -
Цвет -
Запах -
Встречается в природе в составе -
Слайд 3Сероводоро́д, сернистый водород
(физические свойства)
Химическая формула - H2S
Относит. молек. масса - 34
а. е. м.
Молярная масса - 34 г/моль
Температура плавления = -82.30 °C
Температура кипения = -60.28 °C
Плотность вещества = 1.363 г/л
Растворимость = 0.25 г/мл
Агрегатное состояние – газ, тяжёлый
Цвет - бесцветный
Запах – резкий (тухлого мяса)
Ядовит!
Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.
Молярная масса - 34 г/моль
Температура плавления = -82.30 °C
Температура кипения = -60.28 °C
Плотность вещества = 1.363 г/л
Растворимость = 0.25 г/мл
Агрегатное состояние – газ, тяжёлый
Цвет - бесцветный
Запах – резкий (тухлого мяса)
Ядовит!
Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.
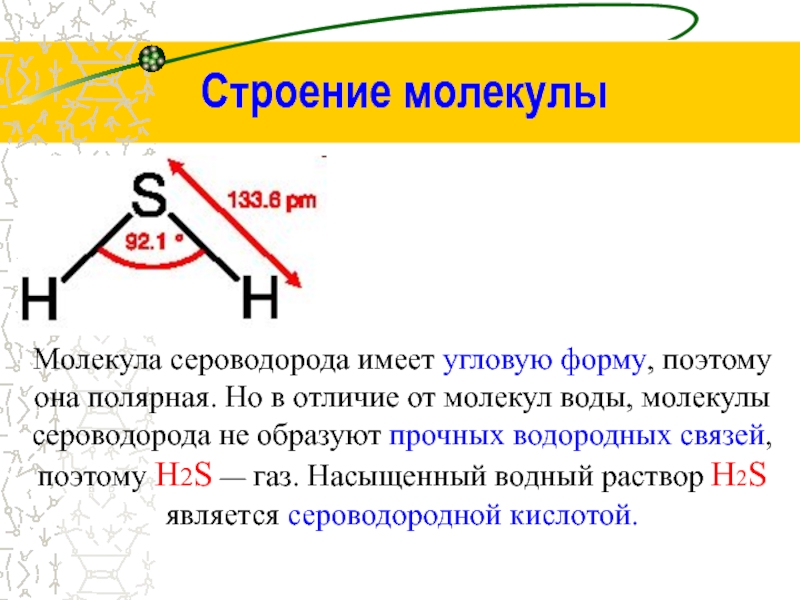
Слайд 4Строение молекулы
Молекула сероводорода имеет угловую форму, поэтому она полярная. Но в
отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водный раствор H2S является сероводородной кислотой.
Слайд 5
Откуда сероводород в Черном море?
CaSO4 + CH4 => CaS + CO2
+ 2H2O
CaS + H2O + CO2 => CaCO3 + H2S
В этих реакциях участвуют сульфатвосстанавливающие бактерии. До верхних слоев воды сероводород не доходит, так как на глубине около 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, помогающие окислить сероводород до серы:
2H2S + O2 => 2H2O + 2S
Но! В последние годы верхняя граница пребывания сероводорода постепенно поднимается. Смертельная граница уже достигла глубина 40 м. Почему?
CaS + H2O + CO2 => CaCO3 + H2S
В этих реакциях участвуют сульфатвосстанавливающие бактерии. До верхних слоев воды сероводород не доходит, так как на глубине около 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, помогающие окислить сероводород до серы:
2H2S + O2 => 2H2O + 2S
Но! В последние годы верхняя граница пребывания сероводорода постепенно поднимается. Смертельная граница уже достигла глубина 40 м. Почему?
Слайд 6Химические свойства
Проявляет все свойства кислот.
с основными оксидами:
H2S + CaO = CaS
+ H2O
с основаниями:
H2S + KOH ↔ KHS + H2O
H2S + OH– ↔ HS– + H2O
H2S + 2KOH ↔ K2S + 2H2O
H2S + 2OH– ↔ S2– + 2H2O
с основаниями:
H2S + KOH ↔ KHS + H2O
H2S + OH– ↔ HS– + H2O
H2S + 2KOH ↔ K2S + 2H2O
H2S + 2OH– ↔ S2– + 2H2O
Слайд 7с солями:
CuCl2+ H2S = CuS↓ + 2HCl
с металлами:
Ca + H2S =
CaS + H2↑
Бромной водой Br2 (восстановительные свойства):
H2S + Br2 = 2HBr + S↓
Бромной водой Br2 (восстановительные свойства):
H2S + Br2 = 2HBr + S↓
желто-
оранжевая
бесцветная
Слайд 82H2S-2 + 3O2 → 2H2O + 2S+4O2↑
S-2 - 6е→ S+4
Восстановитель
O2+4е → 2O -2 Окислитель
2H2S-2 + O2 → 2H2O + 2S0
S-2 - 2е→ S0 Восстановитель
O2+4е → 2O -2 Окислитель
O2+4е → 2O -2 Окислитель
2H2S-2 + O2 → 2H2O + 2S0
S-2 - 2е→ S0 Восстановитель
O2+4е → 2O -2 Окислитель
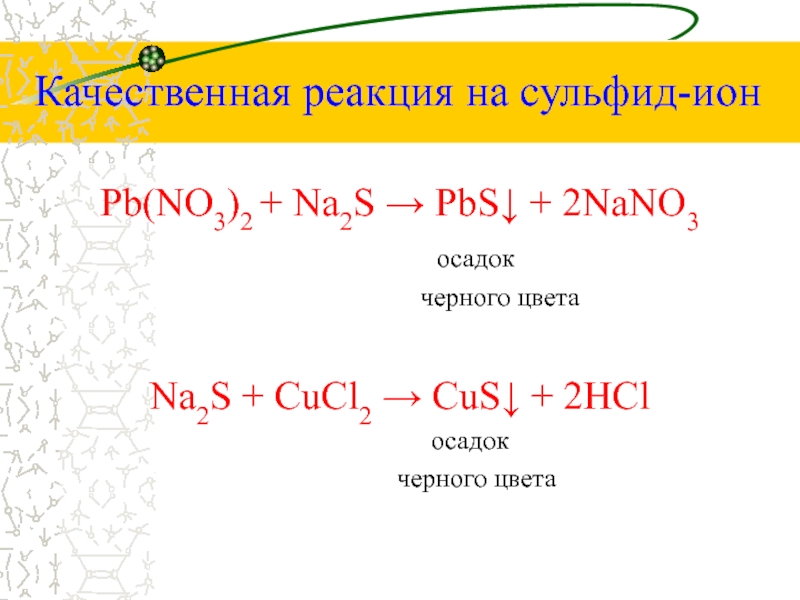
Слайд 9Качественная реакция на сульфид-ион
Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3
осадок
черного цвета
Na2S + CuCl2 → CuS↓ + 2HCl
осадок
черного цвета
черного цвета
Na2S + CuCl2 → CuS↓ + 2HCl
осадок
черного цвета
Слайд 10Получение
В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS + 2HCl
= FeCl2 + H2S↑
Или при добавлении к сульфиду алюминия воды:
Al2S3 + H2O = 2Al(OH)3↓ + H2S↑
А также:
FeS+H2SO4=> FeSO4+H2S↑
H2+S =>H2S
Или при добавлении к сульфиду алюминия воды:
Al2S3 + H2O = 2Al(OH)3↓ + H2S↑
А также:
FeS+H2SO4=> FeSO4+H2S↑
H2+S =>H2S
Слайд 11Применение
Сероводород из-за своей токсичности находит ограниченное применение:
- в аналитической химии сероводород
и сероводородная вода это реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
- медицине — в составе сероводородных ванн.
- для получения серной кислоты, элементной серы, сульфидов.
- используют в органическом синтезе для получения тиофена и меркаптанов.
- в качестве энергетического и химического сырья.
- медицине — в составе сероводородных ванн.
- для получения серной кислоты, элементной серы, сульфидов.
- используют в органическом синтезе для получения тиофена и меркаптанов.
- в качестве энергетического и химического сырья.
Слайд 12Токсикология
Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть.
При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус.
Слайд 13 "Тогда услышал я (о, диво!), запах скверный,
Как будто тухлое разбилося
яйцо,
Или карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо..."
Пушкин А.С.
Или карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо..."
Пушкин А.С.