«Реакции ионного обмена»
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции ионного обмена презентация
Содержание
- 2. Цели презентации: научить школьников составлять ионные
- 3. Методические рекомендации Слайд 6. Определение условий прохождения
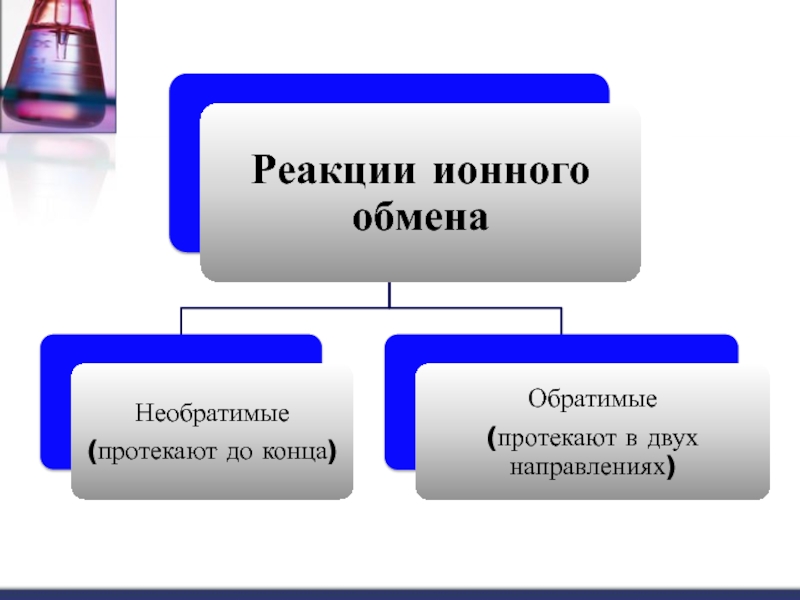
- 4. Реакции ионного обмена
- 6. Идут до конца: CuSO4 +
- 7. Алгоритм составления уравнений Молекулярное уравнение CuSO4+2NaOH
- 8. Не расписываются на ионы: Вода H2O. Слабые
- 9. Выключить поиск Включить поиск Обозначения Баженов А.А.
- 10. Составление уравнений Молекулярное уравнение
- 11. Составление уравнений Молекулярное уравнение
- 12. Не расписываются на ионы: Вода H2O. Слабые
- 13. Обратимые реакции Na2SO4 + KNO3 Na+
- 14. Составление уравнений Молекулярное уравнение Na2SO4+2KNO3
- 15. Укажите ряд, в котором ионы каждой пары
- 16. В каких случаях РИО идут до
- 17. Сокращенное ионное уравнение реакции соответствует взаимодействию: 2H+
- 18. Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3
- 19. Назовите числа правильных ответов 1.Выберите ряд, в
- 20. Применение Ионитами называют вещества или материалы,
- 21. Применение ионитов Для уменьшения жёсткости воды путём
- 22. Применение ионитов В пищевой промышленности: 1.Очистка соков
- 23. Применение ионитов Для извлечения металлов С помощью
- 24. Применение ионитов В медицине: 1.Для увеличения сроков
- 25. Интернет -ресурсы http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.) http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2
- 26. Интернет -ресурсы http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови) http://youreld.clan.su/?page2(пенициллин) http://ogorod01.narod.ru/obschie_podkormka_rasteniy.html (растение) http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин) http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)
- 27. Литература Неорганическая химия(в схемах, рисунках, таблицах, формулах,
Слайд 2Цели презентации:
научить школьников составлять ионные уравнения реакций;
рассмотреть условия протекания реакций ионного
формировать системный подход и способность предсказывать результат реакций на основе полученных знаний;
раскрыть значение реакций ионного обмена.
Презентация может быть использована для дистанционного обучения.
Слайд 3Методические рекомендации
Слайд 6. Определение условий прохождения реакций «до конца» (курсор наводим
Выпадение осадка –записываем уравнение реакции -клик.
Слайд 7. При определении растворимости веществ используем таблицу . После записи реакции в ионном виде возвращаемся на слайд 6.
Выделение газа, образование слабого электролита (действия аналогичны).
В слайдах 15-20 используются триггеры. На слайде 19 проверка ответов – клик на цифры . Правильный ответ , неправильный ответ .
Уравнение
реакции
В презентации используются гиперссылки, триггеры.
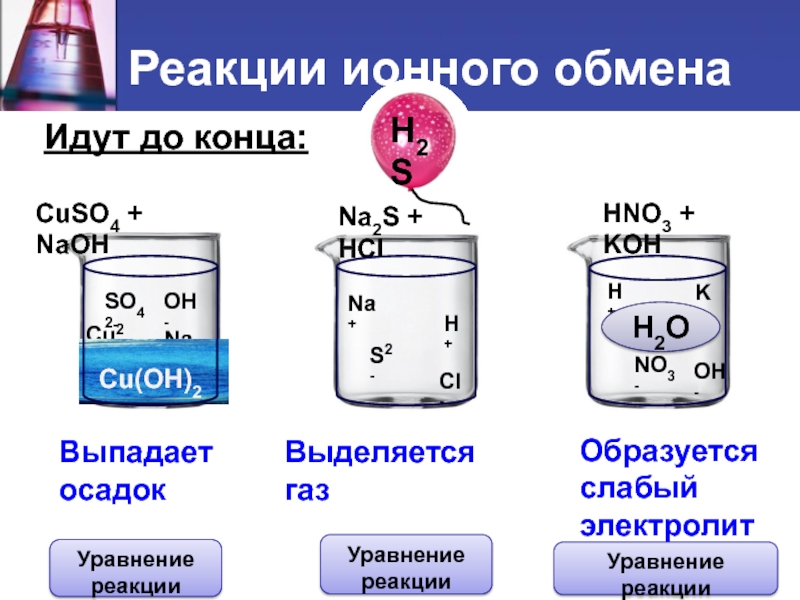
Слайд 6 Идут до конца:
CuSO4 + NaOH
Na2S + HCl
HNO3 +
Cu2+
SO42-
Na+
OH-
Na+
S2-
H+
Cl-
H+
NO3-
K+
OH-
Сu(OH)2
H2S
H2O
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Реакции ионного обмена
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
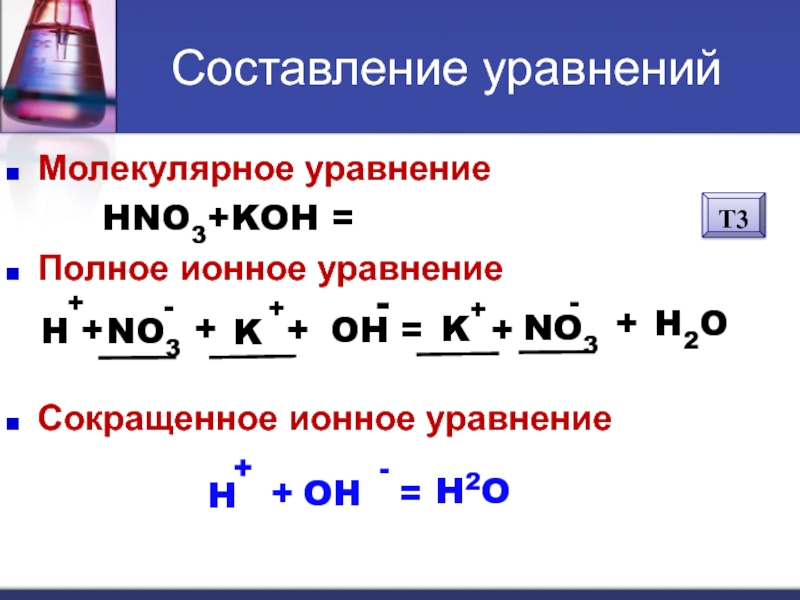
Слайд 7Алгоритм составления уравнений
Молекулярное уравнение
CuSO4+2NaOH = Cu(OH)2 + Na2SO4
Полное ионное уравнение
Сокращенное
Cu
2+
+
SO4
2-
+
2
Na
+
+
2
OH
-
=
Cu(OH)2
+
2
Na
+
+
SO4
2-
Cu
2+
+
2OH
-
=
Cu(OH)2
1.Записать уравнение реакции в
молекулярном виде
2.По таблице растворимости определить
растворимость каждого вещества
3.Составить полное ионное уравнение (записать
диссоциацию растворимых исходных веществ
и продуктов реакции)
4.Найти одинаковые ионы в левой и
правой частях, сократить их и записать
сокращенное ионное уравнение
Т1
Слайд 8Не расписываются на ионы:
Вода H2O.
Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и
Слабые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.).
Амфотерные гидрооксиды (↓): Al(OH)3, Zn(OH)2, Cr(OH)3 и др.
Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и т.д).
Слайд 9Выключить поиск
Включить поиск
Обозначения
Баженов А.А.
Баженов А.А.
_
Р
Р
_
Р
М
Н
Н
Н
_
Н
Н
Н
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
М
Р
Р
Р
Р
Р
Р
Р
Н
Р
М
Н
Н
Н
Н
Н
Н
_
_
Р
Р
Р
Р
Н
М
М
М
М
?
Н
Н
М
?
?
Р
Р
Р
Р
М
Н
М
Р
Р
Р
_
Н
Р
Р
Р
Р
Р
Р
Р
Н
Н
Н
Н
Н
Н
?
Н
Н
?
?
Н
?
Р
Р
?
Н
Н
Н
Н
?
?
Н
Н
?
?
Р
_
Р
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
_
_
Баженов А.А.
Таблица растворимости
.
OH-
Ионы
NO3-
Cl-
S2-
SO32-
SO42-
CO32-
SiO32-
PO43-
CH3COO-
H+
NH4+
K+
Na+
Ag+
Ba2+
Ca2+
Mg2+
Zn2+
Cu2+
Hg2+
Pb2+
Fe2+
Fe3+
Al3+
OH-
H+
Ионы
Баженов А.А.
NO3-
Cl-
S2-
SO32-
SO42-
CO32-
SiO32-
PO43-
CH3COO-
NH4+
K+
Na+
Ag+
Ba2+
Ca2+
Mg2+
Zn2+
Cu2+
Hg2+
Pb2+
Fe2+
Fe3+
Al3+
Т
1
2
3
4
Слайд 10Составление уравнений
Молекулярное уравнение
Na2S+2HCl = H2S +
Полное ионное уравнение
Сокращенное ионное уравнение
Na
+
+
S
2-
+
2
H
+
+
2
Cl
-
=
H2S
+
2
Na
+
+
Cl
-
S
2-
+
2H
+
=
H2S
2
2
Т2
Слайд 11Составление уравнений
Молекулярное уравнение
HNO3+KOH = KNO3 + H2O
Полное
Сокращенное ионное уравнение
H
+
+
NO3
-
+
K
+
+
OH
-
=
H2O
+
K
+
+
NO3
-
H
+
+
OH
-
=
H2O
Т3
Слайд 12Не расписываются на ионы:
Вода H2O.
Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и
Слабые и нерастворимые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.).
Амфотерные гидрооксиды (↓): (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.).
Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и др.).
Слайд 13Обратимые реакции
Na2SO4 + KNO3
Na+
SO42-
K+
NO3-
1.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Слайд 14Составление уравнений
Молекулярное уравнение
Na2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
2Na
+
+
SO4
2-
+
2
K
+
+
2
NO3
-
+
2
K
+
+
SO4
2-
2
NO3
-
Na
+
+
2
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
Т4
Слайд 15Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с
1.SO42-и H+ ; Ag+ и Cl-
2.Cl- и Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
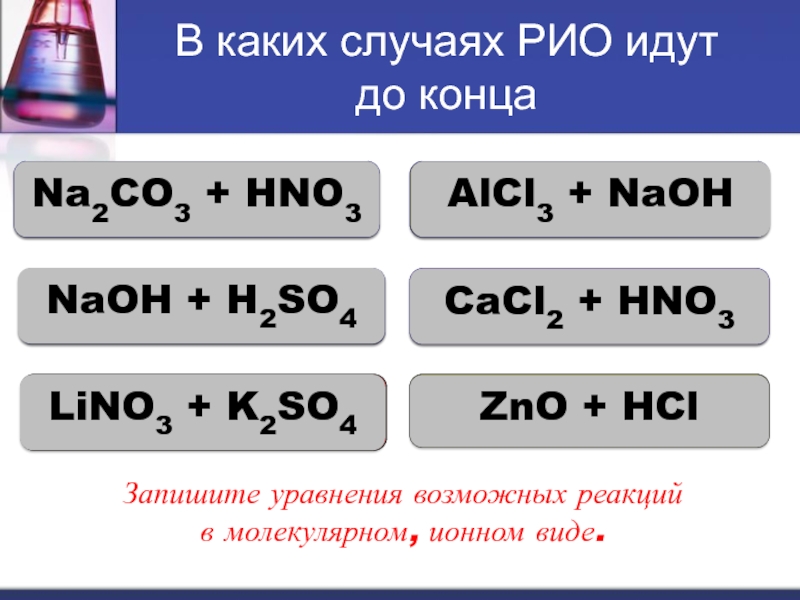
Слайд 16В каких случаях РИО идут
до конца
Молодец
Молодец
Молодец
Ошибка
Ошибка
Молодец
Na2CO3 + HNO3
AlCl3 + NaOH
NaOH
CaCl2 + HNO3
LiNO3 + K2SO4
ZnO + HCl
Запишите уравнения возможных реакций
в молекулярном, ионном виде.
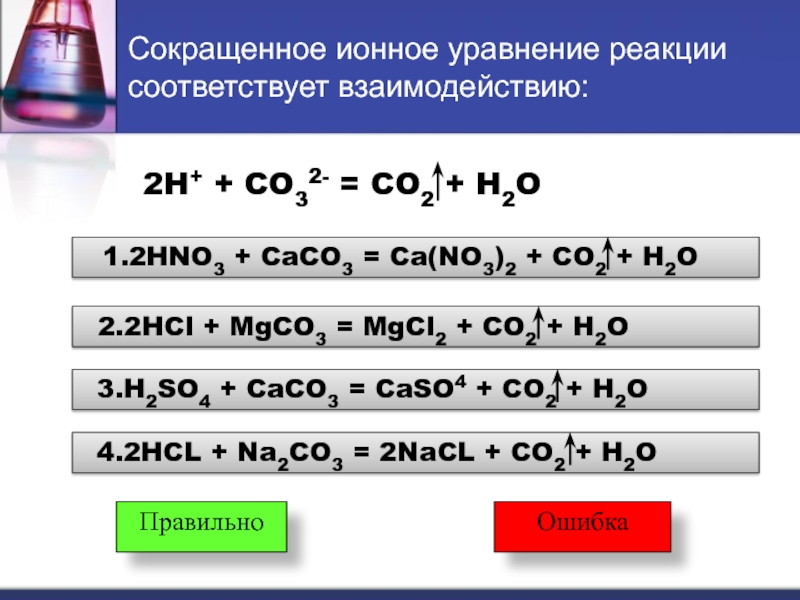
Слайд 17Сокращенное ионное уравнение реакции соответствует взаимодействию:
2H+ + CO32- = CO2 +
1.2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O
2.2HCl + MgCO3 = MgCl2 + CO2 + H2O
3.H2SO4 + CaCO3 = CaSO4 + CO2 + H2O
4.2HCL + Na2CO3 = 2NaCL + CO2 + H2O
Правильно
Ошибка
Слайд 18Сокращенное ионное уравнение реакции соответствует взаимодействию:
Al2O3 + 6H+ = 2Al3+ +
1.Al2O3 + 3CO2 = Al2(CO3)3
2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3
3.Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O
4.AlCL3 + H2O = AlOHCl2+ + HCl
Правильно
Ошибка
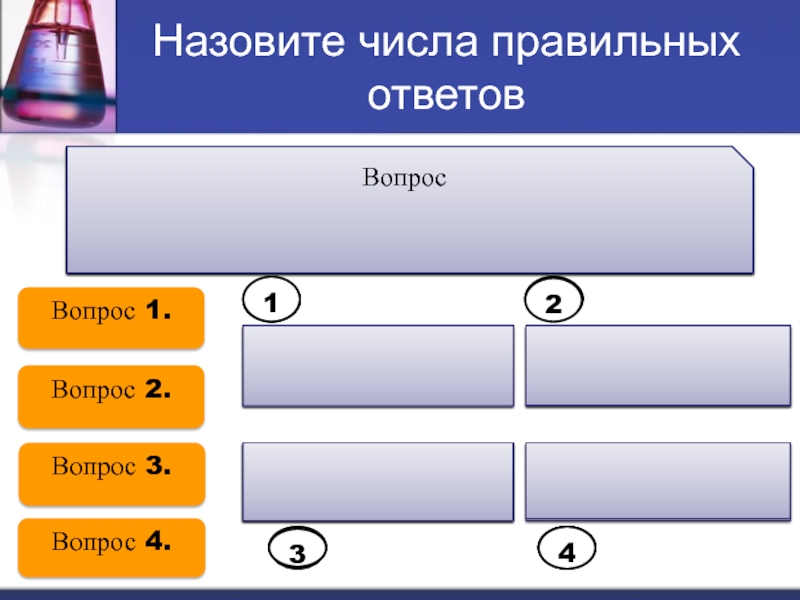
Слайд 19Назовите числа правильных ответов
1.Выберите ряд, в котором каждое вещество
не записывается
составлении ионных уравнений.
Вопрос 1.
Вопрос 2.
Вопрос 3.
Вопрос 4.
H2S, Na2S, CuSO4
CO2, H2SiO3,
H2SO3
KCl, Ca(HCO3)2, HI
H2CO3, K2CO3,
Cu(OH)2
1
2
3
4
Сокращенное ионное уравнение
H+ + OH- = H2O
соответствует реакции:
H2SO4+Zn(OH)2
HCl + Al(OH)3
HNO3 + NaOH
H2CO3 + KOH
1
2
3
4
Выберите пары веществ, которые в водном
растворе взаимодействуют с
образованием газа.
Na2SO3 и HNO3
KHCO3 и HCl
NaHS и NaOH
NaHS и H2SO4
1
2
3
4
Суммы всех коэффициентов в полном и
сокращенном ионных уравнениях реакции
Fe(OH)3 + H2SO4= равны соответственно:
28 и 3
22 и 16
28 и 18
14 и 10
1
2
3
4
Вопрос
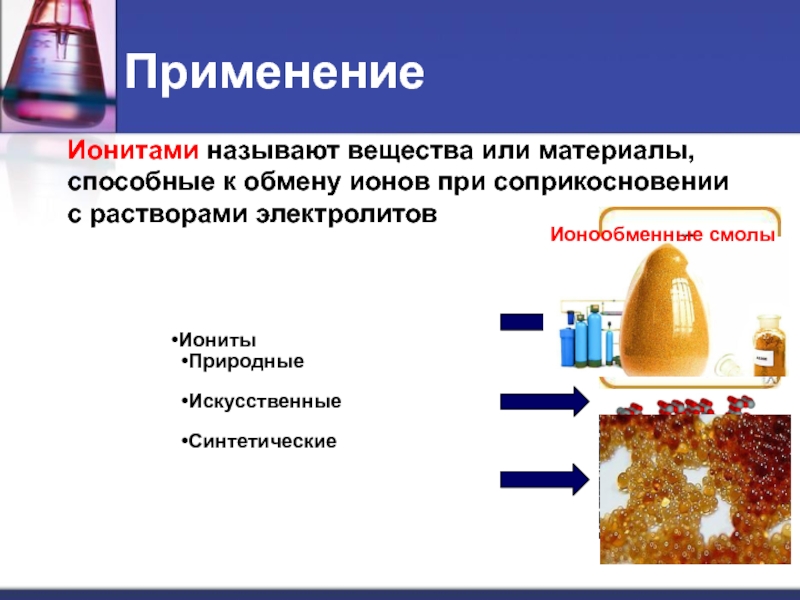
Слайд 20Применение
Ионитами называют вещества или материалы,
способные к обмену ионов при соприкосновении
с растворами электролитов
Иониты
Природные
Искусственные
Синтетические
Цеолит
Ионообменные смолы
Слайд 21Применение ионитов
Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция
Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
Слайд 22Применение ионитов
В пищевой промышленности:
1.Очистка соков в производстве сахара.
2.В производстве дрожжей, фруктовых
глицерина, глюкозы, сгущенного молока, какао,
кофе со сгущенным молоком.
Слайд 23Применение ионитов
Для извлечения металлов
С помощью ионитов извлекаются
редкие и рассеянные элементы
полиметаллических руд.
В сельском хозяйстве иониты
используются для доставки
растениям необходимых им
элементов.
Mo
W
Слайд 24Применение ионитов
В медицине:
1.Для увеличения сроков хранения крови.
2.Для производства, выделения и очистки
3.Использование ионитов, селективно извлекающих
токсические вещества из крови человека.
Слайд 25Интернет -ресурсы
http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.)
http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан)
http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик)
http://do.gendocs.ru/docs/index-265718.html (лестница успеха)
http://ru.123rf.com/photo_8623287_3d-human-ladder-wall-success-business-up-red.html (человечек с
http://krasnoyarsk.pulscen.ru/products/sulfougol_11329010 Сульфоуголь
http://promtek-k.ru/index/sulfougol/0-170 (сульфоуголь)
http://novostey.com/other/news384529.html (Сахар)
http://www.artfile.ru/b.php?i=719068(фруктовые соки)
http://жарптица24.рф/product/bakaleya/konservatsiya_molochnaya/moloko_sguschennoe_tselnoe_glavprodukt_8_5__380gr(сгущеное (молоко)
https://ru.wikipedia.org/wiki/Иониты (Зёрна ионита)
http://www.voda-eko.ru/ionoobmennaya-smola-dlya-filtrov.html(Ионообменная смола)
http://www.aqua-therm.ru/articles/articles_217.html(Иониты)
http://kiev.all.biz/napolniteli-dlya-tualeta-domashnih-zhivotnyh-bgc4142(цеолит)
http://biobeauty.by/sostav-i-deysavie-masok-biobeauty.html (строение цеолита)
http://visfox-oster.blogspot.ru/2012/04/blog-post_12.html (иониты)
Слайд 26Интернет -ресурсы
http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови)
http://youreld.clan.su/?page2(пенициллин)
http://ogorod01.narod.ru/obschie_podkormka_rasteniy.html (растение)
http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин)
http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)
Слайд 27Литература
Неорганическая химия(в схемах, рисунках, таблицах, формулах, химических реакциях), А.П. Гаршин, «Лань»
Книга для чтения по неорганической химии. В. А. Крицман, Москва «Просвещение»1994г.
Химия 8 класс. О.С. Габриелян, Москва «ДРОФА» 2014г.