- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции горения и материальный баланс котла презентация
Содержание
- 1. Реакции горения и материальный баланс котла
- 2. Теоретическими продуктами полного сгорания топлива являются CO2,SO2,H2O
- 3. Балансы элементарных реакций позволяют рассчитать массовые расходы
- 4. Массовый баланс реакции полного горения углерода C+O2=CO2
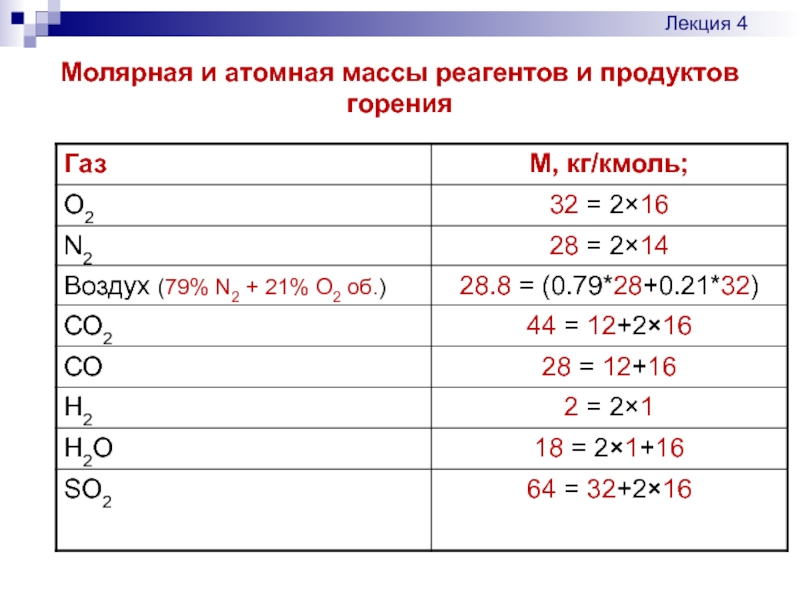
- 5. Молярная и атомная массы реагентов и продуктов горения Лекция 4
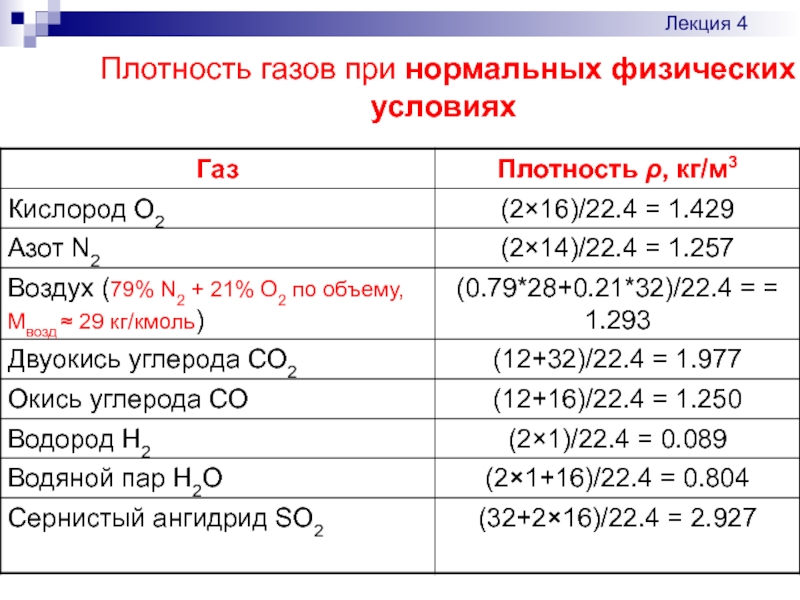
- 6. Плотность газов при нормальных физических условиях Лекция 4
- 7. Лекция 3 1 кг С + 2.66
- 8. Лекция 4 Теоретический объем (расход) воздуха
- 9. Лекция 3 Теоретический объем воздуха (0,21О2+0.79N2), м3/кг
- 10. Лекция 3 Теоретический объем воздуха для полного сгорания сухого газообразного топлива, м3/м3
- 11. Условно принимается, что азот в составе как
- 12. Лекция 3 Теоретическое количество водяного пара
- 13. 0.0161 – объём водяного пара
- 14. Лекция 3 складывается из объемов
- 15. Скорость горения в топочной камере определяется концентрациями
- 16. Коэффициент избытка воздуха на входе в
- 17. Для пылеугольных топок α т = 1.2-1.25,
- 18. Лекция 3
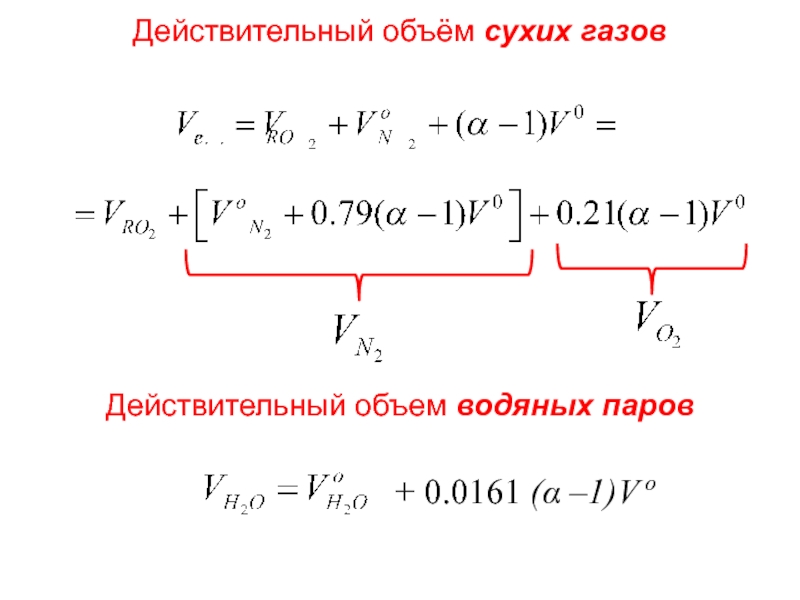
- 19. Действительный объем водяных паров Лекция 3 Действительный объём сухих газов
- 20. Лекция 3 Масса продуктов сгорания Gг (кг/кг)
- 21. Для горючих сланцев объём трёхатомных газов
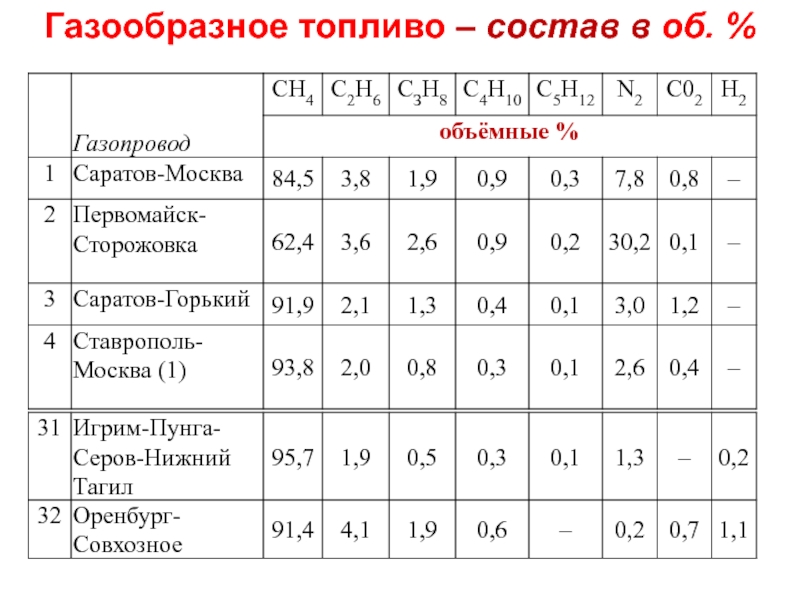
- 22. Газообразное топливо – состав в об. %
- 23. Объём трёхатомных газов: Объем сухих
- 24. Лекция 3 Теоретический объём водяных паров в
- 25. Часто в топочных камерах с помощью дымососа
- 26. В балансовых испытаниях котла коэффициент избытка воздуха
- 27. При сжигании чистого углерода в
- 28. Лекция 4 При сжигании
- 30. Лекция 3 По-существу, это уравнение представляет собой
- 31. Лекция 3 После подстановки значений концентраций О2
- 32. Физический смысл: при полном сгорании топлива объем
- 33. Лекция 3
- 34. Лекция 4 Коэффициент Бунте для газообразных топлив
- 35. Лекция 3 где вместо измеренной концентрации
- 36. Лекция 3 Отсюда Концентрация азота в
- 37. Так как концентрация свободного кислорода в продуктах
- 38. Тesto 325 М/XL Измеряет
- 39. Тesto 330-1/2 Измеряет концентрацию в дымовых
- 40. Тesto 300 М/XL Измеряет концентрацию в
- 41. Базовая версия: - управляющий модуль,
Слайд 2 Теоретическими продуктами полного сгорания топлива являются CO2,SO2,H2O и азот воздуха N2
Пользуясь уравнениями реакций окисления горючей массы топлива и её составом, можно подсчитать
теоретическое количество воздуха, – необходимое для полного сгорания топлива,
и объемы продуктов сгорания.
Лекция 4
Слайд 3 Балансы элементарных реакций позволяют рассчитать массовые расходы кислорода и продуктов реакции,
Деление массы газообразных реагентов на их плотность дает их объемы в нормальных (н)м3 при нормальных условиях (н.у.) : 273 К (0 оС) и 0.98⋅105 Па (760 мм рт. ст. = 1 атм)
Лекция 4
Слайд 4Массовый баланс реакции полного горения углерода
C+O2=CO2
12 кг С + 32 кг
С +(32/12)О2= (44/12)СО2
С+2.67 О2 =3.67 СО2 кг/(кг С)
Объём газовых реагентов
С+ (2.67/1,429)О2 =(3.67/1,977) СО2
С+1,866 О2 = 1,86 СО2 нм3/(кг С)
Лекция 4
Слайд 7Лекция 3
1 кг С + 2.66 кг (1.86 м3) О2 =
1 кг S + 1 кг (0.7 м3) О2 = 2 кг (0.7 м3) SО2
1 кг H2 + 8 кг (5.55 м3) О2 = 9кг (11.8 м3) Н2О
(всю серу полагают органической)
Слайд 8Лекция 4
Теоретический объем (расход) воздуха
– это объем воздуха (при нормальных условиях),
или
1 м3 газообразного топлива (м3/м3)
Слайд 9Лекция 3
Теоретический объем воздуха (0,21О2+0.79N2), м3/кг
Здесь предполагается, что имеющийся в топливе
Поэтому в окислении кислородом воздуха нуждается только свободный водород (Нр – 0.125Ор).
kвозд = 0.033 для органич. серы, kвозд= 0.0456 для колчеданной серы, а так как вся сера в расчетах считается органической
для обеих принимают kвозд ≈ 0.033.
(Ср/100)*(1.86/0.21)
(Нрсвоб/100)*(5.55/0.21)
Формула может быть приведена к виду:
Слайд 10
Лекция 3
Теоретический объем воздуха для полного сгорания
сухого газообразного топлива, м3/м3
Слайд 11Условно принимается, что азот в составе как топлива, так и воздуха,
Лекция 3
Теоретический объем сухих продуктов сгорания, образующихся при сжигании 1 кг твердого/жидкого топлива
в теоретически необходимом объеме воздуха, м3/кг
Слайд 12Лекция 3
Теоретическое количество водяного пара
Кроме сухих газов в состав продуктов сгорания
пар, образующийся в результате полного сгорания водорода топлива (как свободного, так и связанного);
пар, полученный при испарении влаги топлива;
пар, вносимый в топку с теоретическим количеством воздуха (содержание влаги в воздухе принимают обычно d = 10 г/кг = 0.01 кг/кг или 0.0161 м3/м3);
пар, используемый иногда для распыления мазута в форсунках (Gф , кг/кг).
Слайд 13
0.0161 – объём водяного пара в 1 м3 атмосферного воздуха;
Лекция
Gф – масса пара, расходуемого на распыление мазута в паровых форсунках, кг/кг топлива.
Теоретическое количество водяного пара, м3/кг
Слайд 14
Лекция 3
складывается из объемов
трёхатомных газов*
теоретического
и теоретического количества водяного пара
* при анализе состава продуктов сгорания концентрации трёхатомных газов CO2 и SO2 раньше измерялись совместно, что давало их суммарный объём.
трёхатомные газы наряду с парами воды ответственны за тепловое излучение от факела горящего топлива к топочным экранам.
Теоретический объем продуктов сгорания, м3/кг
Слайд 15 Скорость горения в топочной камере определяется концентрациями топлива и окислителя, а
В процессе горения по мере расходования топлива и кислорода их концентрации уменьшаются, и скорость горения падает.
При этом вследствие ограниченной скорости перемешивания топлива и воздуха трудно добиться полного выгорания топлива при теоретическом количестве воздуха.
Поэтому в топку всегда подаётся больше воздуха, чем теоретически необходимо.
Лекция 3
Действительные объёмы продукты сгорания.
Избыток воздуха в топке
Слайд 16Коэффициент избытка воздуха
на входе в топку
– это отношение количества воздухаVв
к его теоретически необходимому количеству V о
Лекция 4
Слайд 17 Для пылеугольных топок α т = 1.2-1.25, при этом нижний предел
При размоле бурых и каменных углей в молотковых мельницах рекомендуется выбирать верхний предел, т.е. 1.25.
При жидком шлакоудалении из-за повышения температуры в топке и уменьшения присосов воздуха αт может быть снижен для однокамерных топок до 1.2,
Для двухкамерных и циклонных топок - до 1.1.
При сжигании природных газов и мазута в котлах, снабженных автоматикой горения и регуляторами давления в газопроводе, αт может быть снижен до 1.05.
При сжигании древесного и альтернативных местных топлив в котлах малой мощности принимают α т = 1.2-1.3
Лекция 3
Для вновь проектируемых котлов α т выбирают в зависимости от вида сжигаемого топлива, метода сжигания и конструкции топки
Слайд 18
Лекция 3
С другой стороны, действительный объем продуктов сгорания складывается из сухих
Действительный объем продуктов сгорания при αт >1 больше теоретического на
объем избыточного воздуха на входе в топку (α –1)Vo
и объем водяных паров, содержащихся в избыточном воздухе, 0.0161(α – 1)Vо.
Поэтому общий действительный объем продуктов сгорания, м3/кг
Слайд 20Лекция 3
Масса продуктов сгорания Gг (кг/кг)
Согласно закону сохранение вещества масса газообразных
Слайд 21Для горючих сланцев объём трёхатомных газов
К – коэффициент разложения карбонатов: при
должен включать дополнительное выделение углекислоты из разложившихся карбонатов
Лекция 4
Слайд 23
Объём трёхатомных газов:
Объем сухих газов:
Лекция 3
Теоретический объем азота:
Теоретический объем продуктов сгорания
Слайд 24Лекция 3
Теоретический объём водяных паров в продуктах сгорания газообразного топлива
(пар-продукт
– влагосодержание 1 м3 сухого газообразного топлива,
≈ 10 г/м3.
Действительный объем продуктов сгорания газа
(теор.объём + объём влажного избыт. воздуха)
Слайд 25Часто в топочных камерах с помощью дымососа поддерживается небольшое разрежение для
В последующих за топкой газоходах котла разрежение больше, чем в топке на величину их гидравлического сопротивления.
Через неплотности в металлической обшивке и обмуровке котла, через лазы и гляделки в газоходы, находящиеся под разрежением, подсасывается атмосферный воздух. За счет этого увеличивается объем продуктов сгорания
Современные котельные агрегаты имеют газоплотные топочные камеры и газоходы, предотвращающие подсосы воздуха α т = α ух.
Лекция 3
Определение реального коэффициента избытка
воздуха по составу дымовых газов
Слайд 26В балансовых испытаниях котла коэффициент избытка воздуха определяется с помощью газового
Обычно в газоанализаторах исследуется осушенный газ, т.е. определяется состав сухого газа (в % по объёму).
Коэффициент избытка воздуха при полном сгорании топлива можно определить по концентрациям кислорода и азота в сухих газах ("азотная" формула)
Лекция 4
Слайд 27 При сжигании чистого углерода в теоретическом количестве воздуха (α
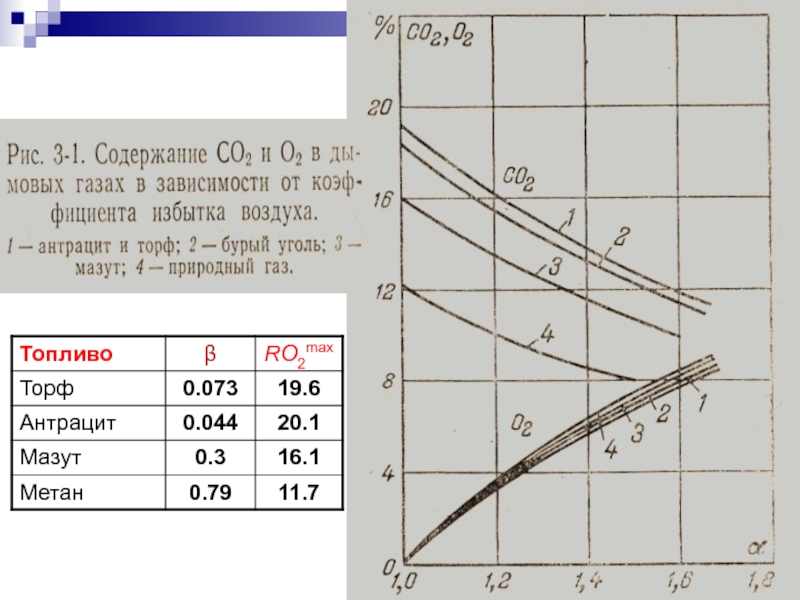
RО2 макс = СО2макс = 21 %.
Лекция 3
(в воздухе 21 % кислорода; согласно реакции горения
C + O2 = CO2
1 кмоль кислорода заменяется одним кмолем CO2 ,
т.е. весь O2 заменяется таким же объёмом CO2, поэтому конечная концентрация диоксида углерода равна исходной концентрации кислорода = 21 %).
Концентрация RО2 в сухих продуктах сгорания определяется по формуле
Слайд 28Лекция 4
При сжигании природных топлив, в которых кроме С
где β – топливный коэффициент Бунте для твёрдого и жидкого топлива
Т.обр., для каждого топлива существует максимальное содержание RО2 , которое образуется при полном сгорании в условиях α = 1.
Слайд 30Лекция 3
По-существу, это уравнение представляет собой баланс массы кислорода: исходный кислород
Топливный коэффициент Бунте
– величина, зависящая только от элементарного состава топлива (т.е. – характеристика топлива) и равная отношению
(объём О2 на окисление свободного водорода топлива) / (объём О2 на образование 3-атомных газов).
При полном сгорании топлива и α > 1, т.е. при наличии в газах остаточного кислорода, концентрация CO2 будет ещё меньше:
откуда следует ОБЩЕЕ (ОСНОВНОЕ) УРАВНЕНИЕ ПОЛНОГО
ГОРЕНИЯ ТОПЛИВА
Слайд 31Лекция 3
После подстановки значений концентраций О2 и N2 в азотную формулу
Если пренебречь коэффициентом Бунте (т.е. окислением водорода), то расчет α можно вести по приближённой формуле
Отсюда содержание кислорода и азота в сухих дымовых газах при полном сгорании топлива и α > 1
Слайд 32Физический смысл: при полном сгорании топлива объем подаваемого для горения воздуха
Тогда коэффициент избытка воздуха можно выразить как отношение объёмного содержания кислорода в воздухе, подаваемом для горения, к процентной доле "сгоревшего" кислорода.
где 21 % – содержание кислорода в исходном воздухе,
О2 , % – концентрация остаточного кислорода в сухих газах,
(21- О2), % – "сгоревший" кислород.
Лекция 3
Последнюю формулу называют "кислородной"
Слайд 35
Лекция 3
где вместо измеренной концентрации О2 в сухих газах используется избыточная
При неполном сгорании топлива коэффициент избытка воздуха определяется по модифицированной азотной формуле
измеренные концентрации О2 и продуктов неполного сгорания в сухих газах
Слайд 36
Лекция 3
Отсюда
Концентрация азота в сухих продуктах неполного сгорания в пренебрежении небольшим
ОБЩЕЕ УРАВНЕНИЕ НЕПОЛНОГО ГОРЕНИЯ
для случая, когда в дымовых газах из продуктов неполного сгорания имеется только СО
Слайд 37Так как концентрация свободного кислорода в продуктах сгорания О2 в основном
С этой целью применяются
автоматические кислородомеры.
Лекция 4
Слайд 38Тesto 325 М/XL
Измеряет в дымовых газах концентрации О2
(СО с компенсацией по Н2 – только Тesto 325XL). 2 канала измерения температуры, двухдиапазонный встроенный датчик давления. Возможность распечатки данных на IR принтере.
Расчет показаний СО2 по заданному СО2 max.
Диапазон измерения: – 40 °С …+600°С ± 40(200) мбар 0…21% О2 0…4000 ppm CO
Лекция 3
Компактный анализатор дымовых газов
Слайд 39Тesto 330-1/2
Измеряет концентрацию в дымовых газах О2 , СО, NO.
Имеет
Может комплектоваться различными газозаборными зондами.
Диапазон измерения: -40 °С …+1200°С ±80 мбар 0…21% О2 0…4000/8000 ppm CO 0…300(3000-опция) ppm NO 0…500 ppm CO атмосф.
Лекция 4
Слайд 40Тesto 300 М/XL
Измеряет концентрацию в дымовых газах О2, СО, NO.
Имеет
Диапазон измерения: -40 °С …+1200°С ±80 мБар 0…21% О2 0…8000 ppm CO 0…3000 ppm NO 0…500 ppm CO атмосф.
Лекция 4
Слайд 41 Базовая версия:
- управляющий модуль,
- анализатор и
-
Измеряет:
- О2 , СО, NO (опция), NO2 или CO2 (опция), (максимум 4 модуля; встроенный датчик, в зависимости от подключенных внешних зондов),
- температуру,
- дифференциальное давление.
Управляющий модуль может использоваться как прибор для измерения:
- температуры,
- влажности,
- скорости воздуха,
- дифференциального давления,
- концентрации атмосферного CO и СО2 ,
- скорости вращения.
Имеется встроенный блок пробоподготовки.
Лекция 3
Портативный модульный газоанализатор Тesto 350 М