- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ презентация
Содержание
- 1. Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
- 2. План лекции: 1. Общие вопросы аналитической химии.
- 3. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
- 4. КОНСПЕКТ В ИНТЕРНЕТЕ
- 5. Определение предмета «Аналитическая химия»
- 6. Аналитическая химия, или аналитика – это раздел
- 7. Определение VIII Европейской конференции по аналитической химии
- 8. Определение по Г.Кристиану со ссылкой на Чарльза
- 9. Аналитическая служба Административная система, обеспечивающая конкретный анализ
- 10. СТРУКТУРА ДИСЦИПЛИНЫ «АНАЛИТИЧЕСКАЯ ХИМИЯ» 1) КАЧЕСТВЕННЫЙ (QUALITY)
- 11. ОСНОВНАЯ ЦЕЛЬ КУРСА АХ ОБЩЕОБРАЗОВАТЕЛЬНЫЙ ПРЕДМЕТ, НУЖНЫЙ ВПОСЛЕДСТВИИ ПРИ ИЗУЧЕНИИ ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
- 12. Основные понятия аналитической химии: принцип, метод и методика анализа
- 13. Принцип анализа Явление, используемое для получения аналитической
- 14. Метод анализа Краткое изложение принципов, лежащих в
- 15. Методика анализа Методика анализа – это подробное
- 16. В зависимости от цели различают качественный, количественный и структурный анализ.
- 17. Качественный анализ Качественный анализ предполагает обнаружение или идентификацию компонентов анализируемого образца.
- 18. Структурный анализ (ОДНА ИЗ РАЗНОВИДНОСТЕЙ КАЧЕСТВЕННОГО АНАЛИЗА)
- 19. Количественный анализ В процессе количественного анализа происходит определение концентраций или масс компонентов.
- 20. Классификация видов анализа в зависимости от определяемого компонента
- 21. Классификация видов анализа в зависимости от массы или объема анализируемой пробы
- 22. Классификация видов анализа в зависимости от процедуры
- 23. Характеристики аналитической реакции Избирательность ( селективность) –
- 24. Избирательность аналитической реакции (в зависимости от
- 25. ПРЕДЕЛ ОБНАРУЖЕНИЯ НАИМЕНЬШЕЕ СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА)
- 26. ПРЕДЕЛ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА) КОТОРЫЙ
- 27. ДИАПАЗОН ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ РАЗНОСТЬ МЕЖДУ НИЖНЕЙ И ВЕРХНЕЙ ГРАНИЦАМИ ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ.
- 28. Методы аналитической химии
- 29. Методы аналитической химии при анализе образцов 1.
- 30. Химические методы обнаружения неорганических веществ.
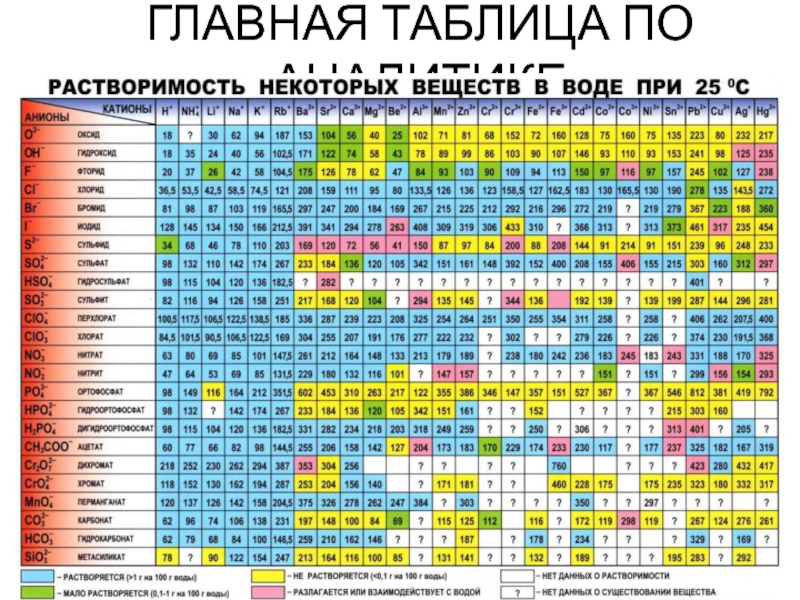
- 31. ГЛАВНАЯ ТАБЛИЦА ПО АНАЛИТИКЕ
- 32. Химические методы обнаружения неорганических веществ основаны на
- 33. Эффекты при аналитических реакциях 1. Образование и
- 34. Понятие аналитической группы ионов
- 35. Понятие аналитической группы ионов Аналитическая группа ионов
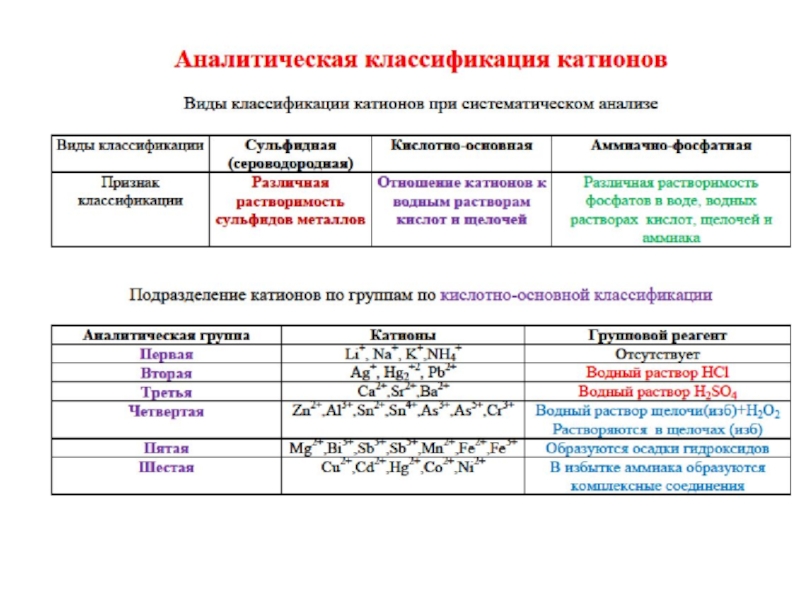
- 36. Аналитическая классификация катионов
- 38. Аналитическая классификация катионов Сульфидная; Кислотно-основная; Аммиачно-фосфатная;
- 39. АНАЛИТИЧЕСКИЕ ГРУППЫ ИОНОВ 6 ГРУПП КАТИОНОВ ПО
- 41. Сульфидная Аналитическая классификация катионов Групповые реагенты –
- 42. Кислотно-основная аналитическая классификация катионов Все катионы подразделяются
- 43. Аммиачно-фосфатная аналитическая классификация катионов В основу положена
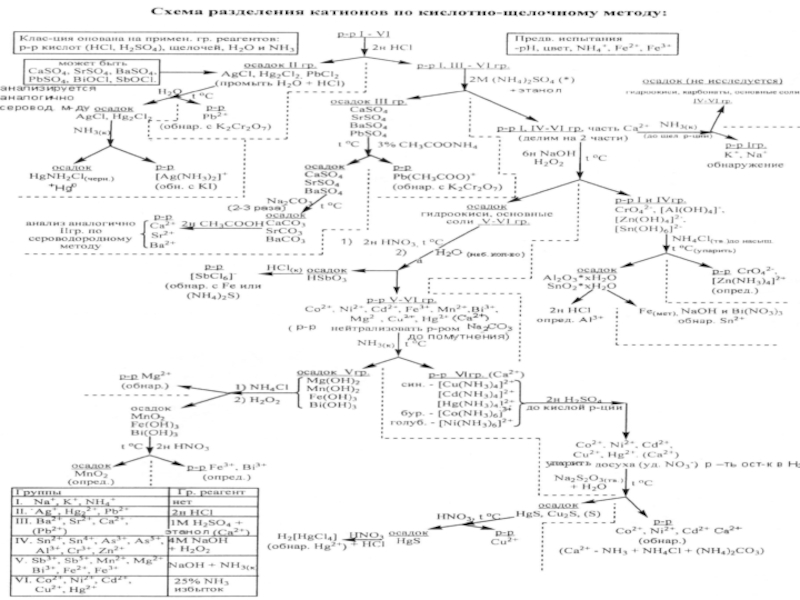
- 44. АНАЛИЗ КАТИОНОВ (ПО Кислотно-основной классификация)
- 45. МЕШАЮЩЕЕ ВЛИЯНИЕ ИОНОВ Li+ (Na+) + Zn(UO2)3CH3COO-=
- 46. ПО ОТНОШЕНИЮ К ГРУППОВОМУ РЕАГЕНТУ НЕ ИМЕЮТ ГРУППОВОГО РЕАГЕНТА ИМЕЮТ ГРУППОВОЙ РЕАГЕНТ
- 47. Подразделение катионов по группам по кислотно-основной классификации
- 48. ИМЕЮТ ГРУППОВОЙ РЕАГЕНТ КИСЛОТЫ НЕРАСТВОРМЫЕ ХЛОРИДЫ
- 49. ОСОБОЕ ПОВЕДЕНИЕ Pb2+, . ρ*(PbСl2)=9,8 г/л
- 50. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
- 51. Реакции ионов Li+
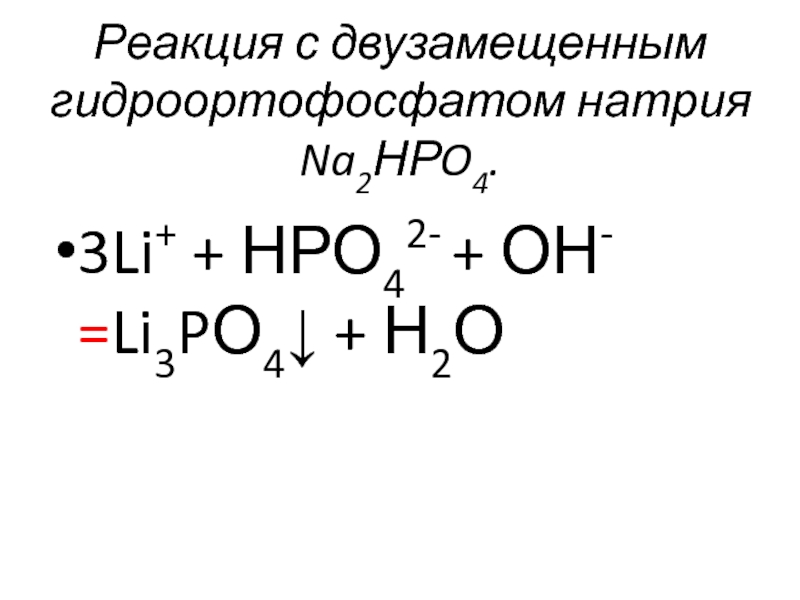
- 52. Реакция с двузамещенным гидроортофосфатом натрия Na2НРO4. 3Li+ + НРО42- + ОН- =Li3PО4↓ + Н2О
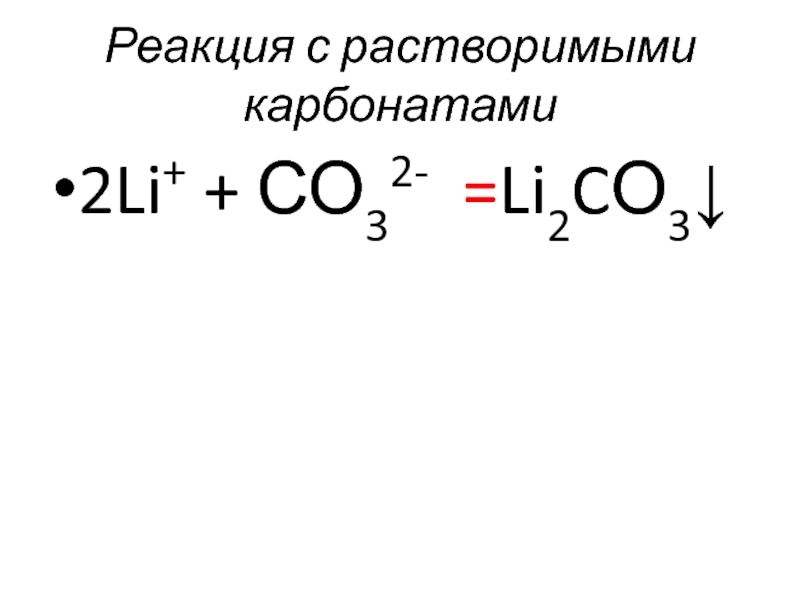
- 53. Реакция с растворимыми карбонатами 2Li+ + СО32- =Li2CО3↓
- 54. Реакция с растворимыми фторидами Li+ + F- = LiF↓
- 55. Реакции ионов Na+
- 56. Микрокристаллоскопическая реакция с цинкуранилацетатом (уже не фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О
- 57. .Реакция с гексагидроксостибатом (V) калия Na+ + [Sb(OH)6]- =Na[Sb(OH)6]↓
- 58. Реакции ионов K+
- 59. Реакция с гексанитрокобальтатом (III) натрия
- 60. Реакция с гидротартратом натрия (фармакопейная) К+ + NaHC4H4О6 =КНС4Н4О6↓ + Na+.
- 61. Реакции ионов NH4+
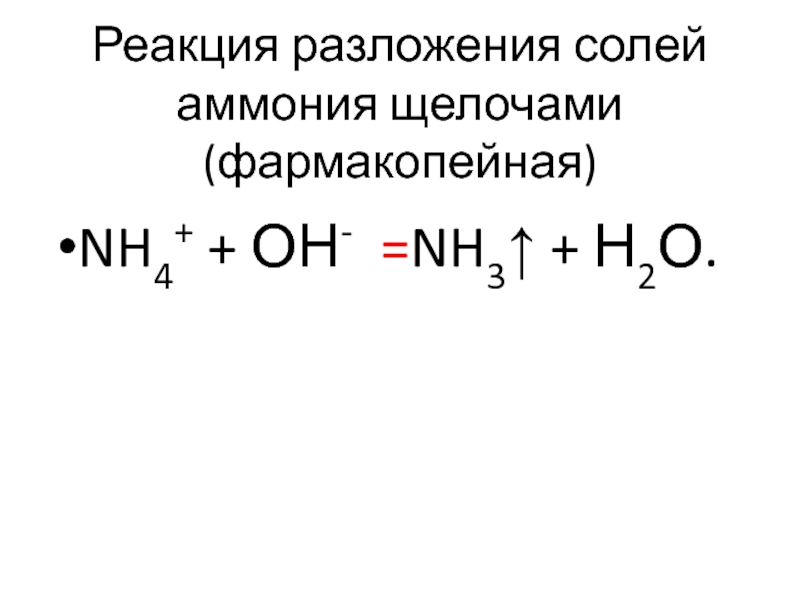
- 62. Реакция разложения солей аммония щелочами (фармакопейная) NH4+ + ОН- =NH3↑ + Н2О.
- 63. Реакция с реактивом Несслера — смесью раствора
- 64. Систематический анализ смеси катионов Li+, Na+, K+,
- 65. Вторая аналитическая группа катионов -Ag+, Pb2+, Hg22+,
- 66. Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О
- 67. Реакции ионов Ag+
- 68. Реакция со щелочами 2Ag+ + 2ОН-
- 69. Растворимые галогениды Ag+ + Сl- = AgCl↓;
- 70. Различие галогенидов серебра Осадок хлорида серебра растворим
- 71. Хромат калия - осадок кирпично-красного цвета: 2Ag+ + CrО42- = Ag2CrО4↓
- 72. Гидрофосфат натрия 3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4-
- 73. Реакция восстановления Ag+ до металлического серебра 4[Ag(NH3)2]OH
- 74. Реакции ионов Pb2+
- 75. Действие щелочей и аммиака Pb2+ + 2OH- = Pb(OH)2 ↓
- 76. Растворимые галогениды Pb2+ +2Cl - = PbCl2
- 77. Осадки галогенидов свинца (II) растворимы в горячей
- 78. Хромат калия образует желтый осадок Pb2+ + CrO42- = PbCrO4 ↓
- 79. Реакция с сульфид-ионами Pb2+ + S2- = PbS ↓
- 80. Реакции ионов Hg22+
- 81. Действие щелочей Hg22+ + 2OH- = Hg2O↓ + H2O
- 82. Водный раствор аммиака 2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.
- 83. Растворимые хлориды Hg22+ + 2Сl- = Hg2Cl2↓ (каломель).
- 84. Растворимые иодиды Hg22+ + 2I- = Hg2I2↓.
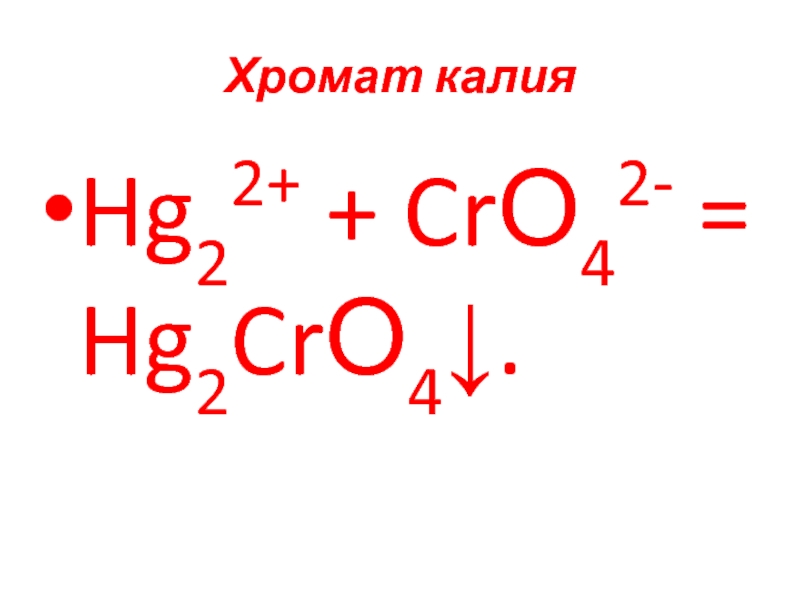
- 85. Хромат калия Hg22+ + CrО42- = Hg2CrО4↓.
- 86. Восстановление ртути (I) до металлической ртути. Hg22+ + Сu = 2Hg↓ + Сu2+.
- 87. Третья аналитическая группа катионов -Ca2+ , Sr2+, Ba2+,
- 88. Реакции ионов Ca2+
- 89. Серная кислота Са2+ + SO42- + 2Н2О = CaSO4∙2Н2О↓.
- 90. Карбонат аммония Са2+ + СO32- = СаСO3↓.
- 91. Оксалат аммония Са2+ + С2O42- = СаС2О4↓
- 92. Гексацианоферрат (II) калия Са2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.
- 93. Реакции ионов Sr2+
- 94. Серная кислота, растворимые сульфаты и гипсовая вода
- 95. Карбонат аммония Sr2+ + СО32- = SrCO3↓.
- 96. Оксалат аммония Sr2+ + С2O42- = SrC2O4↓.
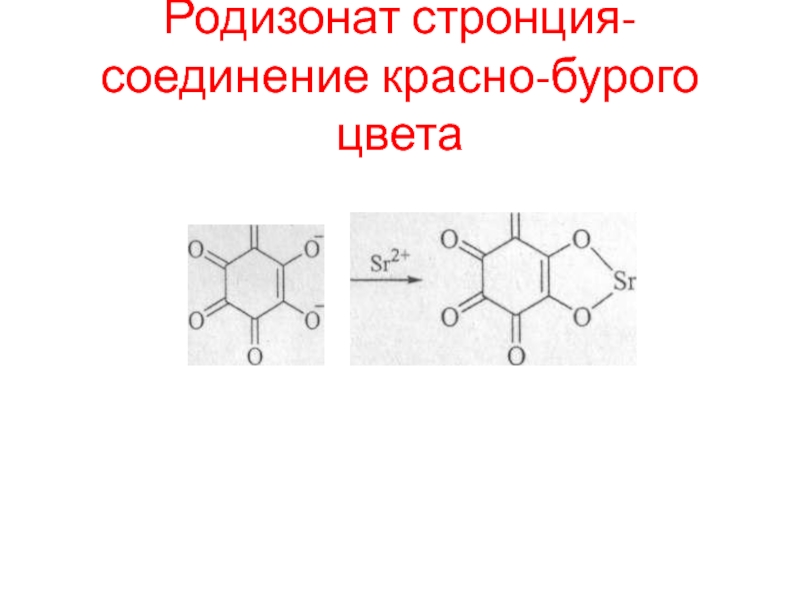
- 97. Родизонат стронция- соединение красно-бурого цвета
- 98. Реакции ионов Ba2+
- 99. Серная кислота и растворимые сульфаты Ва2+ + SO42- = BaSO4↓.
- 100. Карбонат аммония Ва2+ + СO32- = BaCO3↓.
- 101. Оксалат аммония Ва2+ + С2O42- = BaC2O4↓.
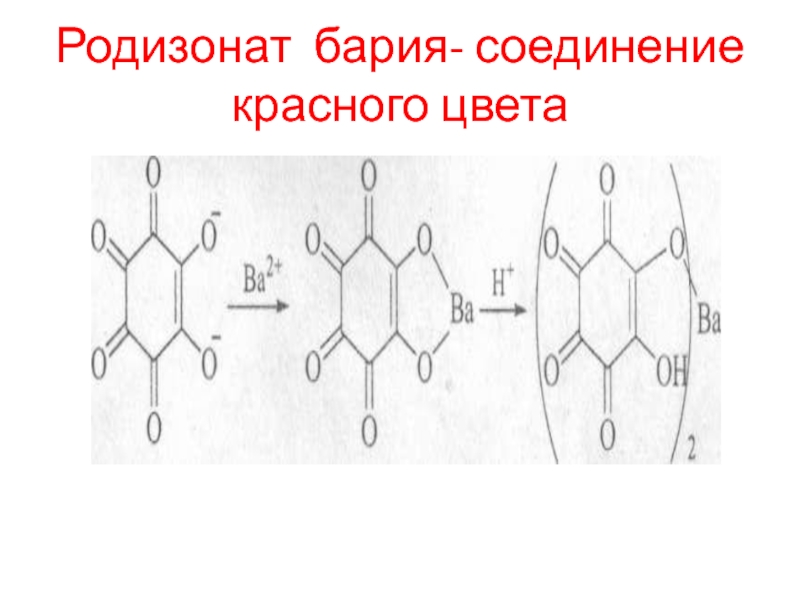
- 102. Родизонат бария- соединение красного цвета
- 103. Хромат или дихромат калия дают осадки ярко-желтого
- 104. СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА Третья аналитическая группа катионов
- 105. ПЕРЕВОД ОСАДКОВ В РАСТВОРИМОЕ СОСТОЯНИЕ СУЛЬФАТЫ КАТИНОВ
- 106. ИДЕНТИФИКАЦИЯ КАТИОНА БАРИЯ ОБНАРУЖИВАЮТ РЕАКЦИЙ С K2Cr2O7
- 107. ОБНАРУЖЕНИЕ СТРОНЦИЯ И КАЛЬЦИЯ. РАЗДЕЛЕНИЕ ОСНОВАНИЕ
- 108. Анализ смеси катионов IVаналитической группы
- 109. Общая характеристика химических свойств
- 110. Катионы IV группы Al3+, Cr3+ , Zn2+ , Sn2+ , Sn (IV).
- 111. Основное свойство Амфотерность. В данном случае
- 112. Гидроксокомплексы при избытке NaOH [Al(OH)4]-, [Cr(OH)4]- , [Zn(OH)4]2-
- 113. Катионы в водных растворах Обладают выраженными кислотными свойствами; Бесцветны, за исключением [Cr(Н2O)6]3+ - серо-зеленого цвета
- 114. AL3+ характеристика химических свойств
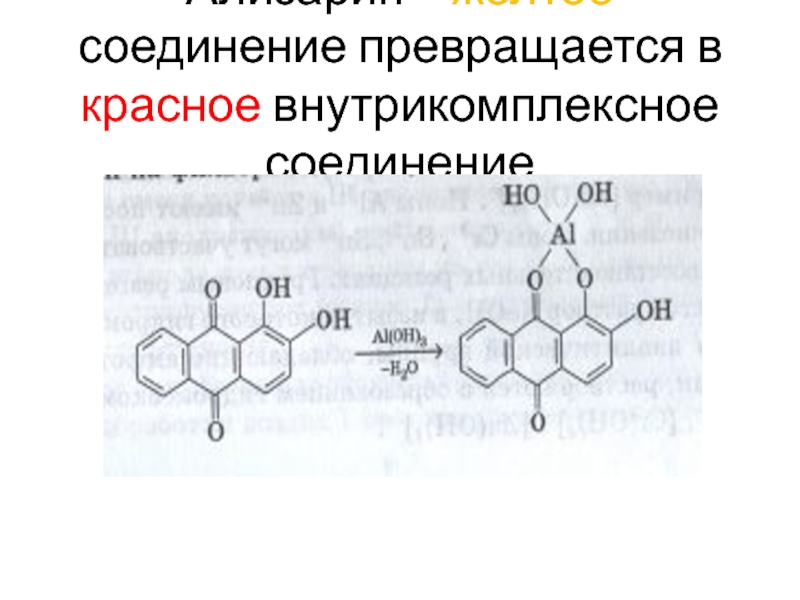
- 115. Ализарин – желтое соединение превращается в красное внутрикомплексное соединение
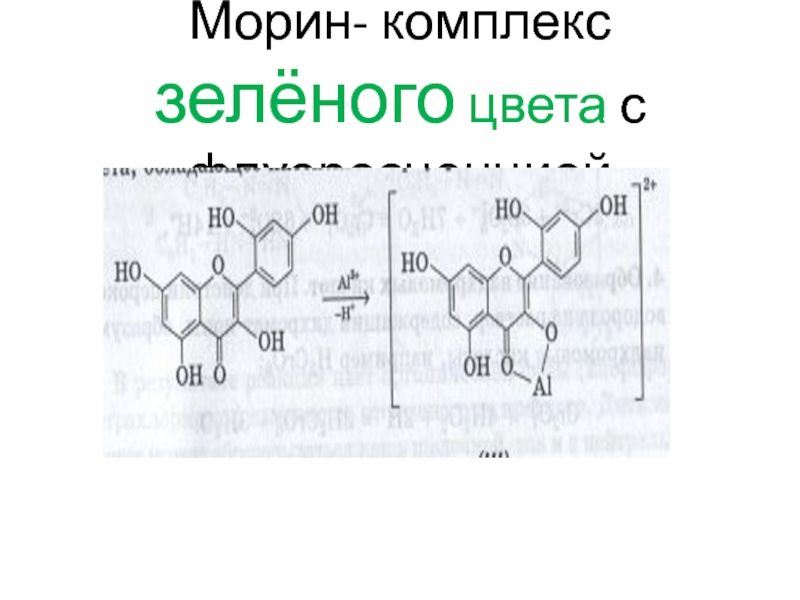
- 116. Морин- комплекс зелёного цвета с флуоресценцией
- 117. CR3+ характеристика химических свойств
- 118. АММИАКАТЫ ХРОМА ОРАНЖЕВОГО ЦВЕТА, n=6 , ОДНАКО РЕАКЦИЯ ПРОТЕКАЕТ КРАЙНЕ МЕДЛЕННО [Cr(NH3)6] 3+
- 119. Окисление Cr(III) до Cr(VI) Щелочная среда 2[Cr(OH)6]3-
- 120. Образование надхромовых кислот Cr2O72- + 4H2O2 + 2H+ = 2H2Cr+6O6 + 3H2O
- 121. ПОЯСНЕНИЕ НАДКИСЛОТЫ- КИСЛОТЫ, В КОТОРЫХ ОДИН ИЛИ НЕСКОЛЬКО КИСЛОРОДОВ О2- ЗАМЕНЕН НА ПЕРОКСИДНУЮ ГРУППИРОВКУ О22-
- 122. ЭКСТРАКЦИЯ надхромовых кислот Экстргент -диэтиловый эфир , этилацетат – органическая фаза синего цвета
- 123. ZN2+ Общая характеристика химических свойств
- 124. Действие щелочей и аммиака Zn2+ + 2OH-
- 125. Реакция с сульфидом натрия – белый осадок Zn2+ + S2- = ZnS ↓
- 126. Реакция с дитизоном – цвет изменяется от зеленого до красного
- 127. ОСОБЕННОСТИ В ЩЕЛОЧНОЙ СРЕДЕ В КРАСНЫЙ ЦВЕТ ОКРАШЕНЫ ОБЕ ФАЗЫ
- 128. Гекса циано феррит калия Гекса циано феррaт
- 129. SN2+ И SN(IV) характеристика химических свойств
- 130. Реакции сульфид-ионов Sn2+ + S2- = SnS ↓ (бурый) [SnCl6]2-+H2S= 6Cl-+2H++ SnS2↓(желтый)
- 131. Реакции окисления-восстановления
- 132. Анализ смеси катионов IV аналитической группы по систематическому анализу
- 133. ОБНАРУЖЕНИЕ ХРОМА ЧЕРЕЗ ОКИСЛЕНИЕ Н2О2 В ЩЕЛОЧНОЙ СРЕДЕ. ОБРАЗУЕТСЯ ЖЕЛТЫЙ ХРОМАТ
- 134. ВЫДЕЛЕНИЕ Al+3 И Sn (IV) В
- 135. РАСТВОРЕНИЕ ОСАДКОВ И АНАЛИЗ РАСТВОРЯЮТ ОСАДКИ
- 136. ПЕРЕВОД ЦИНКА В ОСАДОК – (ZnOH)2CO3 ОБРАБОТКА Na2CO3
- 137. ТЕМА СЛЕДУЮЩЕЙ ЛЕКЦИИ ХИМИЧЕСКИЕ МЕТОДЫ ОБНАРУЖЕНИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Слайд 1Тема лекции
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ.
Слайд 2 План лекции:
1. Общие вопросы аналитической химии.
2. Литература по аналитической химии.
3.
3. Реакции обнаружения катионов I аналитической группы.
4. Реакции обнаружения катионов I I аналитической группы.
Слайд 6Аналитическая химия, или аналитика – это раздел химической науки, разрабатывающий на
Слайд 7Определение VIII Европейской конференции по аналитической химии (Эдинбург, 1993)- Аналитическая химия
Слайд 8Определение по Г.Кристиану со ссылкой на Чарльза Н.Рейли
Аналитическая химия – это
Слайд 9Аналитическая служба
Административная система, обеспечивающая конкретный анализ определенных объектов с использованием методов,
Слайд 10СТРУКТУРА ДИСЦИПЛИНЫ «АНАЛИТИЧЕСКАЯ ХИМИЯ»
1) КАЧЕСТВЕННЫЙ (QUALITY) АНАЛИЗ;
2) КОЛИЧЕСТВЕННЫЙ (QUANTITY) АНАЛИЗ;
3) ФИЗИКО-ХИМИЧЕСКИЕ
Слайд 11ОСНОВНАЯ ЦЕЛЬ КУРСА АХ
ОБЩЕОБРАЗОВАТЕЛЬНЫЙ ПРЕДМЕТ, НУЖНЫЙ ВПОСЛЕДСТВИИ ПРИ ИЗУЧЕНИИ ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Слайд 13Принцип анализа
Явление, используемое для получения аналитической информации, называется принципом анализа. (Например,
Слайд 14Метод анализа
Краткое изложение принципов, лежащих в основе анализа вещества (вне зависимости
Слайд 15Методика анализа
Методика анализа – это подробное описание хода выполнения конкретного анализа
Слайд 17Качественный анализ
Качественный анализ предполагает обнаружение или идентификацию компонентов анализируемого образца.
Слайд 18Структурный анализ (ОДНА ИЗ РАЗНОВИДНОСТЕЙ КАЧЕСТВЕННОГО АНАЛИЗА)
Цель структурного анализа – установление
Слайд 19Количественный анализ
В процессе количественного анализа происходит определение концентраций или масс компонентов.
Слайд 22Классификация видов анализа в зависимости от процедуры проведения анализа
Систематический –разделение смеси
Дробный – определение определенного элемента, для подтверждения его нахождения в смеси.
Локальный – определение элементов на определенном участке поверхности.
Слайд 23Характеристики аналитической реакции
Избирательность ( селективность) – возможность определения в результате аналитической
Предел обнаружения (определения) – минимальное количество вещества, которое можно определить качественно (количественно);
Слайд 24Избирательность аналитической реакции (в зависимости от числа веществ)
Специфические реакции –
Избирательные реакции - позволяют определять небольшое число о веществ;
Групповые реакции – используются в систематическом анализе для выделения группы веществ;
Слайд 25ПРЕДЕЛ ОБНАРУЖЕНИЯ
НАИМЕНЬШЕЕ СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА) КОТОРОЕ ПО ДАННОЙ МЕТОДИКЕ МОЖНО
Слайд 26ПРЕДЕЛ ОПРЕДЕЛЕНИЯ
СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА) КОТОРЫЙ ПРЕВЫШАЕТ СРЕДНЕЕ ЗНАЧЕНИЕ СИГНАЛА КОНТРОЛЬНОГО
Слайд 27ДИАПАЗОН ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ
РАЗНОСТЬ МЕЖДУ НИЖНЕЙ И ВЕРХНЕЙ ГРАНИЦАМИ ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ.
Слайд 29Методы аналитической химии при анализе образцов
1. Метод пробоотбора;
2. Метод разложения проб;
3.
4. Метод обнаружения и количественного определения
Слайд 32Химические методы обнаружения неорганических веществ основаны на проведении аналитических реакций. Аналитическими
Слайд 33Эффекты при аналитических реакциях
1. Образование и растворение осадков
2. Образование характерных кристаллов
3.
4. Выделение газов
Слайд 35Понятие аналитической группы ионов
Аналитическая группа ионов отличается от групп Периодической таблицы
Аналитическая группа ионов обладает общностью свойств в реакциях осаждения или выделения, позволяющих отделить их от остальных ионов близкой химической природы
Слайд 39АНАЛИТИЧЕСКИЕ ГРУППЫ ИОНОВ
6 ГРУПП КАТИОНОВ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИ-КАЦИИ
3 ГРУППЫ АНИОНОВ ПО
Слайд 41Сульфидная Аналитическая классификация катионов
Групповые реагенты – сульфид аммония, сероводород и карбонат
Все катионы подразделяются на
5 аналитических групп. Различия в растворимости и сульфидов и образования осадков с карбонатом аммония
Слайд 42Кислотно-основная аналитическая классификация катионов
Все катионы подразделяются на 6 аналитических групп. Используется
Слайд 43Аммиачно-фосфатная
аналитическая классификация катионов
В основу положена различная растворимость фосфатов в воде, водных
Слайд 48ИМЕЮТ ГРУППОВОЙ РЕАГЕНТ
КИСЛОТЫ
НЕРАСТВОРМЫЕ ХЛОРИДЫ – HCl -
Ag+,, Hg22+,, Pb2+,
НЕРАСТВОРИМЫЕ
H2SO4 (NH4)2SO4- Ca2+, Sr2+, Ba2+,
ОСНОВАНИЯ
Амфотерные гидроксиды:
Al3+, Zn2+ , Cr3+
Нерастворимыегидроксиды:
Растворимые аммиачные комплексы:
Слайд 49ОСОБОЕ ПОВЕДЕНИЕ Pb2+,
. ρ*(PbСl2)=9,8 г/л
ρ*(PbSO4)= 0,045 г/л
Вывод Рb2+, можно отнести
Слайд 56Микрокристаллоскопическая реакция с цинкуранилацетатом (уже не фармакопейная).
Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО-
Слайд 59Реакция с гексанитрокобальтатом (III) натрия
кобальтинитритом натрия (фармакопейная)
2К+ + Na3[Co(NО2)6]
Слайд 63Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4] с
NH4+ + 2[HgI4]2- + 4OH- =[OHg2NH2]I + 7I- + 3H2O
Слайд 64Систематический анализ смеси катионов Li+, Na+, K+, NH4+
Сразу удаляют аммоний прокаливаем
Ионы Na+, K+, определяют дробными реакциями
Слайд 66Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная).
Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О
Слайд 70Различие галогенидов серебра
Осадок хлорида серебра растворим в растворе аммиака. Иодид серебра
Слайд 73Реакция восстановления Ag+ до металлического серебра
4[Ag(NH3)2]OH + CH2O =
4Ag↓ +
Слайд 77Осадки галогенидов свинца (II) растворимы в горячей воде и в присутствии
PbI2↓ + 2I- = [РbI4]2-
PbI2↓ + 2I-
[РbI4]2-.
Слайд 94Серная кислота, растворимые сульфаты и гипсовая вода (насыщенный водный раствор сульфата
Sr2++ SO42- = SrSO4↓.
Слайд 103Хромат или дихромат калия дают осадки ярко-желтого цвета
Ва2+ + СгO42-
2Ва2+ + Сг2O72- + Н2O = 2ВаСrO4↓ + 2Н+.
Слайд 105ПЕРЕВОД ОСАДКОВ В РАСТВОРИМОЕ СОСТОЯНИЕ
СУЛЬФАТЫ КАТИНОВ III ГРУППЫ С СН3СООН НЕ
Слайд 106ИДЕНТИФИКАЦИЯ КАТИОНА БАРИЯ
ОБНАРУЖИВАЮТ РЕАКЦИЙ С K2Cr2O7 СН3СООNa, ОСАЖДАЮТ С K2CrO4 7
Слайд 107ОБНАРУЖЕНИЕ СТРОНЦИЯ И КАЛЬЦИЯ.
РАЗДЕЛЕНИЕ ОСНОВАНИЕ НА ТОМ, ЧТО В НАСЫЩЕНОЙ
Слайд 111Основное свойство
Амфотерность. В данном случае - это способность растворяться в
Слайд 113Катионы в водных растворах
Обладают выраженными кислотными свойствами;
Бесцветны, за исключением [Cr(Н2O)6]3+ -
Слайд 118АММИАКАТЫ ХРОМА
ОРАНЖЕВОГО ЦВЕТА, n=6 , ОДНАКО РЕАКЦИЯ ПРОТЕКАЕТ КРАЙНЕ МЕДЛЕННО [Cr(NH3)6]
Слайд 119Окисление Cr(III) до Cr(VI)
Щелочная среда
2[Cr(OH)6]3- + 3H2O2 =
2CrO42- + 2OH-
Кислая среда
10Cr3+ + 6MnO4- + 11H2O =
5Cr2O72- + 22H+ + 6Mn2+
Слайд 121ПОЯСНЕНИЕ
НАДКИСЛОТЫ- КИСЛОТЫ, В КОТОРЫХ ОДИН ИЛИ НЕСКОЛЬКО КИСЛОРОДОВ О2- ЗАМЕНЕН НА
Слайд 122ЭКСТРАКЦИЯ
надхромовых кислот
Экстргент -диэтиловый эфир , этилацетат – органическая фаза синего
Слайд 124Действие щелочей и аммиака
Zn2+ + 2OH- = Zn(OH)2 ↓
Zn2+ + 2NH3
Zn(OH)2 ↓ +2H+ = Zn2+ + 2H2O
Zn(OH)2 ↓ + 2OH- = [Zn(OH)4]2-
Zn(OH)2 ↓ + 4NH3 = [Zn(NH3)4]2+ +2OH-
Слайд 128Гекса циано феррит калия Гекса циано феррaт (II) калия - ОСАДОК БЕЛОГО
3Zn2+ + 2K+ + 2[Fe(CN)6]4- = Zn3K2[Fe(CN)6]2↓
















































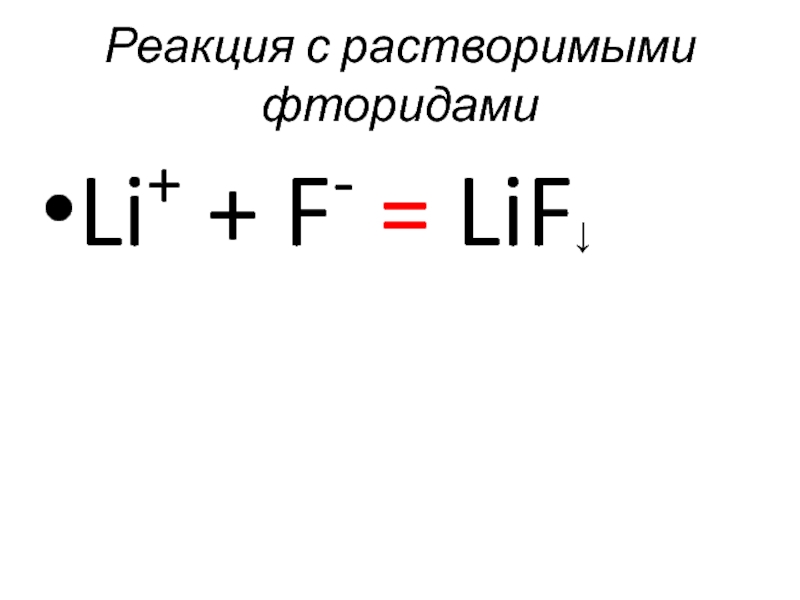
![Микрокристаллоскопическая реакция с цинкуранилацетатом (уже не фармакопейная).Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О](/img/tmb/5/489388/1f3ed2d3492b4305e79adf69481581e0-800x.jpg)
![.Реакция с гексагидроксостибатом (V) калияNa+ + [Sb(OH)6]- =Na[Sb(OH)6]↓](/img/tmb/5/489388/306f7b3b55f10a41dffe53d227a7894d-800x.jpg)

![Реакция с гексанитрокобальтатом (III) натрия кобальтинитритом натрия (фармакопейная)2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ + 2Na+.](/img/tmb/5/489388/46ecc594408902872e6a07bf95c4b923-800x.jpg)

![Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4] с КОН (фармакопейная)NH4+ + 2[HgI4]2-](/img/tmb/5/489388/13a5e7d6a3a892e00e0320a880a404ce-800x.jpg)


![Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная).Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О](/img/tmb/5/489388/3eae52990b18a37a52fa26cd20074e9a-800x.jpg)

![Реакция со щелочами 2Ag+ + 2ОН- Ag2O↓ + Н2О.Ag2O + 4NH3 + Н2О 2[Ag(NH3)2]+ + 2ОН](/img/tmb/5/489388/cd1aaf5e1d568f511dad65ba9bb7d664-800x.jpg)




![Реакция восстановления Ag+ до металлического серебра4[Ag(NH3)2]OH + CH2O = 4Ag↓ + (NH4)2CO3 + 6NH3 + 2H2O](/img/tmb/5/489388/2229e81fdfd7dbf2b31a7298220d232d-800x.jpg)






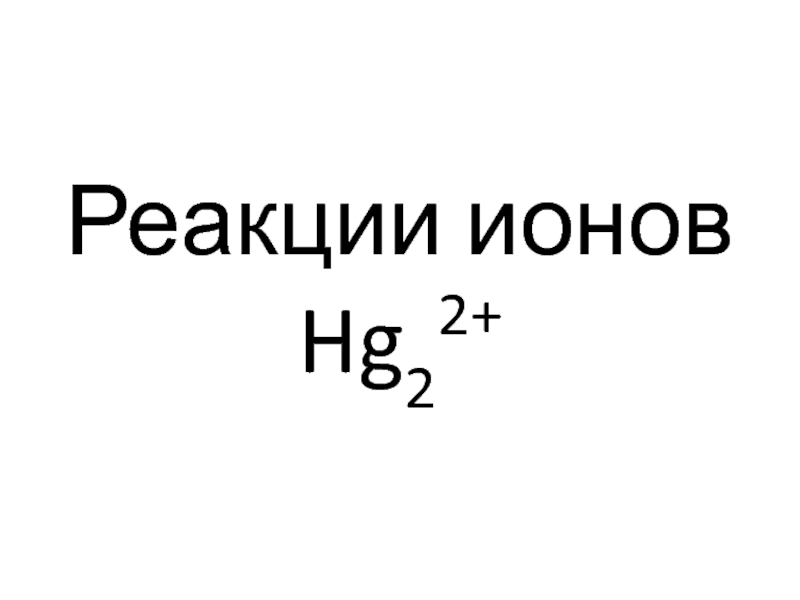

![Водный раствор аммиака2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.](/img/tmb/5/489388/03f258a1548715a750231a27ee972b8a-800x.jpg)

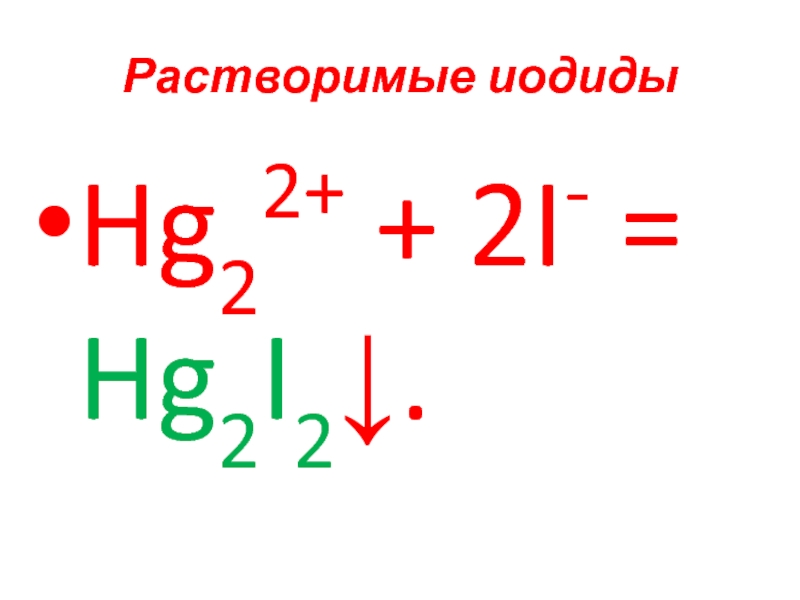


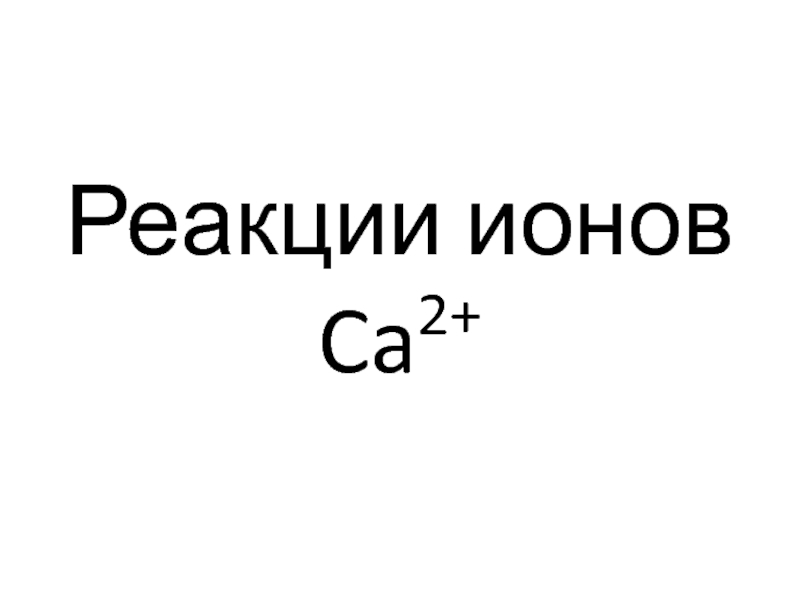



![Гексацианоферрат (II) калияСа2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.](/img/tmb/5/489388/e80c0290f6681b3eca1890661ba2dada-800x.jpg)




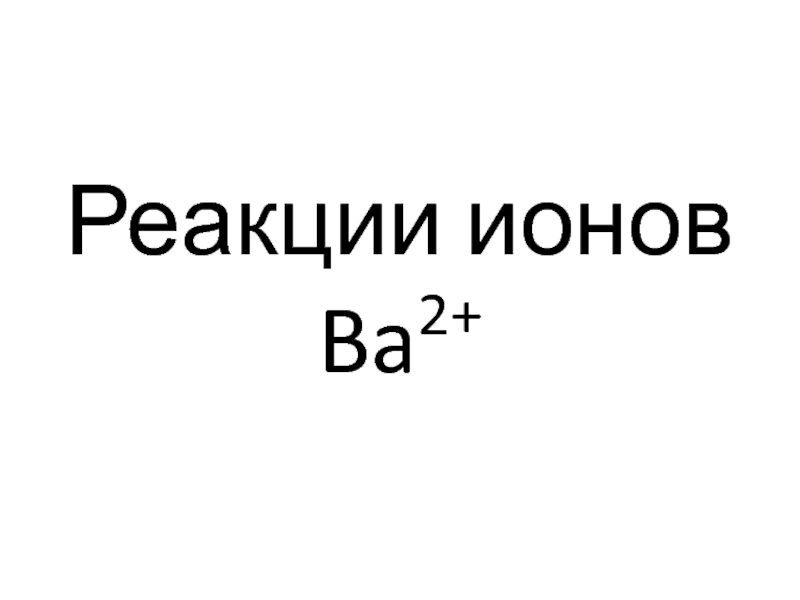







![ОБНАРУЖЕНИЕ СТРОНЦИЯ И КАЛЬЦИЯ. РАЗДЕЛЕНИЕ ОСНОВАНИЕ НА ТОМ, ЧТО В НАСЫЩЕНОЙ РАСТВОРЕ (NH4)2SO4 [Ca(SO4)2]2-, ОБРАЗУЕТ](/img/tmb/5/489388/953739237d32cd73bb8fb99a862b1900-800x.jpg)




![Гидроксокомплексы при избытке NaOH [Al(OH)4]-, [Cr(OH)4]- , [Zn(OH)4]2-](/img/tmb/5/489388/705a0fd17a540be12013381e50392082-800x.jpg)
![Катионы в водных растворахОбладают выраженными кислотными свойствами;Бесцветны, за исключением [Cr(Н2O)6]3+ - серо-зеленого цвета](/img/tmb/5/489388/7d1cbfe3c01e397e9b3cb98fd85660f1-800x.jpg)


![АММИАКАТЫ ХРОМАОРАНЖЕВОГО ЦВЕТА, n=6 , ОДНАКО РЕАКЦИЯ ПРОТЕКАЕТ КРАЙНЕ МЕДЛЕННО [Cr(NH3)6] 3+](/img/tmb/5/489388/404c412c805a2cef59b37c52d43da480-800x.jpg)
![Окисление Cr(III) до Cr(VI)Щелочная среда2[Cr(OH)6]3- + 3H2O2 = 2CrO42- + 2OH- +8H2OКислая среда 10Cr3+ +](/img/tmb/5/489388/b4967c69de45319e48c58629ff5dbb8d-800x.jpg)










![Реакции сульфид-ионовSn2+ + S2- = SnS ↓ (бурый)[SnCl6]2-+H2S=6Cl-+2H++ SnS2↓(желтый)](/img/tmb/5/489388/d963057a7537538279e4b55a69384099-800x.jpg)












