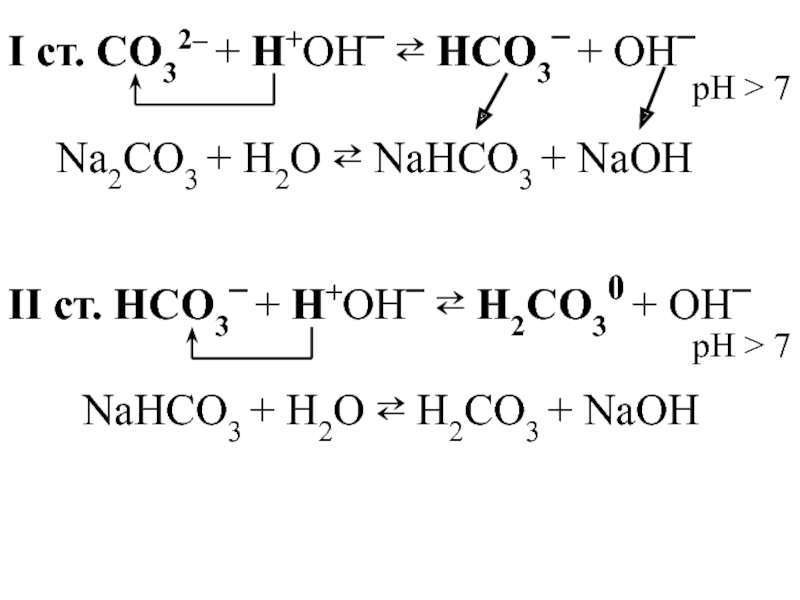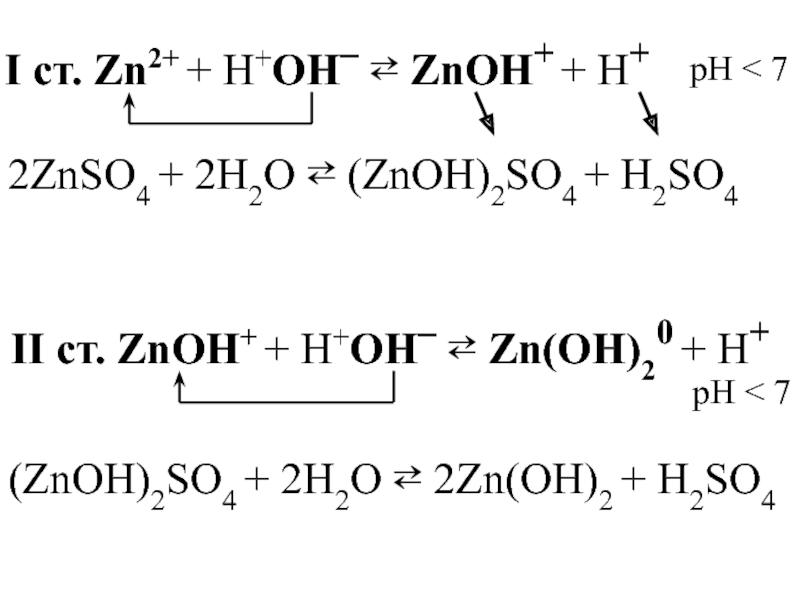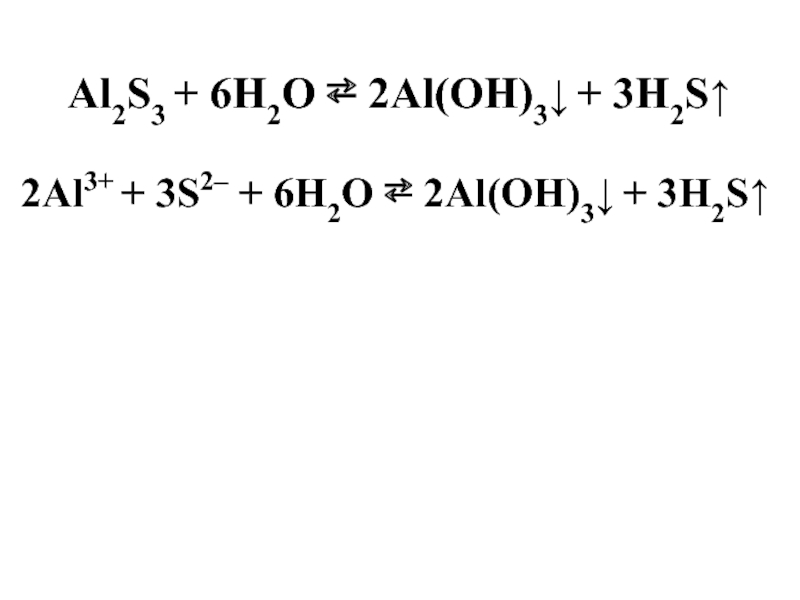- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Общая характеристика растворов презентация
Содержание
- 1. Растворы. Общая характеристика растворов
- 2. План лекции Общие положения; Способы выражения концентраций раствора; Электролитическая диссоциация, рН раствора; Гидролиз солей.
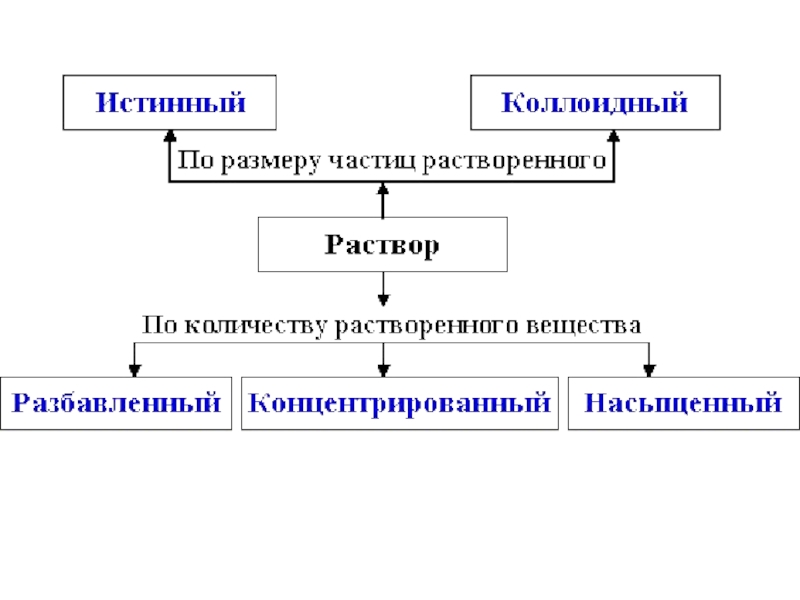
- 4. Растворимость Таблица растворимости Хорошо растворимые (более 10
- 5. 5 % водный раствор HCl 100 г
- 7. Молярная концентрация (Молярность), СМ, [моль/л] – число
- 8. , [моль/л]
- 9. Определите массу нитрата натрия, которая требуется для
- 10. Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] −
- 11. , [моль/л]
- 12. 0,75 н р-р H2SO4 или CН
- 13. Моляльная концентрация (Моляльность), Cm, [моль/кг] – число
- 14. , [моль/кг]
- 15. 2 m раствор H2SO4 2
- 16. Титр Т, [г/мл] Показывает количество г
- 17. Способы выражения концентраций растворов
- 18. Закон эквивалентов для растворов Объемы реагирующих веществ обратно пропорциональны их нормальностям:
- 19. Закон эквивалентов для растворов
- 20. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ NaCl ⇄
- 22. Константа диссоциации Кдис(СН3СООН) = 1,8⋅10–5
- 23. Электролитическая диссоциация воды где [H+], [OH–] и
- 24. Ионное произведение воды: Нейтральная среда [H+]
- 25. Водородный показатель pH = –lg[H+] [H+]
- 26. [H+] = 10–2 моль/л pH =
- 27. ГИДРОЛИЗ СОЛЕЙ 1. Гидролиз соли, образованной сильным
- 28. I ст. CO32– + H+OН– ⇄ HCO3–
- 29. 2. Гидролиз соли, образованной слабым основанием
- 30. I ст. Zn2+ + H+OН– ⇄ ZnOH+
- 31. 3. Гидролиз соли, образованной слабым основанием
- 32. Al2S3 + 6H2O ⇄ 2Al(OH)3↓ + 3H2S↑
- 33. Соль образованная сильным основанием и сильной кислотой
- 34. Совместный гидролиз двух солей Записываем
Слайд 2План лекции
Общие положения;
Способы выражения концентраций раствора;
Электролитическая диссоциация, рН раствора;
Гидролиз солей.
Слайд 4Растворимость
Таблица растворимости
Хорошо растворимые
(более 10 г в-ва в 1 л воды)
Малорастворимые
(от 0,01
Нерастворимые
(менее 0,01 г в-ва в 1 л воды)
Слайд 55 % водный раствор HCl
100 г раствора содержит 5 г HCl
95 г растворителя (воды):
5 г HCl + 95 г H2O = 100 г р-ра
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Массовая концентрация (Массовая доля), ω – число грамм растворенного вещества, содержащегося в 100 г раствора.
Слайд 7Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n,
3 М р-р NaOH
M(NaOH) = 40 г/моль
3 ⋅ 40 = 120 г
В 1 л р-ра – 120 г NaOH
Слайд 9Определите массу нитрата натрия, которая требуется для приготовления
2 л децимолярного
В 1 л раствора содержится:
СМ × МNaNO3 = 0,1 моль/л × 85 г/моль =
= 8,5 г NaNO3
Составим пропорцию:
в 1 л р-ра – 8,5 г NaNO3
в 2 л р-ра – х г NaNO3
Отсюда: х = 17 г
Слайд 10Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] − число эквивалентов растворенного вещества
0,1 н р-р H2SO4
MЭ(H2SO4) = M/осн-ть = 98/2 =
= 49 г/моль
0,1 ⋅ 49 = 4,9 г
В 1 л р-ра – 4,9 г H2SO4
Слайд 120,75 н р-р H2SO4
или CН = 0,75 моль/л р-ра H2SO4
в
или
в 1 л р-ра – 0,75 × 49 = 36,75 г H2SO4
где 49 – эквивалентная масса H2SO4.
В общем виде:
в 1 л раствора содержится СН × МЭ
в заданном V раствора содержится х г
Слайд 13Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n,
0,5 m р-р NaOH
M(NaOH) = 40 г/моль
0,5 ⋅ 40 = 20 г
В 1000 г р-ля – 20 г NaOH
1000 г H2O + 20 г NaOH = 1020 г р-ра
Слайд 152 m раствор H2SO4
2 моля приходятся на 1000 г растворителя
Cm
Слайд 16Титр Т, [г/мл]
Показывает количество г растворенного вещества m, содержащегося в
, [г/мл]
Слайд 18Закон эквивалентов для растворов
Объемы реагирующих веществ обратно пропорциональны их нормальностям:
Слайд 20ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
NaCl ⇄ Na+ + Cl–
KA ⇄ K+ + A¯
Катион
диссоциация
Степень диссоциации:
Слайд 23Электролитическая диссоциация воды
где [H+], [OH–] и [H2O] – молярные концентрации частиц
Н2О ⇄ Н+ + ОН–
Молярная концентрация воды (CM):
1 моль Н2О – 18 г
х моль Н2О – 1000 г в 1 л воды
x = 1000/18 = 55,5 моль/л
[H2O] = 55,5 моль/л
Слайд 24Ионное произведение воды:
Нейтральная среда [H+] = [OH–] = 10–7
Кислая среда
Щелочная среда [H+] < 10–7 < [OH–]
KH2O = [H+]ּ[OH–] = 10–14 моль/л
KH2O – константа воды
в чистой воде [H+] = [OH–] = 10–7 моль/л
Слайд 25Водородный показатель
pH = –lg[H+]
[H+] = 10–7
pH = –lg10–7 = 7
pH < 7 кислая среда
pH > 7 щелочная среда
Слайд 26[H+] = 10–2 моль/л pH = ?
pH = –lg[H+] =
[ОH–] = 10–4 моль/л pH = ?
[H+]ּ[OH–] = 10–14
[H+]ּ 10–4 = 10–14
[ H+] = 10–10
pH = –lg10–10 = 10 щел. ср.
Слайд 27ГИДРОЛИЗ СОЛЕЙ
1. Гидролиз соли, образованной сильным основанием и слабой кислотой.
Na2CO3 ⇄
NaOН
H2CO3
Сильное
основание
Слабая
кислота
pH > 7
Слайд 28I ст. CO32– + H+OН– ⇄ HCO3– + OН–
Na2CO3 + H2O
pH > 7
II ст. HCO3– + H+OН– ⇄ H2CO30 + OН–
NaHCO3 + H2O ⇄ H2CO3 + NaOН
pH > 7
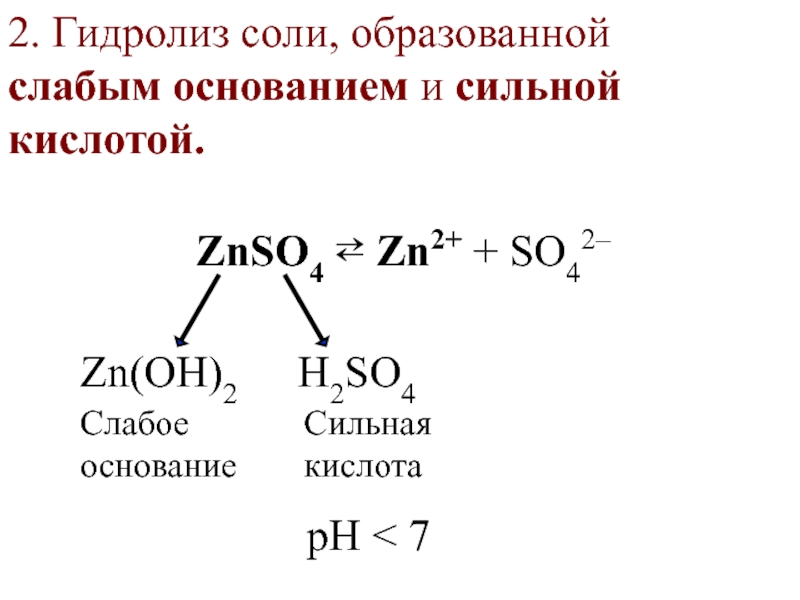
Слайд 292. Гидролиз соли, образованной
слабым основанием и сильной кислотой.
ZnSO4 ⇄ Zn2+
Zn(OН)2
H2SO4
Слабое
основание
Сильная
кислота
pH < 7
Слайд 30I ст. Zn2+ + H+OН– ⇄ ZnOH+ + Н+
2ZnSO4 + 2H2O
pH < 7
II ст. ZnOH+ + H+OН– ⇄ Zn(OH)20 + Н+
(ZnOH)2SO4 + 2H2O ⇄ 2Zn(OH)2 + H2SO4
pH < 7
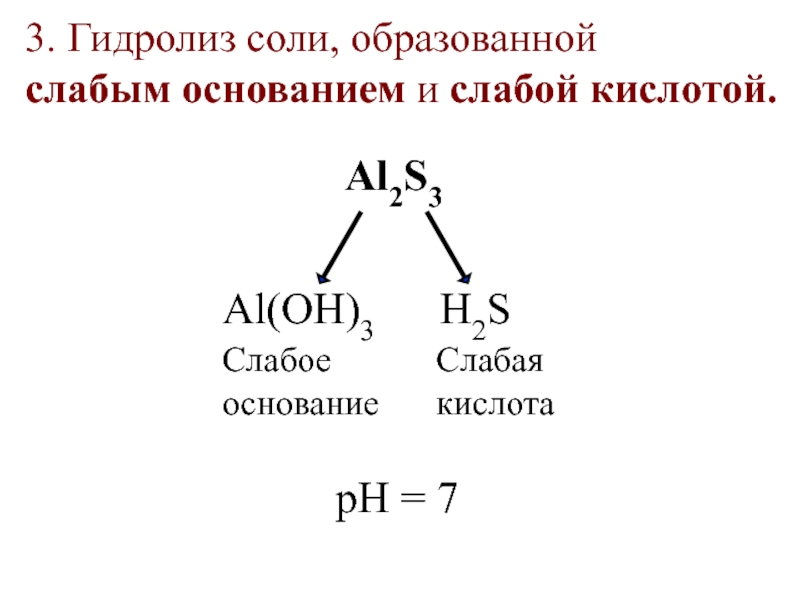
Слайд 313. Гидролиз соли, образованной
слабым основанием и слабой кислотой.
Al2S3
Al(OН)3
H2S
Слабое
основание
Слабая
кислота
pH = 7
Слайд 33Соль образованная сильным основанием и
сильной кислотой
гидролизу не подвергается
(не реагирует в водой)
NaCl + H2O ≠ гидролиз не идет
NaOH
HCl
Сильное
основание
Сильная
кислота
pH = 7
Слайд 34Совместный гидролиз двух солей
Записываем обменную реакцию между солями:
2AlCl3 + 3Na2S
AlCl3 + Na2S + H2O = …
Гидролизу подвергается только Al2S3:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Результат:
2AlCl3 + 3Na2S + 6H2O =
= 2Al(OH)3↓ + 3H2S↑ + 6NaCl




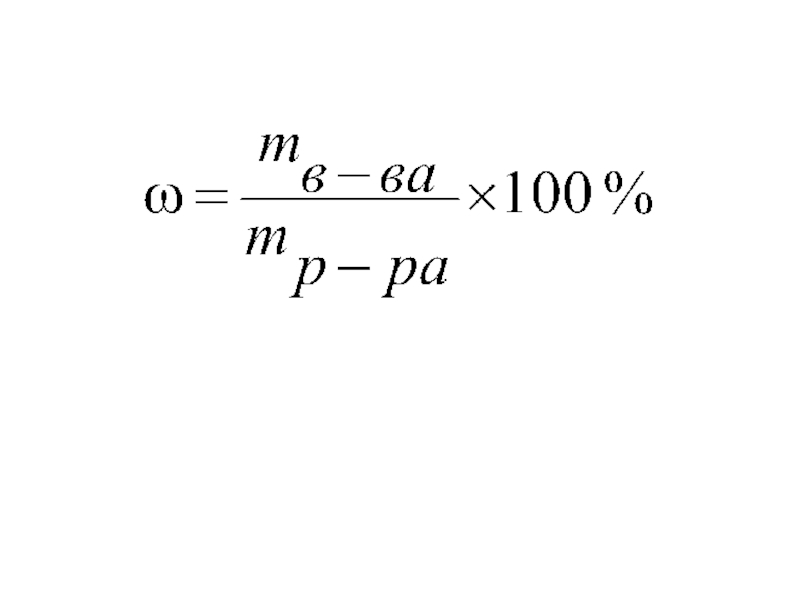
![Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1 л](/img/tmb/3/250484/4c5d6b4f13506067bc4dd0f7cfcae6d8-800x.jpg)
![, [моль/л]](/img/tmb/3/250484/0224b77fe44bfd8857706f213aabca2e-800x.jpg)

![Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] − число эквивалентов растворенного вещества nэ, содержащихся в 1](/img/tmb/3/250484/95a30ebd7e336b749ea4e9d5ffcd11c2-800x.jpg)
![, [моль/л]](/img/tmb/3/250484/b745fce871d4ae3d6f6d38fa72ca1bd9-800x.jpg)

![Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1 кг](/img/tmb/3/250484/69634713cfb009de66463acde8cd191a-800x.jpg)
![, [моль/кг]](/img/tmb/3/250484/8f823c293bab6873f5e5f7c86571035a-800x.jpg)

![Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора V:, [г/мл]](/img/tmb/3/250484/a7e0d1b27df848df21d46a714036417c-800x.jpg)






![Электролитическая диссоциация водыгде [H+], [OH–] и [H2O] – молярные концентрации частиц в воде.Н2О ⇄ Н+](/img/tmb/3/250484/081ead3976aaf61f83f662e2275519c8-800x.jpg)
![Ионное произведение воды:Нейтральная среда [H+] = [OH–] = 10–7Кислая среда [H+] > 10–7 > [OH–]Щелочная](/img/tmb/3/250484/ad7e62634039277ebf4ea0211c13711c-800x.jpg)
![Водородный показательpH = –lg[H+] [H+] = 10–7pH = –lg10–7 = 7 нейтральная средаpH < 7](/img/tmb/3/250484/3f888c65e5bd775a60087d427386afb7-800x.jpg)
![[H+] = 10–2 моль/л pH = ?pH = –lg[H+] = –lg10–2 = 2 кис. ср.[ОH–]](/img/tmb/3/250484/6277e05d742666ee25ed72d0b7ad93c7-800x.jpg)