- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы жидкие, твердые, газообразные презентация
Содержание
- 1. Растворы жидкие, твердые, газообразные
- 2. Растворами называются гомогенные системы переменного состава, состоящие
- 3. Растворы Жидкие Твердые Газообразные
- 4. По растворимости в воде вещества делятся на
- 5. Растворы бывают: Разбавленные Концентрированные Насыщенные Пересыщенные
- 6. Концентрация Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
- 7. Способы выражения концентрации растворов Массовая концентрация,
- 8. Молярная концентрация, молярность СМ (М) – число
- 9. 0,1М – децимолярный; 0,01М – сантимолярный;
- 10. В общем виде: в 1 л раствора
- 11. Эквивалентная концентрация, нормальность CН − число эквивалентов
- 12. 0,1н – децинормальный; 0,01н – сантинормальный; 0,001н
- 13. Пример. 0,75н раствор H2SO4 или CН
- 14. Моляльная концентрация, моляльность Cm – число молей
- 15. Титр Т – показывает количество граммов растворенного
- 16. Если растворы имеют разную нормальность, то применяют:
- 17. НЕФТЬ КАК ДИСПЕРСНАЯ СИСТЕМА
- 18. Дисперсные системы
- 19. Дисперсионная среда
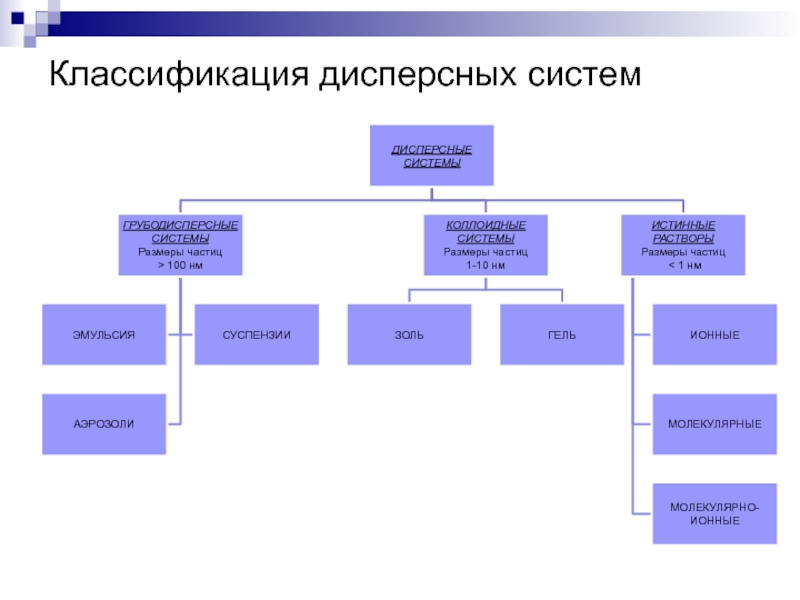
- 21. Классификация дисперсных систем
- 22. Грубодисперсные системы (взвеси)
- 23. Коллоидные растворы Золи получают дисперсионными и
- 24. Истинные растворы Молекулярные – это водные растворы
- 25. Классификация по агрегатному состоянию
- 26. Дисперсная среда: твердое вещество Дисперсная фаза –
- 27. Дисперсная среда: газ Дисперсная фаза – газ:
- 28. Дисперсная среда: жидкость Дисперсная фаза – газ:
- 29. Значение дисперсных систем Для химии наибольшее значение
- 30. Нефть - это сложная многокомпонентная смесь, которая
- 31. Особую группу коллоидных частиц образуют молекулы поверхностно-активных
- 33. Увеличение добычи нефти идет как путем освоения
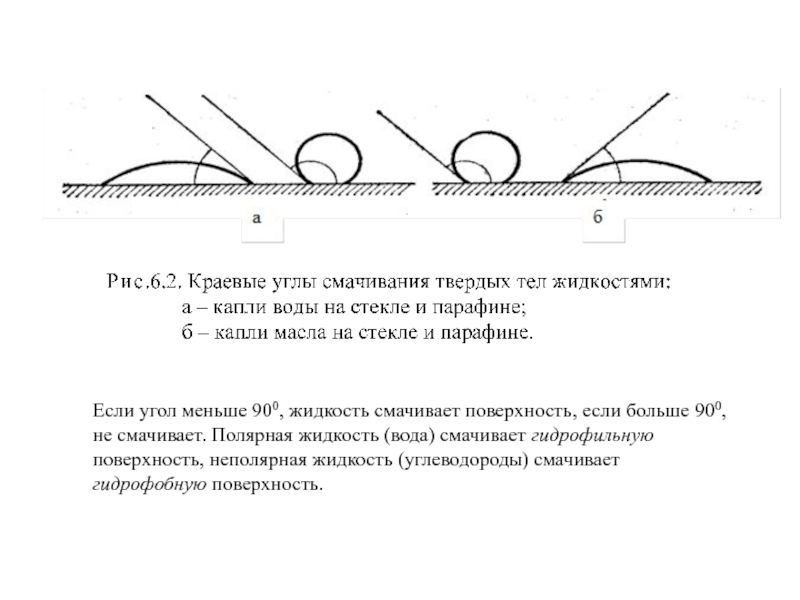
- 34. Если угол меньше 900, жидкость смачивает поверхность,
- 35. Минералы, образующие нефтяные пласты и слои горных
Слайд 2Растворами называются гомогенные системы переменного состава, состоящие из двух или более
Раствор состоит из растворенного вещества и растворителя.
Растворитель вода – водный раствор
Слайд 4По растворимости в воде вещества делятся на 3 группы:
Хорошо растворимые («р»)
Малорастворимые – «м» 0,01 – 10г на 1л воды (сульфат кальция – гипс в воде);
Практически нерастворимые – «н» менее 0,01 г.
Слайд 6Концентрация
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора
Слайд 7Способы выражения концентрации растворов
Массовая концентрация, массовая доля ω – отношение
Слайд 8Молярная концентрация, молярность СМ (М) – число молей растворенного вещества nр.в-ва,
Слайд 90,1М – децимолярный;
0,01М – сантимолярный;
0,02М – двусантимолярный;
0,001М – милимолярный.
Пример. 1,5М
СМ = 1,5 моль/л H2SO4
В 1 л раствора - 1,5 моля H2SO4
или
в 1 л раствора содержится
1,5 ∙ 98 = 147 г,
где 98 – молярная масса H2SO4
Слайд 11Эквивалентная концентрация, нормальность CН − число эквивалентов растворенного вещества nэ, содержащихся
Слайд 120,1н – децинормальный;
0,01н – сантинормальный;
0,001н – милинормальный.
Если в растворе содержится
1
то это 1Н раствор.
Один эквивалент весит эквивалентную массу.
Слайд 13Пример. 0,75н раствор H2SO4 или
CН = 0,75 моль/л H2SO4
В 1л
или
в 1 л раствора содержится
0,75 ∙ 49 = 36,75 г,
где 49 – эквивалентная масса H2SO4
В общем виде:
в 1 л раствора содержится СН ∙ МЭ
в заданном V раствора содержится Х г
Слайд 14Моляльная концентрация, моляльность Cm – число молей растворенного вещества nр.в., приходящихся
Пример. 2m раствор H2SO4
2 моля приходятся на1000 г растворителя (т.е. воды)
Cm∙Мр.в.приходятся на1000 г растворителя
Слайд 15Титр Т – показывает количество граммов растворенного вещества mр.в., содержащихся в
Сн – нормальная концентрация
Мэ – молярная масса эквивалента
растворенного вещества
Слайд 16Если растворы имеют разную нормальность, то применяют:
Закон эквивалентов для растворов:
Объемы реагирующих
V1Cн1 = V2Cн2
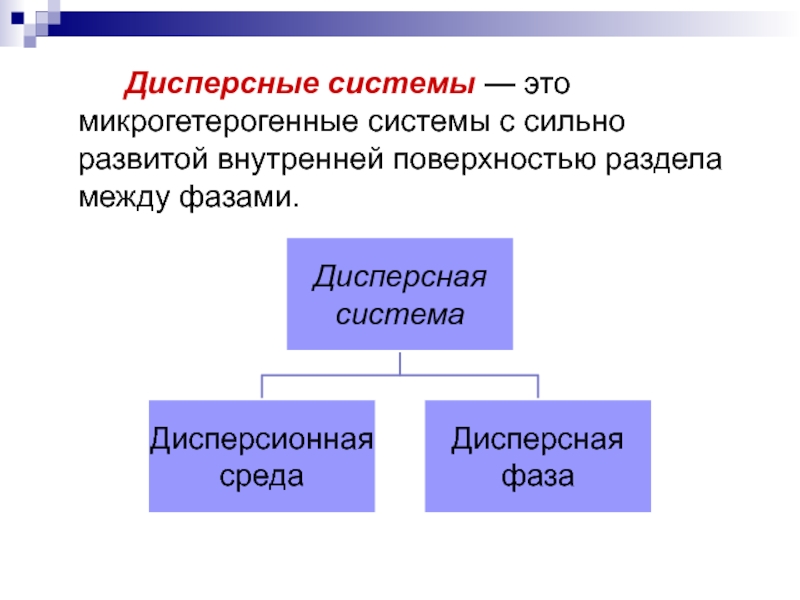
Слайд 18 Дисперсные системы — это микрогетерогенные системы
Слайд 19 Дисперсионная среда - непрерывная фаза (тело),
Дисперсная фаза - совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде.
Слайд 22Грубодисперсные системы (взвеси)
Эмульсии — это дисперсные
Суспензии — это дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, — причем твердое вещество практически нерастворимо в жидкости. Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость, в которой вещество не растворяется, и хорошо взболтать (например, взбалтывание глины в воде). Со временем частички выпадут на дно сосуда. Очевидно, чем меньше частички, тем дольше будет сохраняться суспензия.
Аэрозоли - взвеси в газе мелких частиц жидкостей или твёрдых веществ.
Слайд 23Коллоидные растворы
Золи получают дисперсионными и конденсационными методами. Диспергирование чаще всего
Гели. При определенных условиях коагуляция (явление слипания коллоидных частиц и выпадения их в осадок) золей приводит к образованию студенистой массы, называемой гелем. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое-полутвердое состояние. - желатин, желе, мармелад.
Слайд 24Истинные растворы
Молекулярные – это водные растворы неэлектролитов – органических веществ (спирта,
Ионные – это растворы сильных электролитов (щелочей, солей, кислот – NaOH, K2SO4,HNO3, HClO4);
Молекулярно – ионные – это растворы слабых электролитов (азотистой, сероводородной кислот и др.).
Слайд 25
Классификация
по агрегатному состоянию дисперсионной среды и дисперсной фазы:
Твердое вещество
Газ
Жидкость
Слайд 26Дисперсная среда: твердое вещество
Дисперсная фаза – газ:
Почва, текстильные
Дисперсная фаза – жидкость:
Влажная почва, медицинские и косметические средства.
Дисперсная фаза – твердое вещество:
Горные породы, цветные стекла, некоторые сплавы.
Слайд 27Дисперсная среда: газ
Дисперсная фаза – газ:
Всегда гомогенная смесь
Дисперсная фаза – жидкость:
Туман, попутный газ с капельками нефти, аэрозоли.
Дисперсная фаза – твердое вещество:
Пыли в воздухе, дымы, смог, песчаные бури.
Слайд 28Дисперсная среда: жидкость
Дисперсная фаза – газ:
Шипучие напитки, пены.
Дисперсная
Эмульсии: нефть, крем, молоко; жидкие среды организма, жидкое содержимое клеток.
Дисперсная фаза – твердое вещество:
Золи, гели, пасты. Строительные растворы.
Слайд 29Значение дисперсных систем
Для химии наибольшее значение имеют дисперсные системы, в которых
Природная вода всегда содержит растворённые вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений протекают в растворах.
Слайд 30Нефть - это сложная многокомпонентная смесь, которая в зависимости от внешних
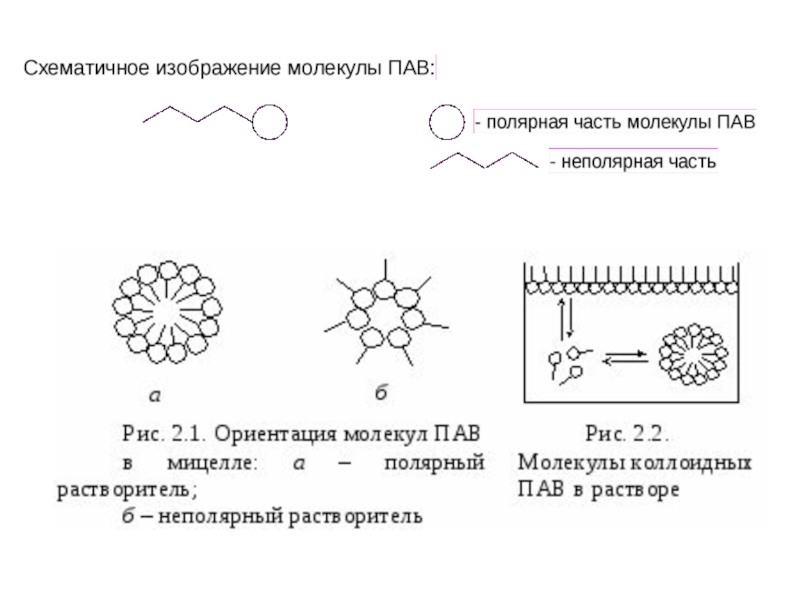
Слайд 31Особую группу коллоидных частиц образуют молекулы поверхностно-активных веществ (ПАВ). Они отличаются
Примерами ПАВ могут служить жирные кислоты, спирты, мыла. Схематически полярную группу молекул изображают кружком, а неполярную – палочкой.
На поверхности раздела полярной и неполярной жидкостей (такие жидкости не смешиваются), например воды и масла, молекулы ПАВ располагаются таким образом, что полярная часть находится в первой жидкости, а неполярная – во второй. Этим обеспечивается их более высокая «растворимость», чем в любой из жидкостей в отдельности. Это и есть одна из причин поверхностной активности ПАВ.
Слайд 33Увеличение добычи нефти идет как путем освоения новых месторождений, так и
Смачивание – процесс взаимодействия жидкости с поверхностью твердого тела. Он характеризуется краевым углом смачивания, теплотой смачивания и адгезией, т.е. силой прилипания капли к твердому телу. Краевой угол смачивания – это угол между касательной к поверхности капли, лежащей на поверхности твердого тела и плоскостью этого тела.