очистки коллоидных систем.
Основные понятия. Классификация дисперсных систем.
Коллоидная частица: строение мицеллы.
3. Методы получения коллоидных растворов.
4. Методы очистки коллоидных растворов.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5) презентация
Содержание
- 1. Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5)
- 2. 1. Основные понятия. Классификация дисперсных систем.
- 3. 1. Основные понятия. Классификация дисперсных систем. Два общих признака
- 4. 1. Основные понятия. Классификация дисперсных систем. Количественные
- 5. 1. Основные понятия. Классификация дисперсных систем. Удельная
- 6. 1. Основные понятия. Классификация дисперсных систем. Формы дисперсной фазы
- 7. 1. Основные понятия. Классификация дисперсных систем. Важным
- 8. 1. Основные понятия. Классификация дисперсных систем. Свойства дисперсных систем разных типов
- 9. 1. Основные понятия. Классификация дисперсных систем. Продолжение табл.
- 10. 1. Основные понятия. Классификация дисперсных систем. Классификация по агрегатному состоянию ДФ и ДСр
- 11. 1. Основные понятия. Классификация дисперсных систем. Классификация
- 12. 1. Основные понятия. Классификация дисперсных систем. Лиофильные
- 13. 1. Основные понятия. Классификация дисперсных систем.
- 14. 1. Основные понятия. Классификация дисперсных систем.
- 15. 1. Основные понятия. Классификация дисперсных систем.
- 16. 2. Коллоидные растворы: строение мицеллы золя
- 17. 2. Коллоидные растворы: строение мицеллы золя Рассмотрим
- 18. 2. Коллоидные растворы: строение мицеллы золя При этом образуется мицелла, имеющая следующее строение:
- 19. 2. Коллоидные растворы: строение мицеллы золя Осадок
- 20. 2. Коллоидные растворы: строение мицеллы золя Потенциалопределяющие
- 21. 2. Коллоидные растворы: строение мицеллы золя Составим
- 22. 3. Методы получения коллоидных растворов
- 23. 3. Методы получения коллоидных растворов Соотношние диспергационных и конденсационных методов
- 24. 3. Методы получения коллоидных растворов Методы
- 25. 3. Методы получения коллоидных растворов Механизм пептизации
- 26. 3. Методы получения коллоидных растворов Примером
- 27. 3. Методы получения коллоидных растворов
- 28. 3. Методы получения коллоидных растворов Конденсационные методы
- 29. 3. Методы получения коллоидных растворов
- 30. 3. Методы получения коллоидных растворов чтобы вещество
- 31. 3. Методы получения коллоидных растворов Примеры реакций химической конденсации
- 32. 4. Методы очистки коллоидных растворов Коллоидные растворы,
- 33. 4. Методы очистки коллоидных растворов Диализ
- 34. 4. Методы очистки коллоидных растворов Диализатор:
- 35. 4. Методы очистки коллоидных растворов С помощью
- 36. 4. Методы очистки коллоидных растворов По
- 37. 4. Методы очистки коллоидных растворов Для очистки
- 38. 4. Методы очистки коллоидных растворов
- 39. 4. Методы очистки коллоидных растворов Для разделения
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 5. Дисперсные системы. Способы получения и
Слайд 21. Основные понятия. Классификация дисперсных систем.
Дисперсной системой называется система, в которой
одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.
Раздробленное вещество в этом случае называется дисперсной фазой (ДФ), а среду, в которой оно распределено – дисперсионной средой (ДСр).
Раздробленное вещество в этом случае называется дисперсной фазой (ДФ), а среду, в которой оно распределено – дисперсионной средой (ДСр).
Слайд 31. Основные понятия. Классификация дисперсных систем.
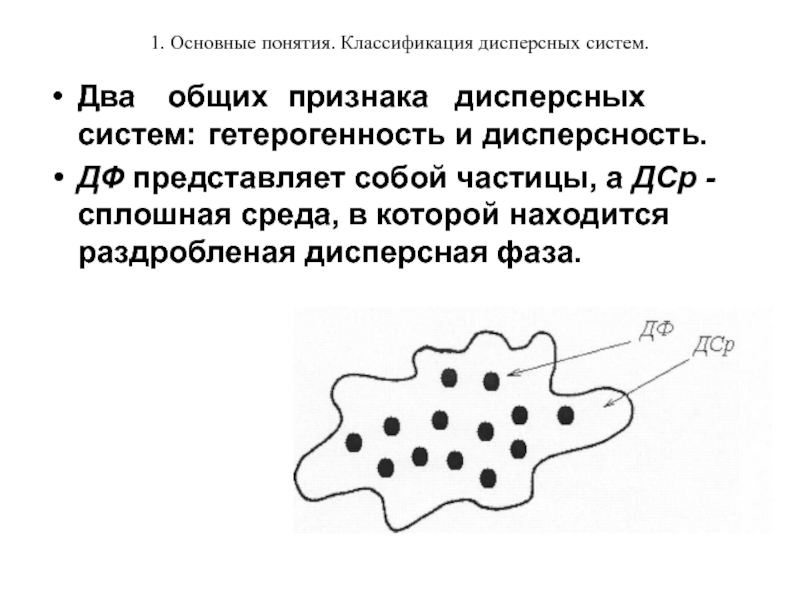
Два общих признака дисперсных систем: гетерогенность и дисперсность.
ДФ
представляет собой частицы, а ДСр - сплошная среда, в которой находится раздробленая дисперсная фаза.
Слайд 41. Основные понятия. Классификация дисперсных систем.
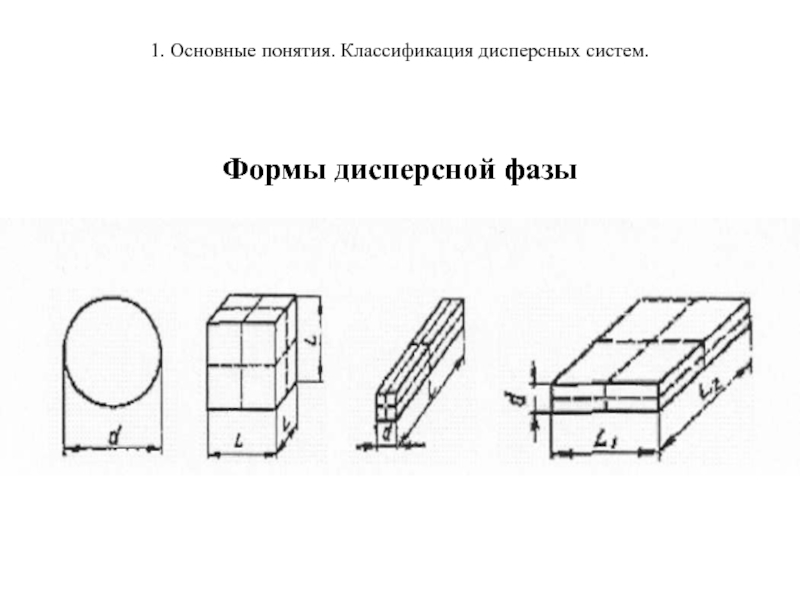
Количественные характеристики ДФ
Поперечный размер частиц ДФ
(для сферических частиц это диаметр сферы d, для кубических частиц - ребро куба l, м-1; см-1) или дисперсность (D = 1/d, м-1, см-1).
Удельная поверхность Syд - это межфазная поверхность, приходящаяся на единицу объема ДФ (V) или ее массы (т).
Удельная поверхность Syд - это межфазная поверхность, приходящаяся на единицу объема ДФ (V) или ее массы (т).
Слайд 51. Основные понятия. Классификация дисперсных систем.
Удельная поверхность
Удельная поверхность для сферической частицы
с радиусом r
Удельная поверхность для кубической частицы с ребром куба l
Удельная поверхность для кубической частицы с ребром куба l
Слайд 71. Основные понятия. Классификация дисперсных систем.
Важным свойством ДС является наличие большой
межфазной поверхности. Характерными являются процессы, протекающие на поверхности, а не внутри фазы.
Слайд 81. Основные понятия. Классификация дисперсных систем.
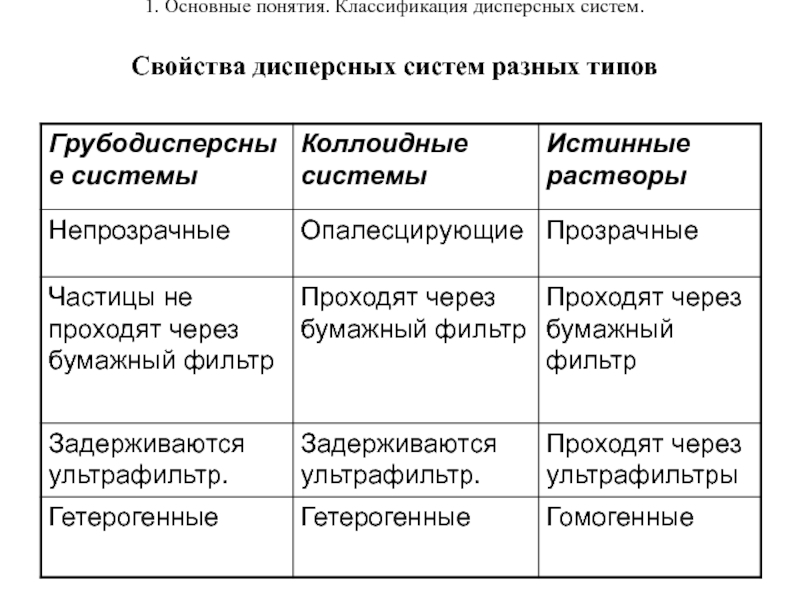
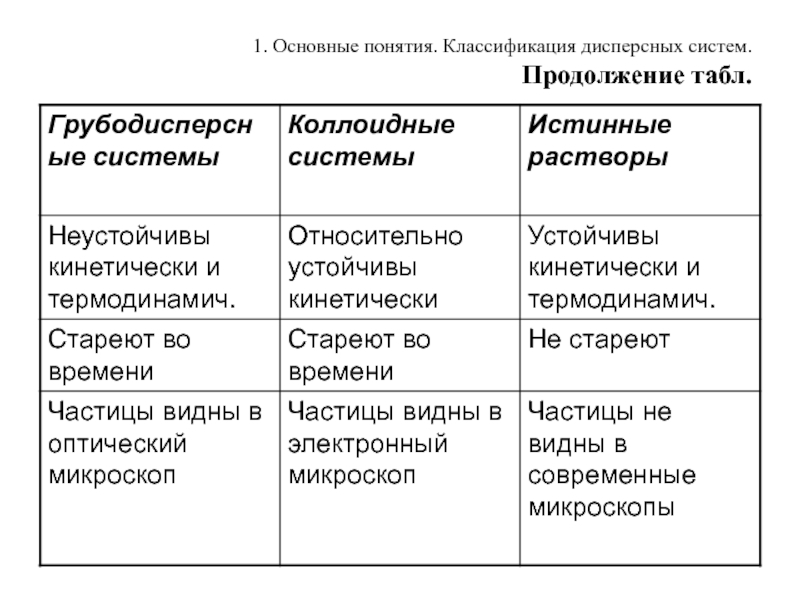
Свойства дисперсных систем разных типов
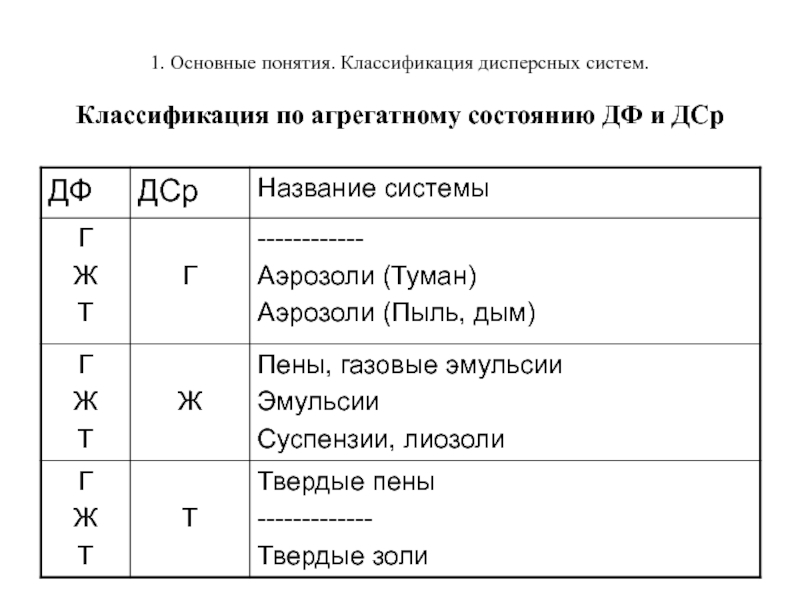
Слайд 101. Основные понятия. Классификация дисперсных систем. Классификация по агрегатному состоянию ДФ и
ДСр
Слайд 111. Основные понятия. Классификация дисперсных систем.
Классификация по степени связи ДС и
ДФ:
системы со слабым взаимодействием между ДФ и ДС называют лиофобными коллоидами (золями), с сильным взаимодействием – лиофильными.
Если ДС является вода, то системы соответственно называются гидрофобными и гидрофильными.
системы со слабым взаимодействием между ДФ и ДС называют лиофобными коллоидами (золями), с сильным взаимодействием – лиофильными.
Если ДС является вода, то системы соответственно называются гидрофобными и гидрофильными.
Слайд 121. Основные понятия. Классификация дисперсных систем.
Лиофильные системы образуются самопроизвольно, следовательно, термодинамически
устойчивы. Как правило, они представляют собой растворы полимерных органических соединений (белки, полисахариды).
Лиофобные системы являются термодинамически неустойчивыми. Они образуются из неорганических соединений (солей, оснований).
Лиофобные системы являются термодинамически неустойчивыми. Они образуются из неорганических соединений (солей, оснований).
Слайд 131. Основные понятия. Классификация дисперсных систем.
Классификация по взаимодействию частиц:
Свободнодисперсные (бесструктурные);
Связаннодисперсные (структурированные).
Золь
– бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются друг относительно друга (например, золь серебра – колларгол). По внешнему виду золи напоминают истинные растворы.
Слайд 141. Основные понятия. Классификация дисперсных систем.
Гель – структурированный коллоидный
раствор, в котором частицы ДФ связаны между собой с образованием пространственной структуры типа каркасов. В них коллоидные частицы малоподвижны и способны совершать только колебательные движения. По внешнему виду гели желеобразны.
Слайд 151. Основные понятия. Классификация дисперсных систем.
Особое место в классификации
ДС занимают ВМС.
По многим свойствам их можно отнести к истинным растворам: они гомогенны, устойчивы, обратимы.
Однако размеры молекул ВМС настолько велики, что соизмеримы с размерами коллоидных частиц, что обуславливает проявление свойств коллоидных растворов: малая скорость диффузии, характерные кинетические и электрокинетические свойства, структурообразование и т.д.
По многим свойствам их можно отнести к истинным растворам: они гомогенны, устойчивы, обратимы.
Однако размеры молекул ВМС настолько велики, что соизмеримы с размерами коллоидных частиц, что обуславливает проявление свойств коллоидных растворов: малая скорость диффузии, характерные кинетические и электрокинетические свойства, структурообразование и т.д.
Слайд 162. Коллоидные растворы: строение мицеллы золя
Согласно общепринятой мицеллярной
теории строения коллоидных растворов, золь состоит из двух частей:
Мицелл - частиц ДФ. Они имеют сложную структуру, которая зависит от условий получения золей.
Интермицеллярной (т. е. межмицеллярной) жидкости - ДСр, разделяющей мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
Мицелл - частиц ДФ. Они имеют сложную структуру, которая зависит от условий получения золей.
Интермицеллярной (т. е. межмицеллярной) жидкости - ДСр, разделяющей мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
Слайд 172. Коллоидные растворы: строение мицеллы золя
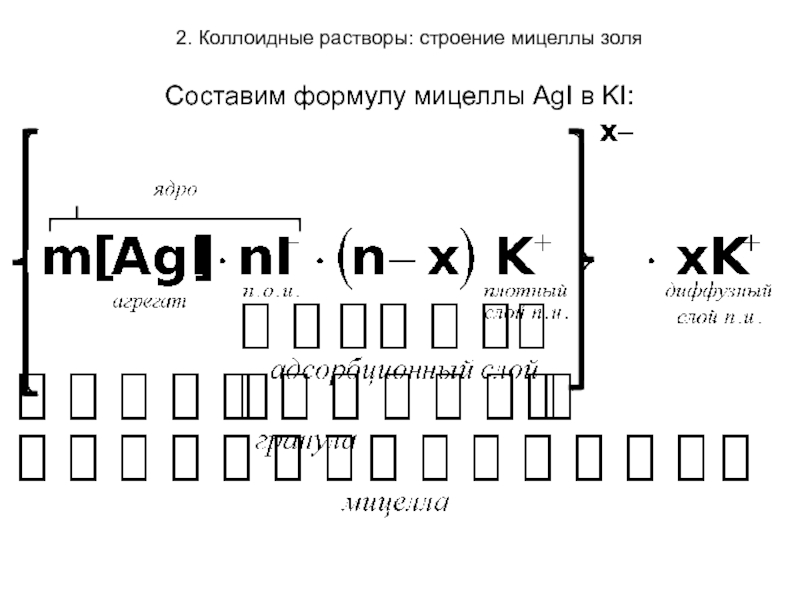
Рассмотрим строение мицеллы на примере образования
золя иодида серебра при взаимодействии
KI(избыток) + AgN03 → AgI↓ + KN03
(стабилизатор)
KI(избыток) + AgN03 → AgI↓ + KN03
(стабилизатор)
Слайд 182. Коллоидные растворы: строение мицеллы золя
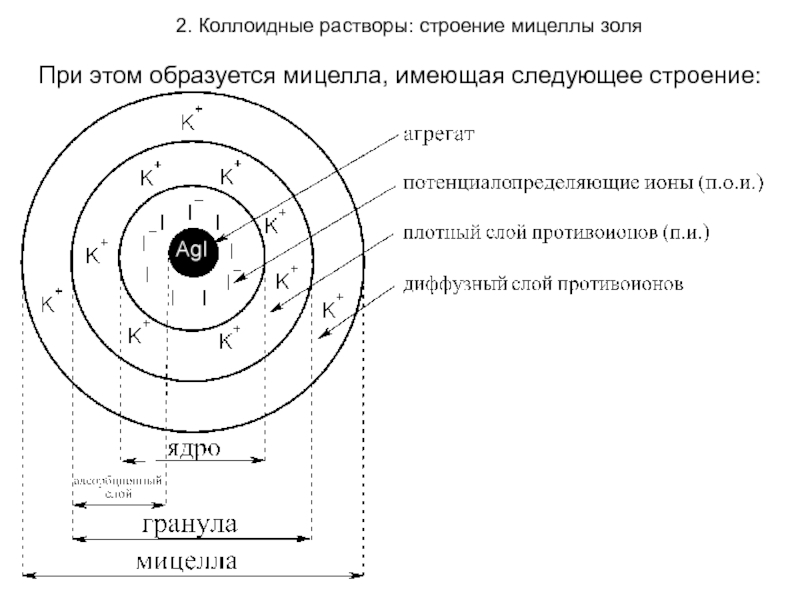
При этом образуется мицелла, имеющая следующее
строение:
Слайд 192. Коллоидные растворы: строение мицеллы золя
Осадок AgI является агрегатом мицеллы.
На твердой
кристаллической поверхности осадка в соответствии с правилом Панета-Фаянса будут адсорбироваться ионы I-, достраивая кристаллическую решетку и сообщая частицам отрицательный заряд.
Ионы I- называются потенциалопределяющими.
Агрегат и потенциалопределяющие ионы составляют
ядро мицеллы.
К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов.
Ионы I- называются потенциалопределяющими.
Агрегат и потенциалопределяющие ионы составляют
ядро мицеллы.
К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов.
Слайд 202. Коллоидные растворы: строение мицеллы золя
Потенциалопределяющие ионы и противоионы плотного слоя
вместе образуют адсорбционный слой.
Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся знаком и величиной заряда потенциалопределяющих ионов.
Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой.
Гранула и диффузный слой составляют мицеллу.
Мицелла таким образом электронейтральна.
Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся знаком и величиной заряда потенциалопределяющих ионов.
Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой.
Гранула и диффузный слой составляют мицеллу.
Мицелла таким образом электронейтральна.
Слайд 22
3. Методы получения коллоидных растворов
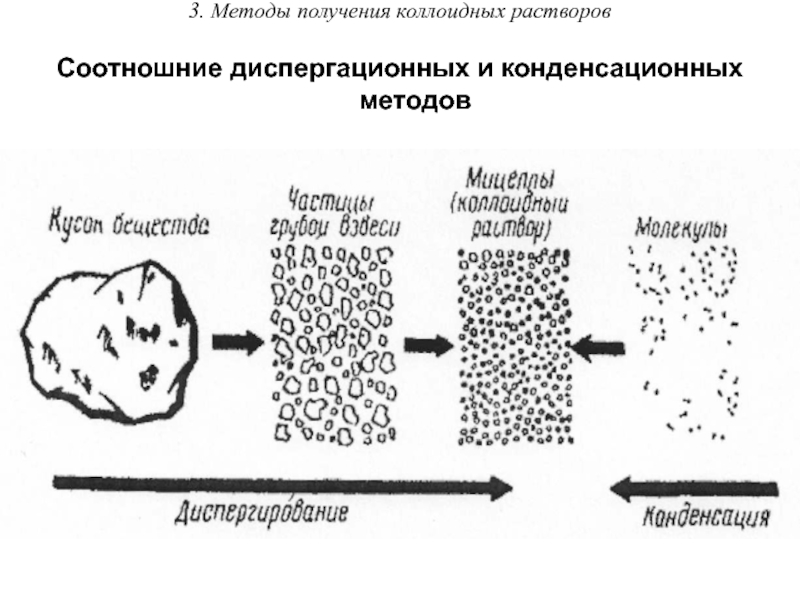
Коллоидные системы занимают промежуточное положение между истинными
растворами и грубодисперсными системами, что обусловливает возможность их получения диспергированием крупных частичек или конденсацией молекул. Соответственно методы получения коллоидных систем делят на диспергационные и конденсационные.
Слайд 233. Методы получения коллоидных растворов
Соотношние диспергационных и конденсационных методов
Слайд 243. Методы получения коллоидных растворов
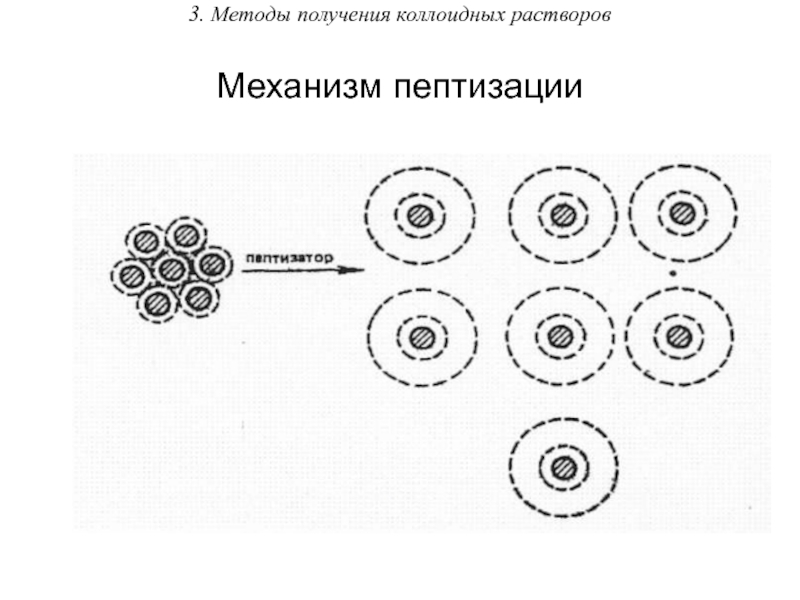
Методы диспергирования (от лат. – измельчать) –
получение частиц ДФ путем дробления крупных частиц на более мелкие. Применяют механическое дробление (с помощью шаровых или коллоидных мельниц), ультразвуковое (под действием ультразвука), электрическое (при использовании электродов) и химическое диспергирование – пептизация (заключается в химическом воздействии на осадок).
Слайд 263. Методы получения коллоидных растворов
Примером пептизации может служить переход в золь
свежеполученного и промытого водой осадка гидроксида железа(III) при добавлении к нему небольших количеств раствора хлорида железа(III).
При этом частицы осадка Fe(OH)3 избирательно адсорбируют ионы Fe3+, которые сообщают частицам положительный электрический заряд. Вследствие этого между частицами возникают силы электростатического отталкивания и они переходят во взвешенное состояние – золь.
При этом частицы осадка Fe(OH)3 избирательно адсорбируют ионы Fe3+, которые сообщают частицам положительный электрический заряд. Вследствие этого между частицами возникают силы электростатического отталкивания и они переходят во взвешенное состояние – золь.
Слайд 273. Методы получения коллоидных растворов
Строение мицеллы полученного золя можно
представить следующим образом
{m[Fe(OH)3] ∙ nFe3+ ∙ 3(n-x)Cl-}3x+ ∙ 3xCl-
{m[Fe(OH)3] ∙ nFe3+ ∙ 3(n-x)Cl-}3x+ ∙ 3xCl-
Слайд 283. Методы получения коллоидных растворов
Конденсационные методы (от лат. – укрупнять) –
получение частиц ДФ путем объединения атомов, молекул, ионов. Различают физическую и химическую конденсацию.
Физическая конденсация - чаще всего это метод замены растворителя. Сначала готовят истинный раствор вещества в летучем растворителе (например, канифоль в спирте) и добавляют к жидкости, в которой вещество нерастворимо (вода). В результате происходит резкое понижение растворимости и молекулы вещества конденсируются в частицы коллоидных размеров.
Физическая конденсация - чаще всего это метод замены растворителя. Сначала готовят истинный раствор вещества в летучем растворителе (например, канифоль в спирте) и добавляют к жидкости, в которой вещество нерастворимо (вода). В результате происходит резкое понижение растворимости и молекулы вещества конденсируются в частицы коллоидных размеров.
Слайд 293. Методы получения коллоидных растворов
Химическая конденсация – для получения
коллоидных растворов используют любые реакции, в результате которых образуются малорастворимые соединения (реакции обмена, гидролиза, восстановления и др.).
Чтобы в ходе реакции образовался коллоидный раствор, а не истинный раствор или осадок, необходимо соблюдение, по крайней мере, трех условий:
Чтобы в ходе реакции образовался коллоидный раствор, а не истинный раствор или осадок, необходимо соблюдение, по крайней мере, трех условий:
Слайд 303. Методы получения коллоидных растворов
чтобы вещество ДФ было нерастворимо в ДСр;
чтобы
скорость образования зародышей кристаллов ДФ была гораздо больше, чем скорость роста кристаллов; это условие выполняется обычно тог да, когда концентрированный раствор одного компонента вливается в сильно разбавленный раствор другого компонента при интенсивном перемешивании;
чтобы одно из исходных веществ было взято в избытке, именно оно является стабилизатором.
чтобы одно из исходных веществ было взято в избытке, именно оно является стабилизатором.
Слайд 324. Методы очистки коллоидных растворов
Коллоидные растворы, как и истинные, хорошо фильтруются
через бумажный пористый фильтр, но, в отличие от истинных, не проходят через полупроницаемые мембраны. На этом основана очистка коллоидных растворов от низкомолекулярных веществ (диализ, фильтрация, ультрацентрифугирование).
Слайд 334. Методы очистки коллоидных растворов
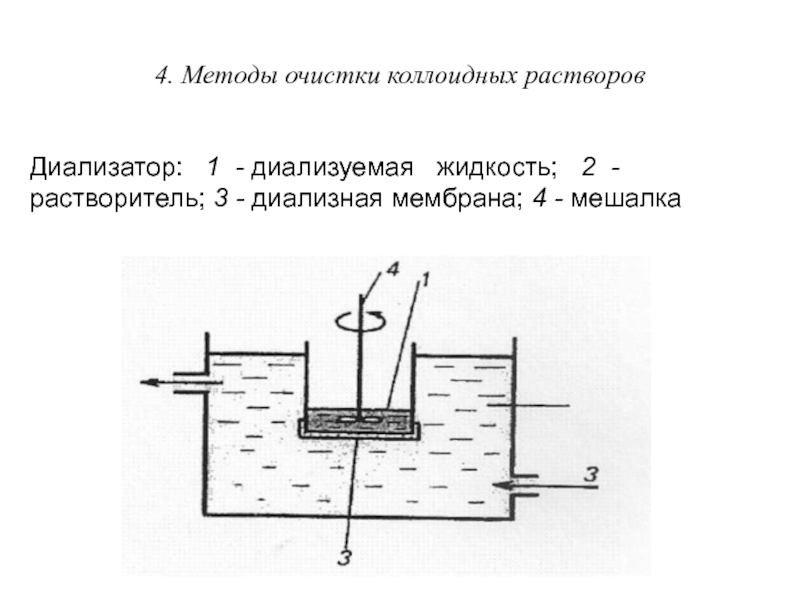
Диализ проводят с помощью прибора - диализатора.
Он состоит из двух сосудов, отделенных полупроницаемой мембраной, способной пропускать молекулы и ионы низкомолекулярных веществ. Во внутренний сосуд наливается раствор золя, во внешнем – циркулирует растворитель (как правило, вода). Примеси удаляются через мембрану из раствора золя в растворитель.
Для ускорения процесса применяют электродиализ.
Для ускорения процесса применяют электродиализ.
Слайд 344. Методы очистки коллоидных растворов
Диализатор: 1 - диализуемая жидкость;
2 -растворитель; 3 - диализная мембрана; 4 - мешалка
Слайд 354. Методы очистки коллоидных растворов
С помощью компенсационного диализа можно количественно определить
содержание низкомолекулярных веществ в биологических жидкостях. Сущность этого вида диализа заключается в том, что жидкость в диализаторе омывается не чистым растворителем, а растворами с различной концентрацией определяемого вещества. Концентрация низкомолекулярного вещества во внешнем растворе при диализе не меняется лишь в том случае, если она равна концентрации этого вещества в растворе золя.
Слайд 364. Методы очистки коллоидных растворов
По принципу компенсационного диализа работает аппарат «искусственная
почка», применяемый при ОПН.
Аппарат подключают к системе кровообращения больного, кровь под давлением протекает между двумя мембранами, омываемыми снаружи физраствором. При этом токсичные вещества поступают в физраствор, что способствует очищению крови от продуктов обмена и распада тканей (мочевины, креатина, ионов калия и др.).
Аппарат подключают к системе кровообращения больного, кровь под давлением протекает между двумя мембранами, омываемыми снаружи физраствором. При этом токсичные вещества поступают в физраствор, что способствует очищению крови от продуктов обмена и распада тканей (мочевины, креатина, ионов калия и др.).
Слайд 374. Методы очистки коллоидных растворов
Для очистки коллоидных растворов от грубодисперсных частиц
проводят фильтрование через обычные бумажные фильтры. Грубодисперсные частицы задерживаются на фильтре.
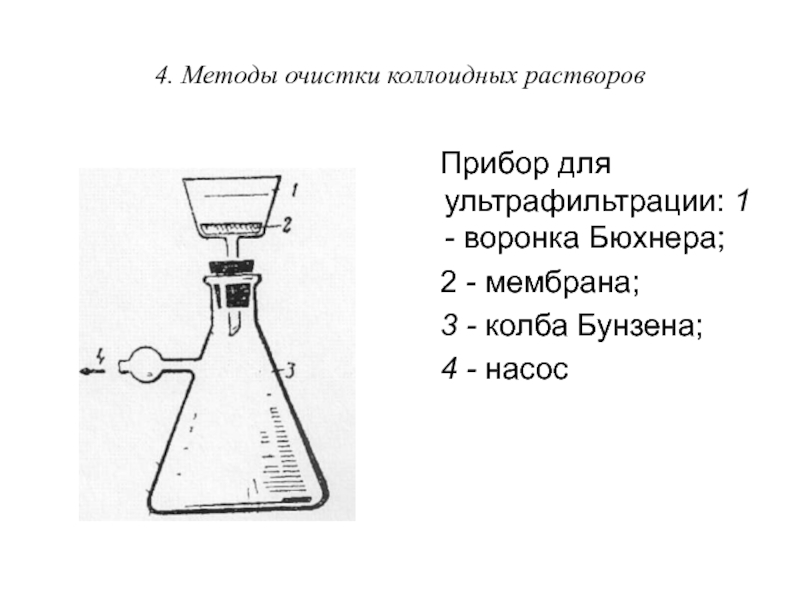
Для отделения ДФ от ДСр, применяют ультрафильтрацию. При этом используют специальные фильтры, не пропускающие коллоидные частицы или макромолекулы. Как правило, ультрафильтрацию проводят под давлением.
Для отделения ДФ от ДСр, применяют ультрафильтрацию. При этом используют специальные фильтры, не пропускающие коллоидные частицы или макромолекулы. Как правило, ультрафильтрацию проводят под давлением.
Слайд 384. Методы очистки коллоидных растворов
Прибор для ультрафильтрации: 1 -
воронка Бюхнера;
2 - мембрана;
3 - колба Бунзена;
4 - насос
2 - мембрана;
3 - колба Бунзена;
4 - насос
Слайд 394. Методы очистки коллоидных растворов
Для разделения частиц ДФ, имеющих различную массу,
применяют ультрацентрифугирование. При этом разделение частиц происходит в центробежном поле больших ускорений в центрифугах. Так, разделяют фракции белков.

















![3. Методы получения коллоидных растворов Строение мицеллы полученного золя можно представить следующим образом{m[Fe(OH)3] ∙](/img/tmb/3/262833/90f5fddda0184046a5150fec19bc32ec-800x.jpg)