- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Свойства растворов не электролитов и электролитов презентация
Содержание
- 1. Растворы. Свойства растворов не электролитов и электролитов
- 2. Растворы – это макроскопически однородные смеси двух
- 3. Пример: Вода – это растворитель, если
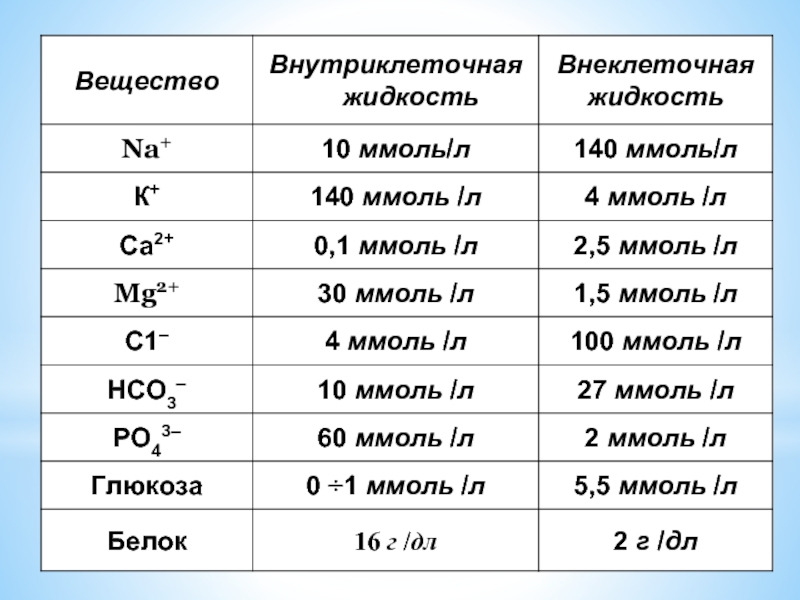
- 4. Содержание и распределение воды в организме человека
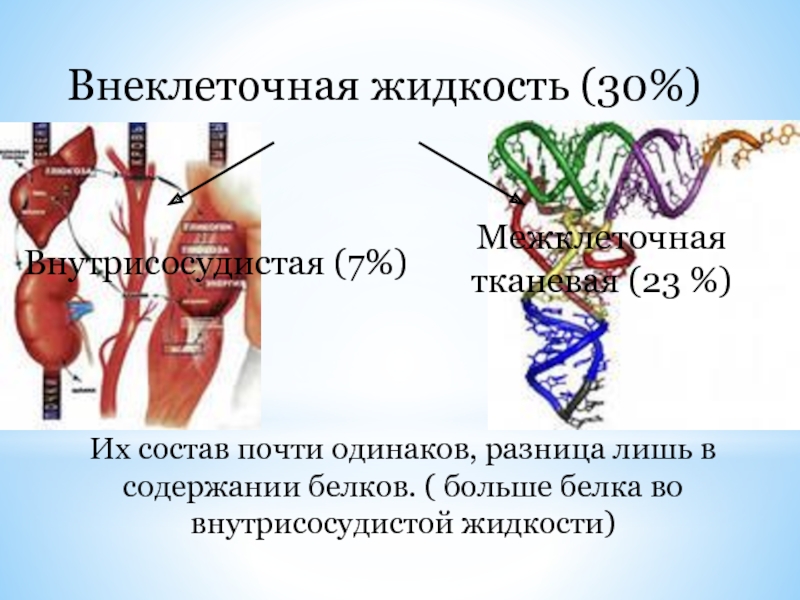
- 6. Внеклеточная жидкость (30%) Внутрисосудистая (7%) Межклеточная
- 7. В биохимических процессах вода выступает как : Растворитель Реагент Продукт реакции
- 8. Вода- универсальный растворитель Существование межмолекулярных водородных связей
- 9. Н2О – универсальный растворитель,
- 10. «Вода! У тебя нет ни вкуса, ни
- 11. Термодинамика процесса растворения Растворение – процесс самопроизвольный,
- 12. Энергетическая характеристика растворения ∆Н растворения =
- 13. 1. Если |∆Н ф. п. |>
- 14. Энтропийная характеристика растворения ∆Sрастворения = ∆S
- 15. 2. Рассмотрим растворение газообразного вещества в воде.
- 16. Реальные и идеальные растворы ∆Н р-ния
- 17. Коллигативные свойства растворов осмотическое давление 2. понижение
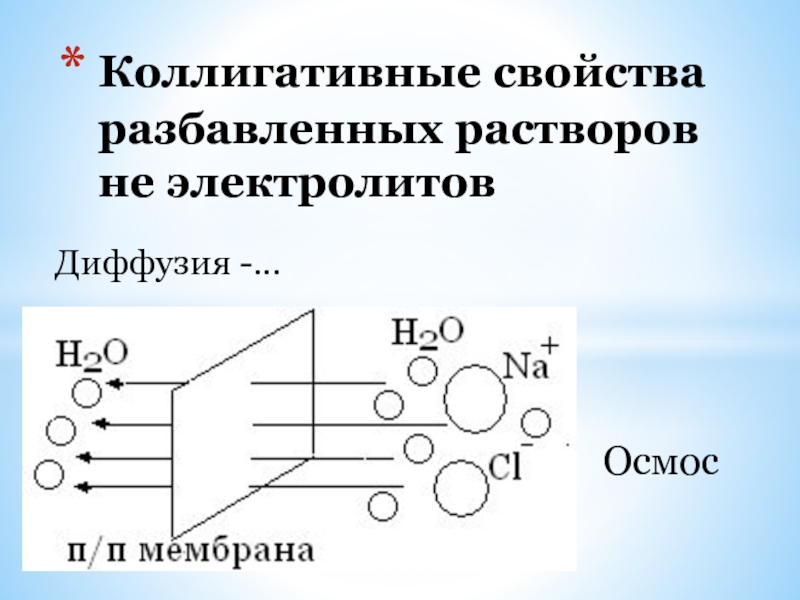
- 18. Коллигативные свойства разбавленных растворов не электролитов Диффузия -… Осмос
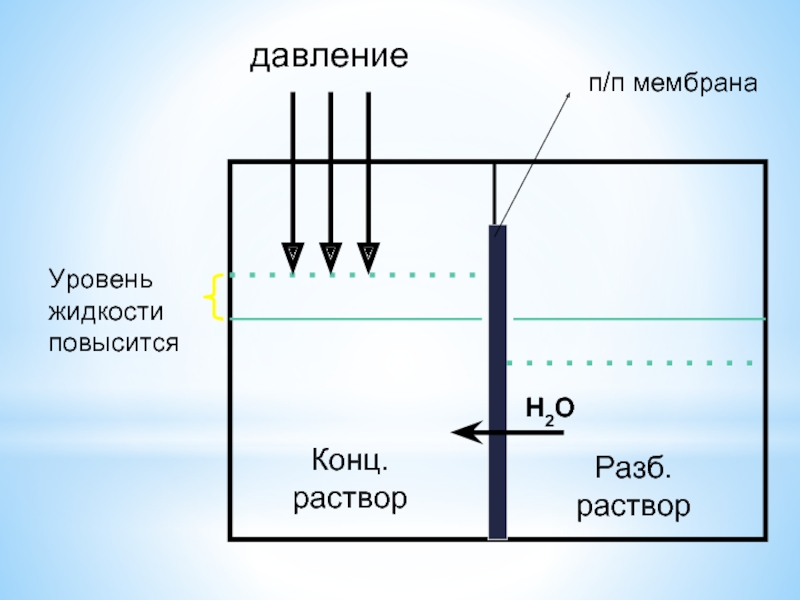
- 19. Конц. раствор Разб. раствор
- 20. В 1886 г. Вант-Гофф экспериментально установил, что
- 21. РVгаза= nRT уравнение Менделеева-Клапейрона.
- 22. Закон Вант-Гоффа: «Осмотическое давление раствора равно тому
- 23. распределение воды между внутриклеточной жидкостью и внеклеточной
- 24. Для плазмы крови осмоляльность = 292 ммоль/кг.
- 25. Форменные элементы крови на Росм. не влияют.
- 26. Эритроциты в условиях нарушения изотоничности среды Росм
- 27. Если раствор имеет Росм одинаковое с клеткой,
- 28. II. Давление насыщенного пара растворителя испарение
- 29. конденсация Vиспарения = Vконденсации Насыщенный пар Р0
- 30. Р0 – Р = ΔР ;
- 31. Температура кипения и температура замерзания растворителя и раствора
- 32. t0 t ∆ t кип t0 t ∆ t зам.
- 33. Е- эбулиоскопическая постоянная, К- криоскопическая постоянная,
- 34. Криометрия, эбулиометрия
- 35. Коллигативные свойства разбавленных растворов электролитов Росм =
- 36. В 1887 г. Вант-Гофф ввел изотонический коэффициент
- 37. Электролитами называются вещества, которые в растворе или
- 38. В 1887г. шведский учёный С. Аррениус для
- 39. 1.Молекулы электролитов при растворении или расплавлении распадаются
- 40. 2. Ионы движутся хаотически, а при пропускании
- 41. 3. Диссоциация - процесс обратимый. Наряду с
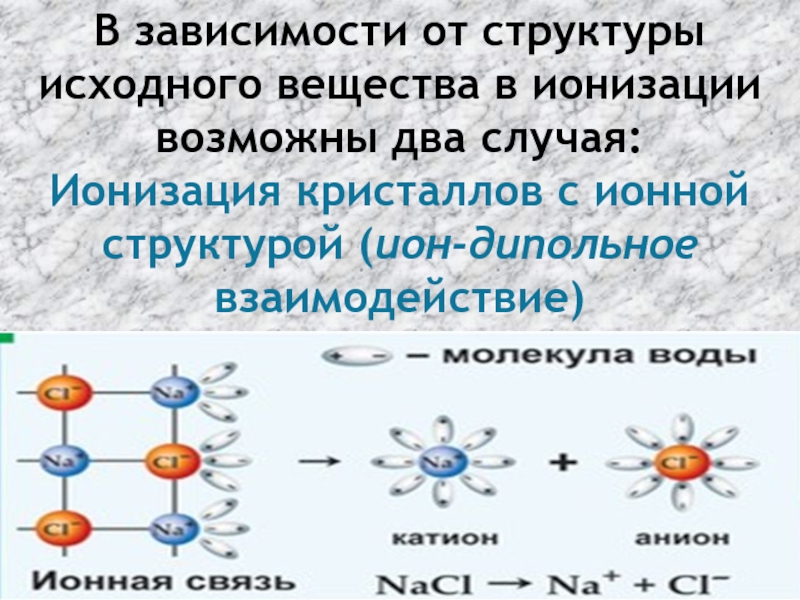
- 42. В зависимости от структуры исходного вещества в
- 43. Ионизация соединений, состоящих из полярных молекул (
- 44. Теория Аррениуса не учитывала влияние растворителя на
- 45. Образование гидратных (сальватных) оболочек способствует уменьшению электростатического
- 46.
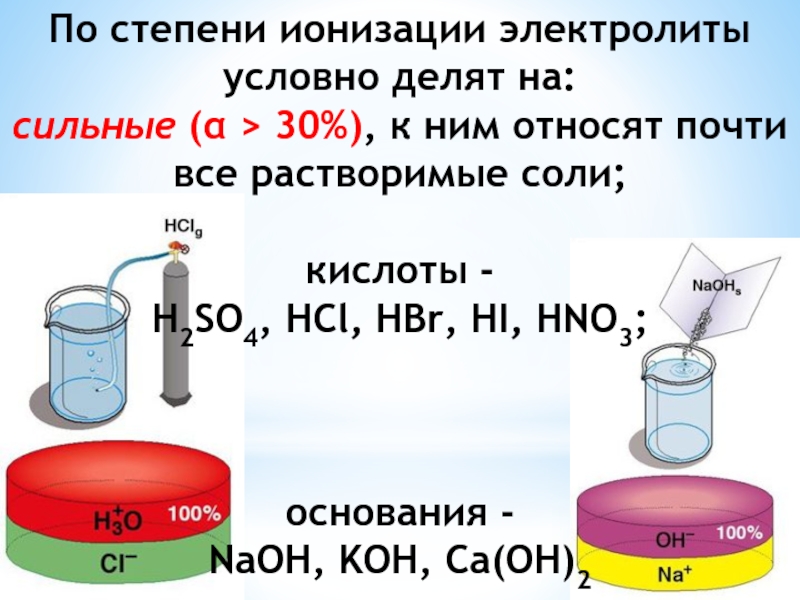
- 47. По степени ионизации электролиты условно делят на:
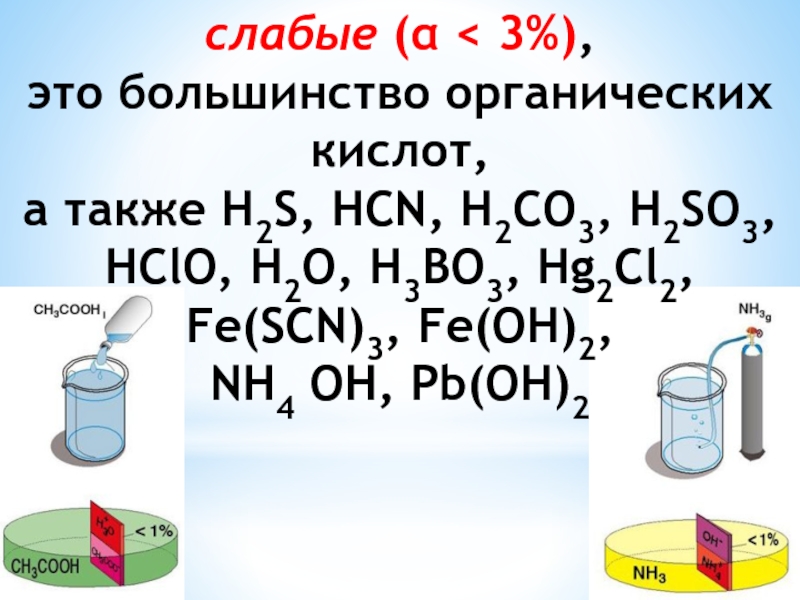
- 48. cлабые (α < 3%), это большинство
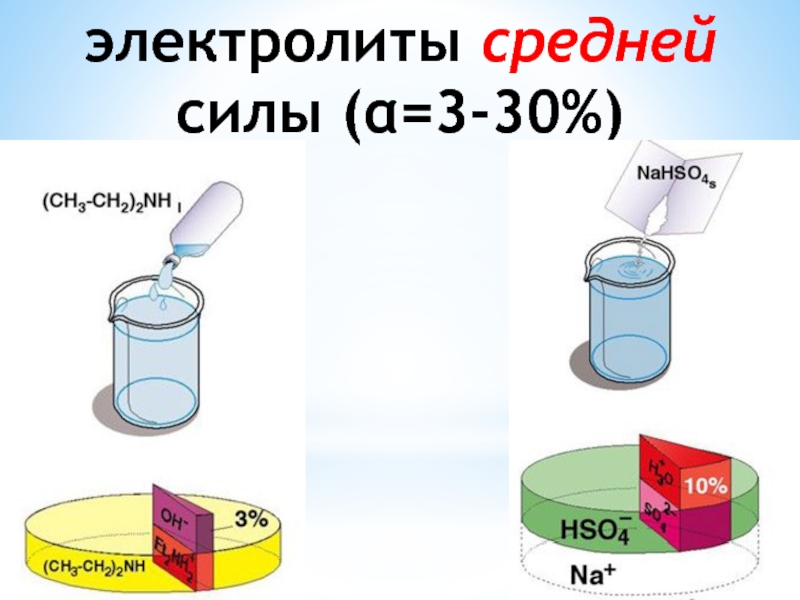
- 49. электролиты средней силы (α=3-30%)
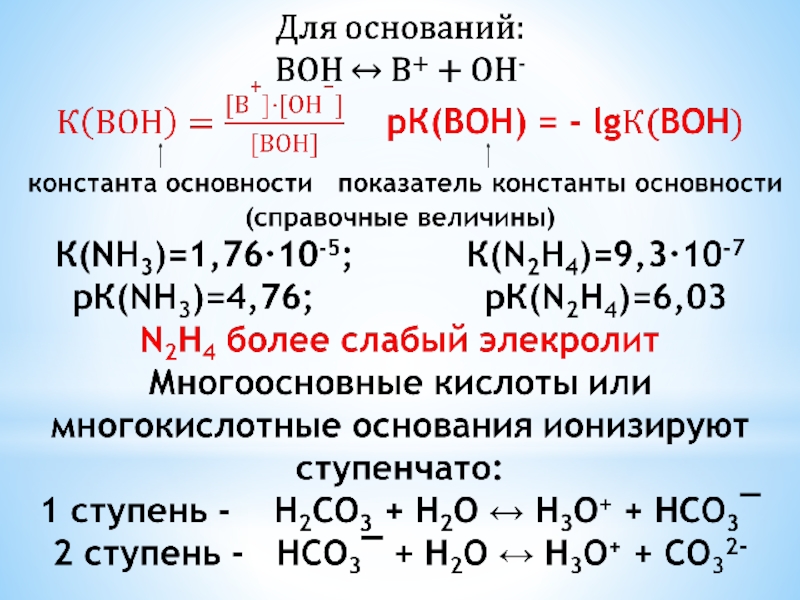
- 51. На степень электролитической диссоциации влияют: ТЕМПЕРАТУРА: для
- 52. ДОБАВЛЕНИЕ ОДНОИМЕННОГО ИОНА:
- 53.
- 54.
- 55. Суммарное уравнение: H2CO3 + 2H2O ↔ 2H3O+
- 56.
- 57. Эта формула отражает закон Оствальда: степень диссоциации
- 58. ТЕОРИЯ ВОДНЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ сформулирована в
- 59. 2. В мало разбавленных растворах сильных электролитов
- 60. Каждый ион электролита окружен противоположно заряженными
- 61. Вследствие этого снижается эффективность ионов в таких
- 62. Таким образом, можно считать, что во всех
- 63. Активность – эффективная концентрация электролита, в соответствии
- 64. В идеальных растворах а =
- 65.
- 66. Количественной характеристикой межионных электростатических взаимодействий является ионная
- 67. Таким образом, при большой концентрации раствора силы
- 68. Спасибо за внимание!
Слайд 2Растворы – это макроскопически однородные смеси двух или большего числа веществ
Растворитель – это…
Растворенное вещество -
Слайд 3Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или
Слайд 4Содержание и распределение воды в организме человека
~ 60 % от общей
70% всей воды организма внутриклеточная
30% - внеклеточная
Их состав сильно отличается :
Слайд 6Внеклеточная жидкость (30%)
Внутрисосудистая (7%)
Межклеточная тканевая (23 %)
Их состав почти одинаков, разница
Слайд 8Вода- универсальный растворитель
Существование межмолекулярных водородных связей определяет аномальные физические свойства воды:
1.
2. Высокая температура кипения
3. Большая теплота испарения
4. Высокое поверхностное натяжение
5. Низкая вязкость
6. Более высокая плотность в жидком состоянии, чем в твердом .
7. Высокая диэлектрическая проницаемость (ε = 80)
Слайд 9
Н2О – универсальный растворитель, наличие аномальных свойств ее играет важную физиологическую
Слайд 10«Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя
Слайд 11Термодинамика процесса растворения
Растворение – процесс самопроизвольный, поэтому ∆Gрастворения < 0.
∆Gрастворения
Слайд 12Энергетическая характеристика растворения
∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации
1.
> 0
Разрушение к.р. –эндотермический процесс
< 0
Образование хим. связи –экзотермический процесс
Слайд 13
1. Если |∆Н ф. п. |> |∆Н гидр. |,
то
2. Если |∆Н ф. п. |<|∆Н гидр. |,
то ∆Н растворения < 0, экзо-процесс, раствор нагревается (NaOH )
Т.о. при растворении тв./ж.
0 < ∆ Н растворения < 0
Слайд 14Энтропийная характеристика растворения
∆Sрастворения = ∆S фаз. перехода + ∆S гидратации
>>
< 0,
т.к. уменьшается число частиц в единице объёма
Т.о., |∆S ф. п. |> |∆S гидр. |, поэтому ∆Sрастворения тв. вещ-в > 0
Слайд 152. Рассмотрим растворение газообразного вещества в воде.
Обычно ∆Sрастворения газов
∆Нрастворения=∆G растворения + Т ∆Sрастворения
∆Gраств. < 0 и ∆Sраств. < 0 ;
∆Н растворения газов < 0
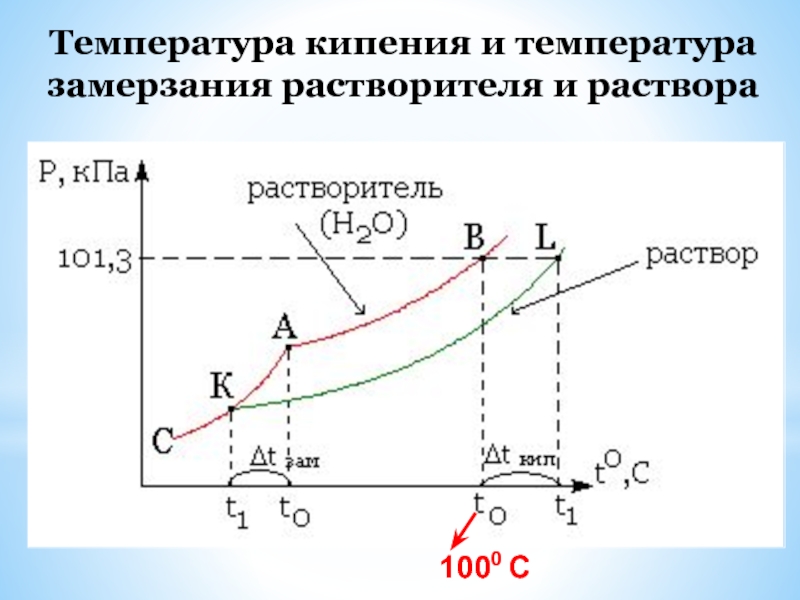
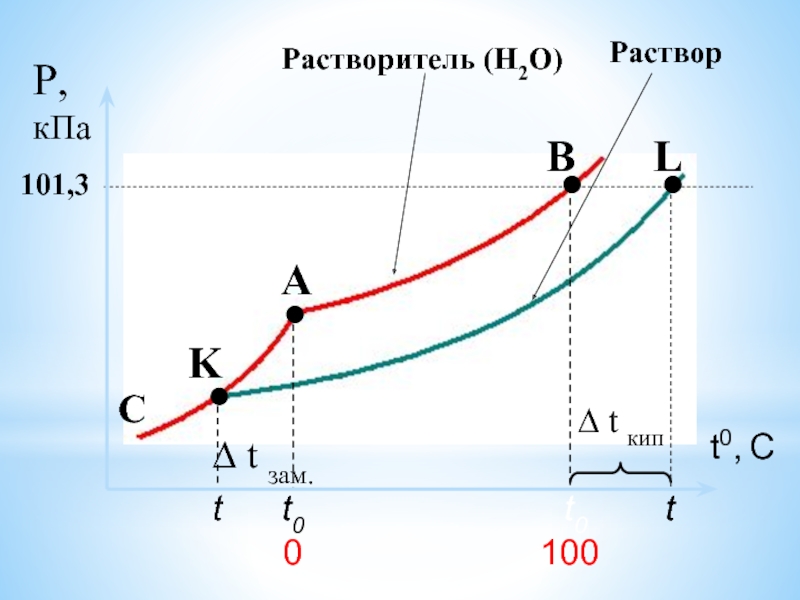
Слайд 17Коллигативные свойства растворов
осмотическое давление
2. понижение давления насыщенного пара растворителя над раствором
3. повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя
4. понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
Слайд 20В 1886 г. Вант-Гофф экспериментально установил, что
Р осм. =СМRT – уравнение
1м3 = 1000 л; 1Па =10-3 кПа
СМ= моль/л, Росм.= кПа.
Слайд 22Закон Вант-Гоффа: «Осмотическое давление раствора равно тому давлению, которое оказывало бы
Пример: 1 моль/л раствор С6Н12О6 . Чему равно Росм?
чем ↑ М, тем ↓ Р осм. (белки)
Слайд 23распределение воды между внутриклеточной жидкостью и внеклеточной
распределение воды между сосудистым
Осмос и осмотические явления в биологических системах
Осмолярность - … моль/л
Осмоляльность - … моль/ кг р-ля (определяется криометрией)
Слайд 24Для плазмы крови осмоляльность = 292 ммоль/кг. Она обусловлена:
1. низкомолекулярными веществами-электролитами:
2. низкомолекулярными веществами не электролитами: глюкоза, мочевина.
3. ВМС – белки.
Слайд 25Форменные элементы крови на Росм. не влияют.
Р осм. внутри и
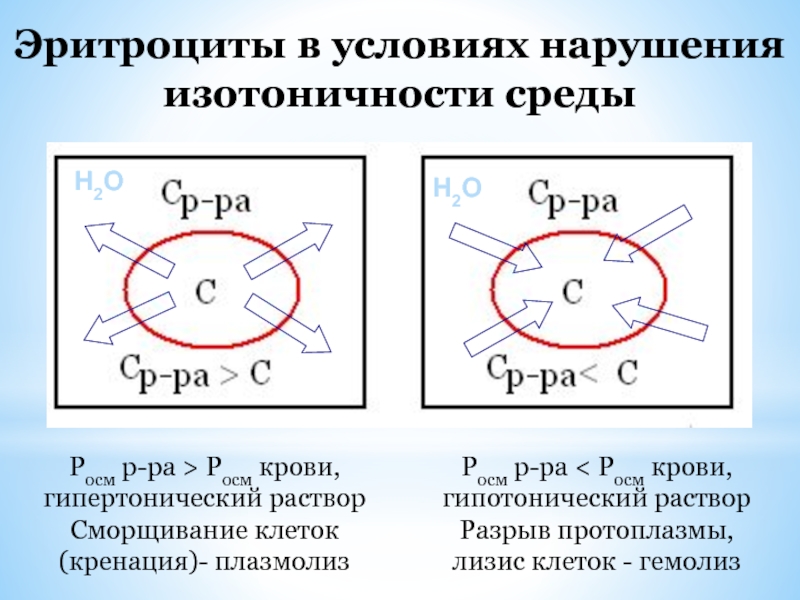
Слайд 26Эритроциты в условиях нарушения изотоничности среды
Росм р-ра > Росм крови, гипертонический
Сморщивание клеток (кренация)- плазмолиз
Росм р-ра < Росм крови, гипотонический раствор
Разрыв протоплазмы, лизис клеток - гемолиз
Слайд 27Если раствор имеет Росм одинаковое с клеткой, то это изотонический раствор.
Это 0,85-0,9 % (0,15 моль/л) NaCl ;
5% (0,3 моль/л) С6Н12О6
Физиологический раствор:
р-р Рингера- Локка - в 1л:
глюкоза 1,0 г , NaCl 9,0 г , КCl о,2 г
солевой инфузин и др.
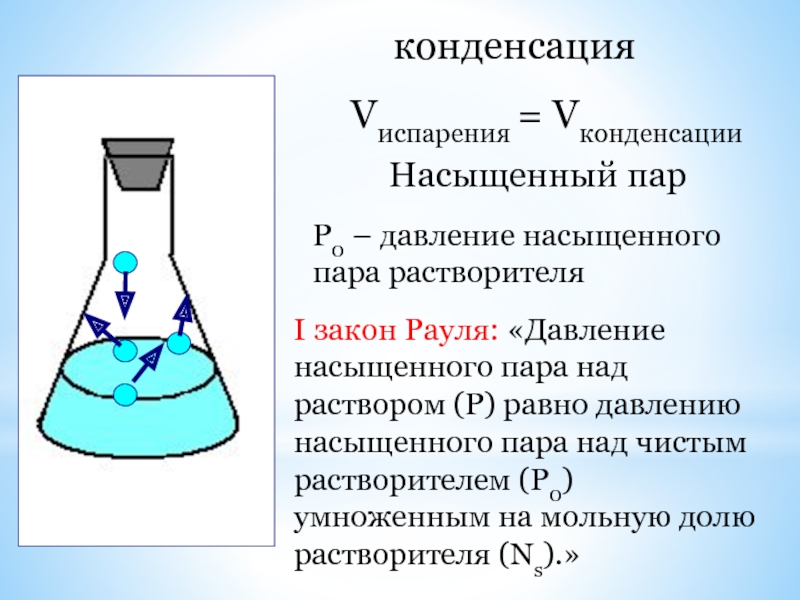
Слайд 29конденсация
Vиспарения = Vконденсации
Насыщенный пар
Р0 – давление насыщенного пара растворителя
I закон Рауля:
Слайд 30
Р0 – Р = ΔР ; ΔР- абсолютное понижение давления
Р = Р0 Ns
относительное понижение давления нас. пара над раствором.
NS + Ni= 1, NS =1- Ni
P = P0(1- Ni) = P0 - P0 Ni; P0 – P = P0 Ni ;
ΔР=Р0 N i
Слайд 33Е- эбулиоскопическая постоянная,
К- криоскопическая постоянная,
Сm- моляльность раствора.
Для Н2О:
К=1,86 кг⋅град / моль.
Слайд 35Коллигативные свойства разбавленных растворов электролитов
Росм = См ⋅ R ⋅ T
P
ΔТкип.=Е⋅ Сm
ΔТзам.=К⋅ Сm
Только для р-ров неэлектролитов
Слайд 36В 1887 г. Вант-Гофф ввел изотонический коэффициент – i (i>1)
Росм
P = i ⋅ P0⋅ Ns
ΔТкип.= i ⋅ Е ⋅ Сm
ΔТзам.= i ⋅ К ⋅ Сm
i= α (n-1) + 1
Слайд 37Электролитами называются вещества, которые в растворе или в расплаве
частично или полностью
Слайд 38В 1887г. шведский учёный
С. Аррениус для объяснения
особенностей водных растворов
веществ предложил
электролитической диссоциации.
Сванте
Аррениус
Слайд 391.Молекулы электролитов при растворении или расплавлении распадаются на ионы (+) и
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией или ионизацией.
Слайд 402. Ионы движутся хаотически, а при пропускании электролитического тока (+) заряженные
а (-) заряженные частицы(An) - к (+) заряженному электроду аноду
(Cl-; SO3²-; Cr2O7²-; H2PO4-; HCO3-).
Слайд 413. Диссоциация - процесс обратимый. Наряду с ионизацией - распадом молекул
Na2SO4 ↔ 2Na+ + SO4²-
4. Общая сумма зарядов (Kat) равна общей сумме зарядов (An) и противоположна по знаку.
Слайд 42В зависимости от структуры исходного вещества в ионизации возможны два случая:
Ионизация
Слайд 43Ионизация соединений, состоящих из полярных молекул ( HCl; HNO3; NaOH и
Слайд 44Теория Аррениуса не учитывала влияние растворителя на процесс ионизации.
Д. И.
и И. А. Каблуков
дополнили теорию электролитической диссоциации: роль растворителя заключается не только в поляризации и разделении ионов противоположного знака, а также и в молизации, т.к. в результате диссоциации образуются не свободные ионы, а гидратированные (H2O) или сальватированные (с другим растворителем).
Слайд 45Образование гидратных (сальватных) оболочек способствует уменьшению электростатического взаимодействия ионов. Ослабление этого
гексан -1,9 не обладают диссоциирующей способностью.
Слайд 47По степени ионизации электролиты условно делят на:
сильные (α > 30%),
кислоты -
H2SO4, HCl, HBr, HI, HNO3;
основания -
NaOH, KOH, Ca(OH)2
Слайд 48cлабые (α < 3%),
это большинство органических кислот,
а также H2S,
NH4 OH, Pb(OH)2
Слайд 51На степень электролитической диссоциации влияют:
ТЕМПЕРАТУРА: для эндотермических процессов (∆H > 0)
КОНЦЕНТРАЦИЯ РАСТВОРА: при разбавлении растворов α значительно возрастает.
Слайд 52ДОБАВЛЕНИЕ ОДНОИМЕННОГО ИОНА:
CH3COOH ↔ CH3OO¯ +
Например, введение сильного электролита
CH3COONa ↔ CH3COO¯ + Na+ способствует увеличению концентрации CH3COO¯- иона,
приводящему к сдвигу равновесия в лево, уменьшению α.
Слайд 55Суммарное уравнение:
H2CO3 + 2H2O ↔ 2H3O+ + CO32-
Ксум = К1·К2
Распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей К1>К2>К3 (для трехосновной Н3РО4).
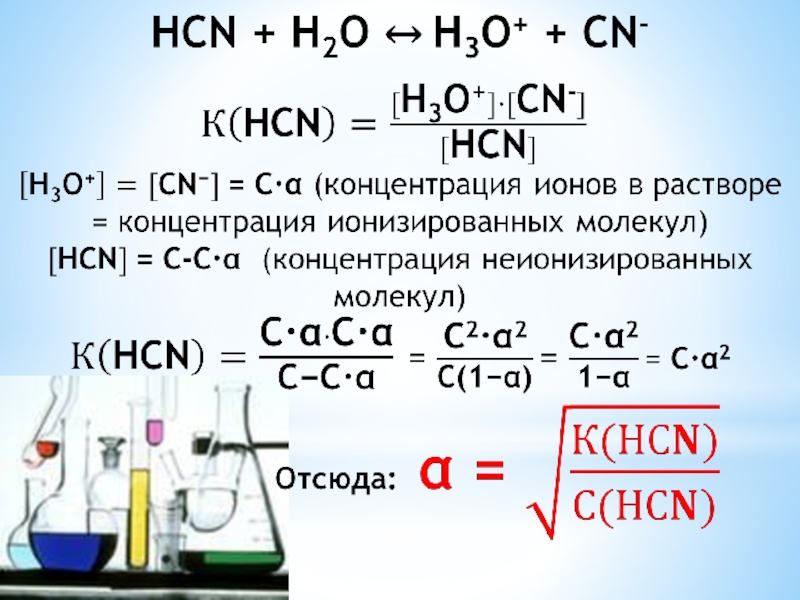
Зная константу ионизации электролита, можно рассчитать степень ионизации.
Слайд 57Эта формула отражает закон Оствальда: степень диссоциации слабого электролита возрастает с
Слайд 58ТЕОРИЯ ВОДНЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ сформулирована в 1923году Дебаем и Хюккелем:
1.
Слайд 592. В мало разбавленных растворах сильных электролитов среднее расстояние между ионами
3. В растворах сильных электролитов ионы не совсем свободны: движение их
стеснено взаимным притяжением друг к другу.
Слайд 60Каждый ион электролита окружен
противоположно заряженными ионами,
получившими название
«ИОННОЙ АТМОСФЕРЫ»,
тормозит движение ионов и влияет
на степень ионизации.
α является кажущейся, т.к. она не
соответствует действительной
степени распада электролита на
ионы из-за образования ионной
атмосферы , ионных пар (дуплетов),
триплетов.
Слайд 61Вследствие этого снижается эффективность ионов в таких явлениях, как перенос заряда
Слайд 62Таким образом, можно считать, что во всех процессах участвуют лишь «активные
Слайд 63Активность – эффективная концентрация электролита, в соответствии с которой он участвует
а(х) = f(х) ∙ C(x) (моль/л)
f (x) – коэффициент активности, который показывает отклонение свойств реальных растворов от идеальных.
Слайд 64В идеальных растворах
а = С, а в реальных С
криометрическим, осмометрическим, электрохимическим
методом, а также можно рассчитать.
Слайд 66Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора - величина
µ=1/2[C(x1)∙Z2(x1)+ C(x2)∙Z2(x2)+…]
Слайд 67Таким образом, при большой концентрации раствора силы межионного взаимодействия увеличиваются, µ
У слабых электролитов отсутствует «ионная атмосфера» и межионные электростатические взаимодействия, поэтому они в расчет не берутся.