- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Общая характеристика растворов презентация
Содержание
- 1. Растворы. Общая характеристика растворов
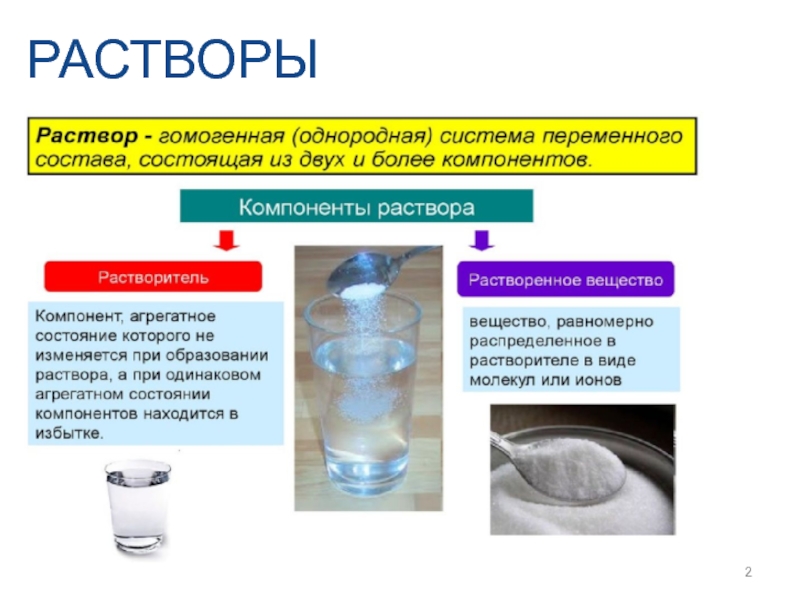
- 2. РАСТВОРЫ
- 3. 1. По агрегатному состоянию – жидкие, твердые
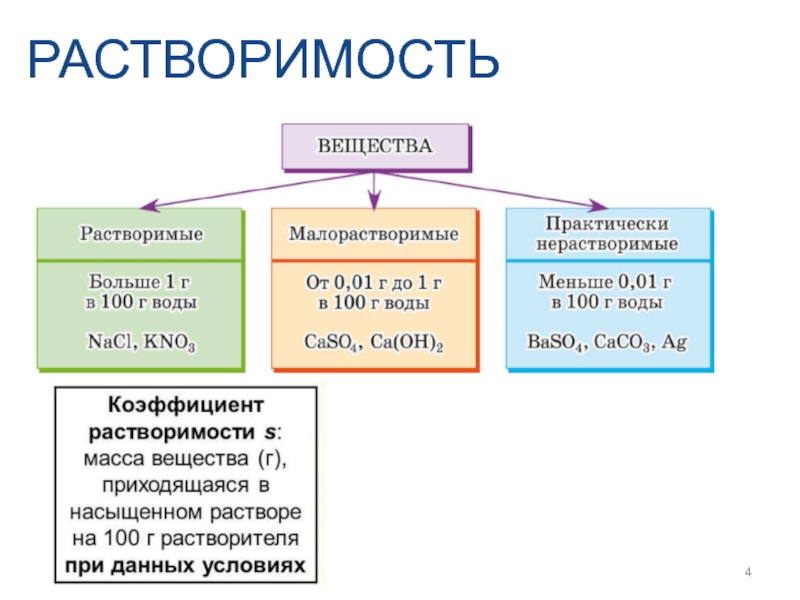
- 4. РАСТВОРИМОСТЬ
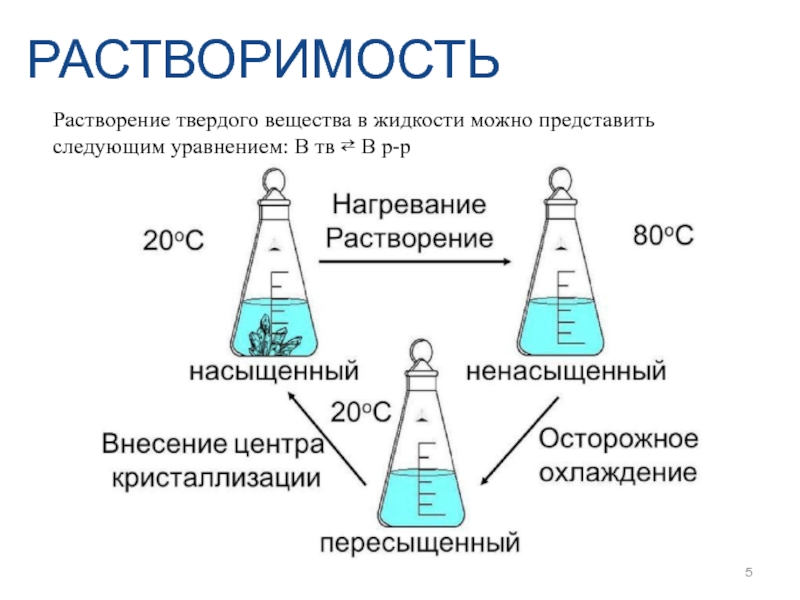
- 5. РАСТВОРИМОСТЬ Растворение твердого вещества в жидкости можно
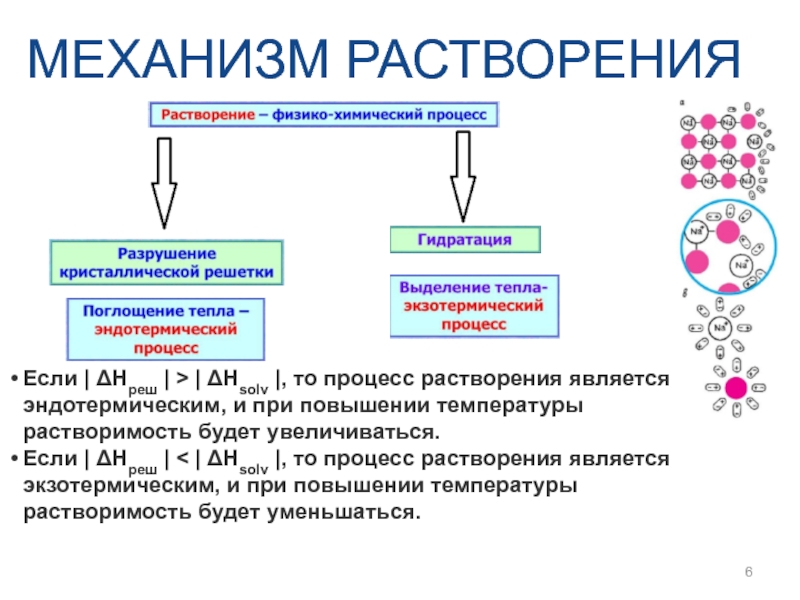
- 6. МЕХАНИЗМ РАСТВОРЕНИЯ Если | ΔHреш | >
- 7. КОНЦЕНТРАЦИЯ РАСТВОРОВ - порядок реакции
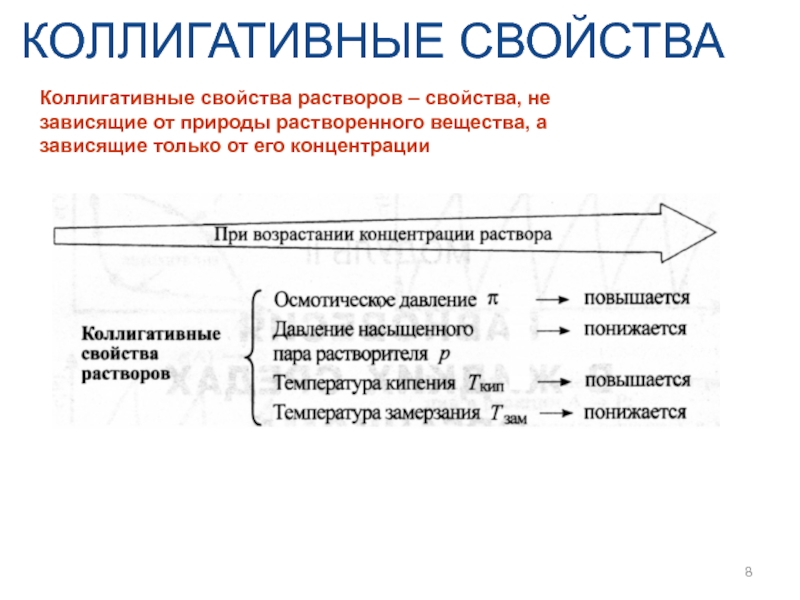
- 8. КОЛЛИГАТИВНЫЕ СВОЙСТВА Коллигативные свойства растворов – свойства,
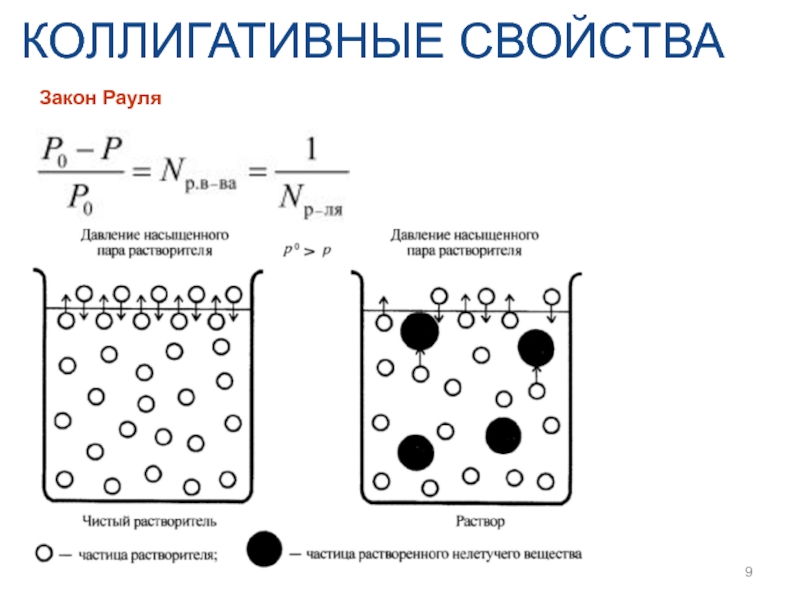
- 9. КОЛЛИГАТИВНЫЕ СВОЙСТВА Закон Рауля
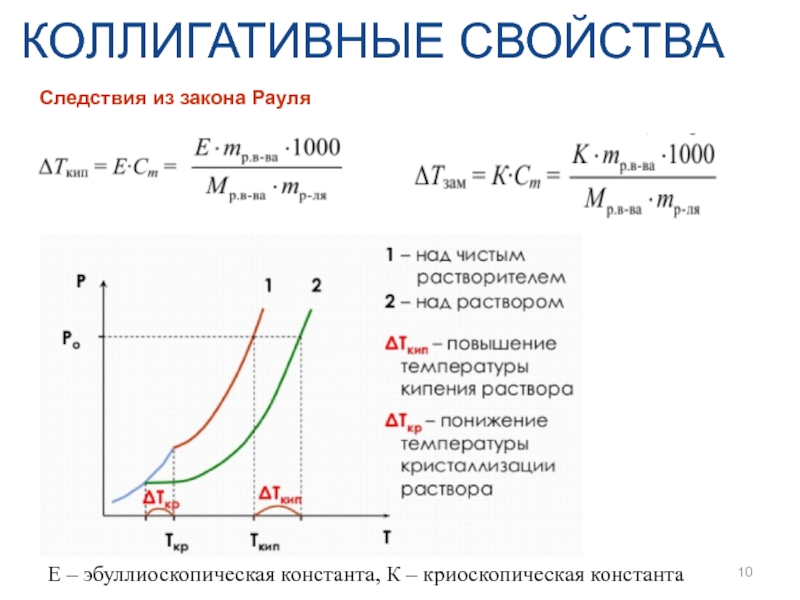
- 10. КОЛЛИГАТИВНЫЕ СВОЙСТВА Следствия из закона Рауля E – эбуллиоскопическая константа, К – криоскопическая константа
- 11. КОЛЛИГАТИВНЫЕ СВОЙСТВА
- 12. КОЛЛИГАТИВНЫЕ СВОЙСТВА Уравнения применимы только к растворам
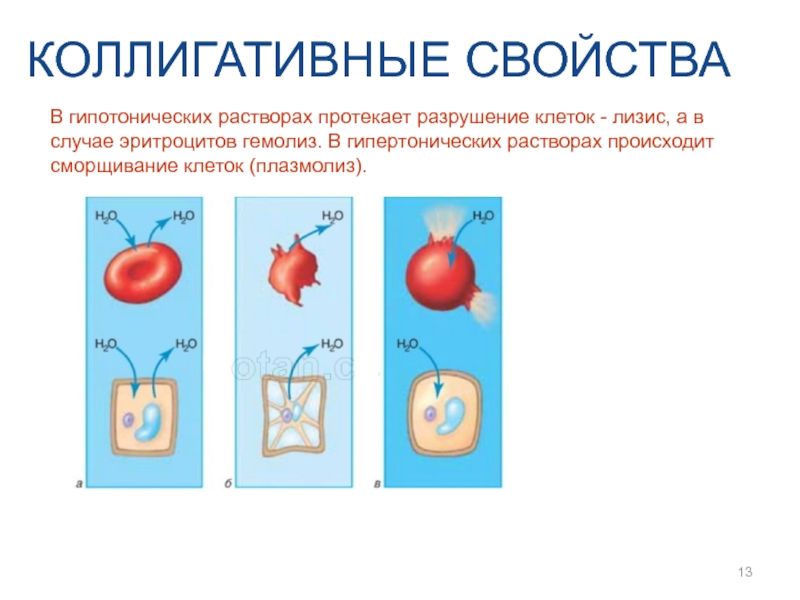
- 13. КОЛЛИГАТИВНЫЕ СВОЙСТВА В гипотонических растворах протекает разрушение
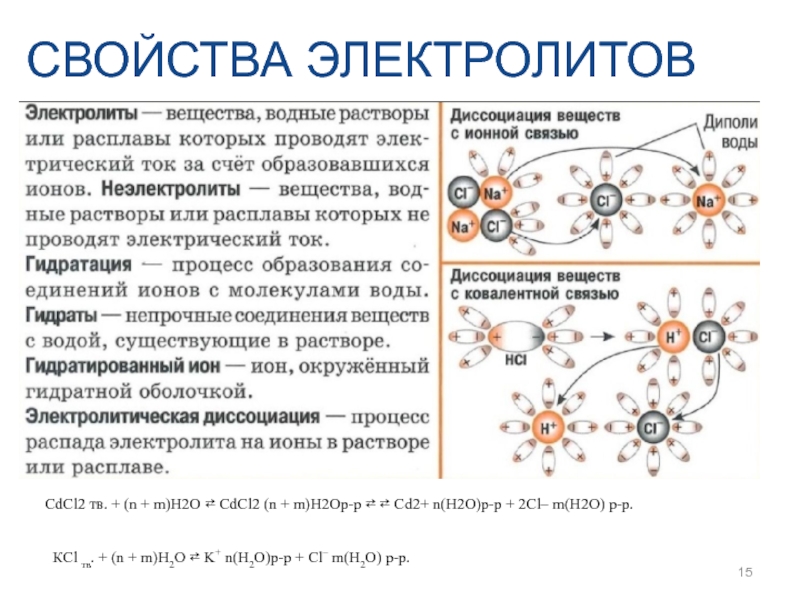
- 14. Распад электролита на ионы под влиянием полярных
- 15. СВОЙСТВА ЭЛЕКТРОЛИТОВ CdCl2 тв. + (n +
- 16. СВОЙСТВА ЭЛЕКТРОЛИТОВ Т.к. диссоциация- процесс обратимый, то
- 17. СВОЙСТВА ЭЛЕКТРОЛИТОВ Пусть раствор содержал С моль/л
- 18. СВОЙСТВА ЭЛЕКТРОЛИТОВ
- 19. СВОЙСТВА ЭЛЕКТРОЛИТОВ Согласно теории Дебая-Гюккеля для описания
- 20. СВОЙСТВА ЭЛЕКТРОЛИТОВ Z=1 (NaNO3 = Na+ +
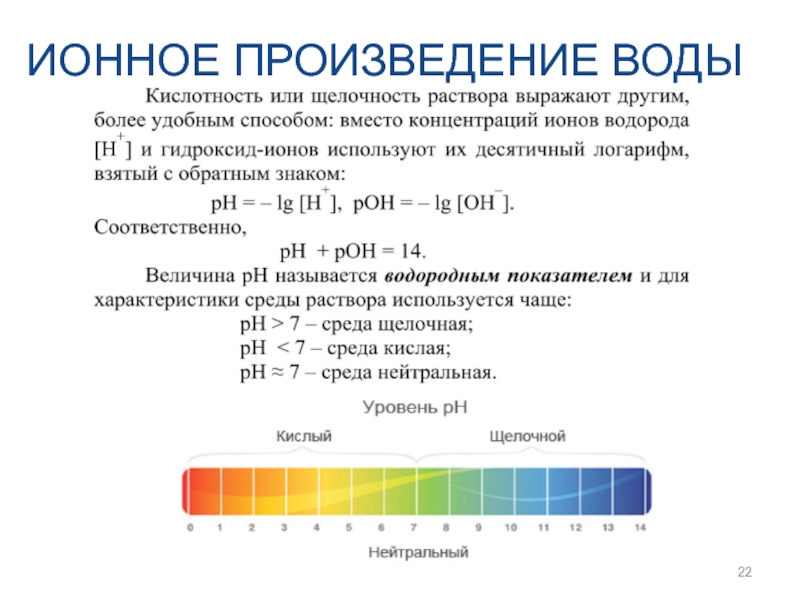
- 21. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- 22. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- 23. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
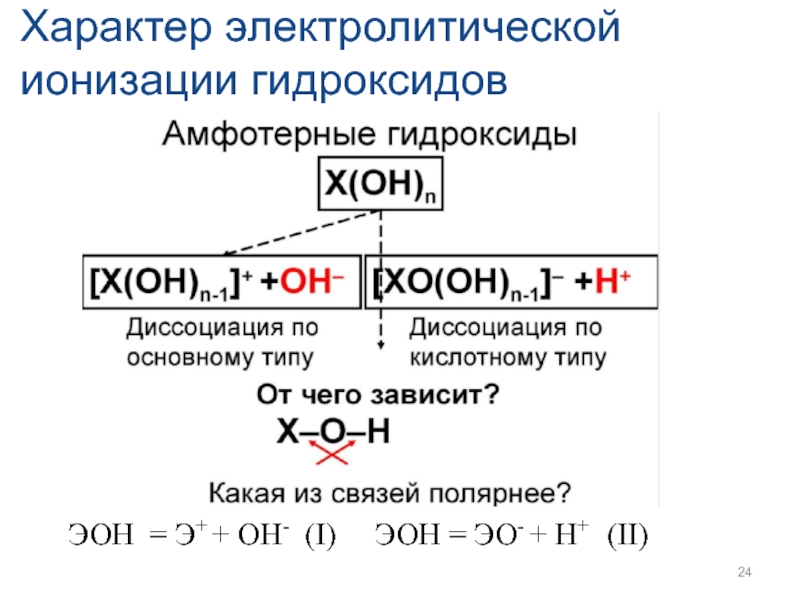
- 24. Характер электролитической ионизации гидроксидов ЭОН = Э+
- 25. Диссоциация многоосновных кислот
- 26. Диссоциация многокислотных оснований
- 27. Реакции в растворах. Гидролиз Нейтрализация доходит
- 28. Реакции в растворах. Гидролиз
- 29. Реакции в растворах. Гидролиз
- 30. Реакции в растворах. Гидролиз
- 31. Реакции в растворах. Гидролиз
- 32. Реакции в растворах. Гидролиз В случае
- 33. Гидролиз. Количественные характеристики
- 34. Гетерогенные равновесия в растворе
- 35. Гетерогенные равновесия в растворе Условие образования
- 36. Гетерогенные равновесия в растворе
- 37. Гетерогенные равновесия в растворе Малорастворимые соли
- 38. Гетерогенные равновесия в растворе Иногда осадки
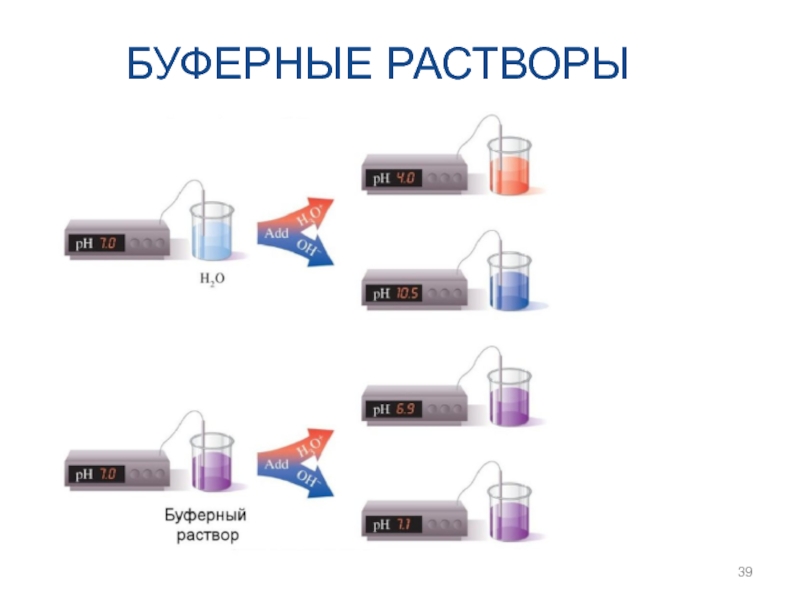
- 39. БУФЕРНЫЕ РАСТВОРЫ
- 40. БУФЕРНЫЕ РАСТВОРЫ
- 41. БУФЕРНЫЕ РАСТВОРЫ
- 42. БУФЕРНЫЕ РАСТВОРЫ
- 43. БУФЕРНЫЕ РАСТВОРЫ
- 44. БУФЕРНЫЕ РАСТВОРЫ
- 45. БУФЕРНЫЕ РАСТВОРЫ
- 46. БУФЕРНЫЕ РАСТВОРЫ
- 47. БУФЕРНЫЕ РАСТВОРЫ
- 48. БУФЕРНЫЕ РАСТВОРЫ
Слайд 1Лекция № 5
Растворы
1. Общая характеристика растворов.
2. Способы выражения концентрации
3. Коллигативные свойства растворов.
4. Основные положения теории электролитической диссоциации. 5. Количественные характеристики процесса диссоциации.
6. Степень электролитической диссоциации. Классификация растворов по величине α.
7. Закон разбавления Оствальда.
8. Ионное произведение воды. Водородный и гидроксильный показатель.
9. Гидролиз, сущность процесса.
10. Произведение растворимости.
Слайд 31. По агрегатному состоянию – жидкие, твердые и газообразные
КЛАССИФИКАЦИЯ
2. По
3. По количеству компонентов – бинарные, тройные...
4. По способности проводить электрический ток – электролиты и неэлектролиты
АВ + nS ⇄ АВnS ⇄ А+ xS + В– (n – x)S,
где S – молекулы растворителя
АВ +nS ⇄ АВnS
Слайд 5РАСТВОРИМОСТЬ
Растворение твердого вещества в жидкости можно представить следующим уравнением: В тв
Слайд 6МЕХАНИЗМ РАСТВОРЕНИЯ
Если | ΔHреш | > | ΔHsolv |, то процесс
Если | ΔHреш | < | ΔHsolv |, то процесс растворения является экзотермическим, и при повышении температуры растворимость будет уменьшаться.
Слайд 8КОЛЛИГАТИВНЫЕ СВОЙСТВА
Коллигативные свойства растворов – свойства, не зависящие от природы растворенного
Слайд 10КОЛЛИГАТИВНЫЕ СВОЙСТВА
Следствия из закона Рауля
E – эбуллиоскопическая константа, К – криоскопическая
Слайд 12КОЛЛИГАТИВНЫЕ СВОЙСТВА
Уравнения применимы только к растворам неэлектролитов. Для растворов электролитов в
Слайд 13КОЛЛИГАТИВНЫЕ СВОЙСТВА
В гипотонических растворах протекает разрушение клеток - лизис, а в
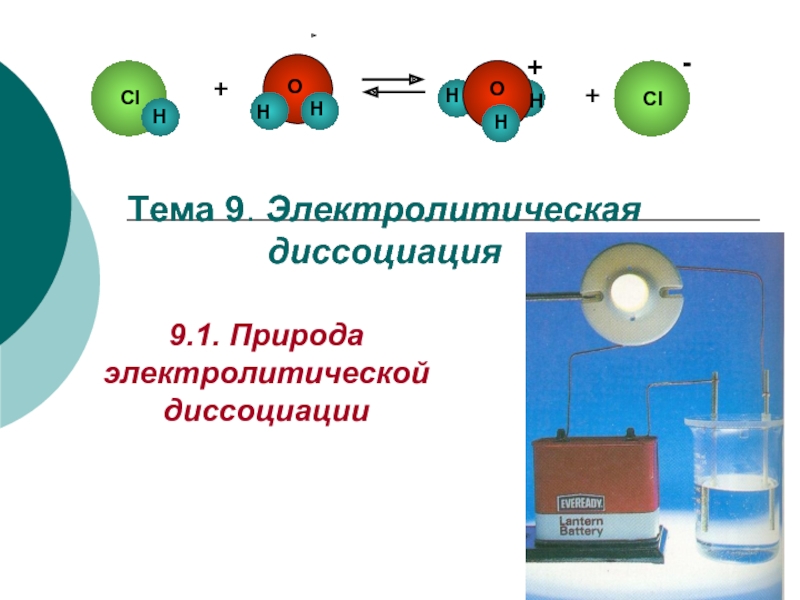
Слайд 14Распад электролита на ионы под влиянием полярных молекул растворителя (например, воды)
АВ + (n+m)Н2О ⇄ АВ(Н2О)n+m ⇄ А+(Н2О)n + В–(Н2О)m
Степень электролитической диссоциации (α) показывает отношение числа молекул, диссоциирующих (распавшихся) на ионы, к общему числу молекул растворенного вещества.
α=Nдис./Nобщ или α=С/С0
Степень диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, от концентрации раствора
СВОЙСТВА ЭЛЕКТРОЛИТОВ
Слайд 15СВОЙСТВА ЭЛЕКТРОЛИТОВ
CdCl2 тв. + (n + m)H2O ⇄ CdCl2 (n +
КCl тв. + (n + m)H2О ⇄ K+ n(H2O)р-р + Cl– m(H2O) р-р.
Слайд 16СВОЙСТВА ЭЛЕКТРОЛИТОВ
Т.к. диссоциация- процесс обратимый, то для него справедлив закон действующих
Слайд 17СВОЙСТВА ЭЛЕКТРОЛИТОВ
Пусть раствор содержал С моль/л электролита, степень диссоциации которого α,
тогда в равновесии концентрация недиссоциированных молекул равна
С – С · α = С (1- α ), а концентрации катионов - С· α , анионов - С· α.
Подставляем эти значения в выражение для Кдис.
Кдис = С2· α2 / C (1-α) = С · α2/ (1-α)
Кдис = С ·α2/(1-α)
Слайд 19СВОЙСТВА ЭЛЕКТРОЛИТОВ
Согласно теории Дебая-Гюккеля для описания реальных свойств растворов сильных электролитов
fa- коэффициент активности (кажущаяся степень диссоциации) включает в себя силы электростатического взаимодействия между ионами, величина, характеризующая отклонение свойств концентрированных растворов сильных электролитов от свойств разбавленных растворов слабых электролитов.
mA + nB = pC + gД
f - зависит от ионной силы раствора I
Слайд 20СВОЙСТВА ЭЛЕКТРОЛИТОВ
Z=1 (NaNO3 = Na+ + NO3-)
I= ½ (C1·12 + C2·12)
Z=2 (CuSO4 = Cu2+ + SO42-)
I= ½ (C·22 + C·22) = ½·8C= 4C I=4C
Z =1, Z =2 (CuCl2 = Cu+2 + 2Cl-)
I= ½ (C·22 + 2C·12) = ½ · 6C= 3C I=3C
Z=3, Z=1 (K3PO4 = 3K+ + PO43-)
I= ½ (3C·12 + C·32) = ½·12C = 6C I=6C
Связь коэффициента активности с ионной силой раствора выражается формулами:
Слайд 27Реакции в растворах. Гидролиз
Нейтрализация доходит до конца только тогда, когда
НС1 + КОН = КС1 + Н2О
Взаимная нейтрализация кислот и оснований, отличающихся друг от друга по силе, до конца не протекает.
Например:
СН3СООН + КОН = СН3СООК + Н2О
СН3СООН + К+ + ОН- = СН3СОО- + К+ + Н2О
СН3СООН + ОН- = СН3СОО- + Н2О
Эта реакция нейтрализации обратима. Обратная реакция нейтрализации, т.е. реакция взаимодействия кислоты и основания называется реакцией гидролиза.
Гидролизом соли называется - взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и к изменению рН среды. Гидролиз – является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Слайд 32Реакции в растворах. Гидролиз
В случае соли NH4CH3COO, константы диссоциации КNH4OH
СН3СОО- + NH-4 + НОН=СН3СОН + NH4ОН рН = 7
Т.к. концентрации ацетат - ионов и ионов аммония в растворе одинаковы, то кислота и основание равны по силе, то реакция среды будет нейтральной.
При взаимодействии солей А13+,Сr3+, Fe3+ с растворами сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды.
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей и реакция идет до конца. Это примеры совместного гидролиза – когда продукты гидролиза одной соли взаимодействуют с продуктами гидролиза другой соли, образуя при этом слабо диссоциирующие соединения и гидролиз обеих солей идет до конца.
Слайд 35Гетерогенные равновесия в растворе
Условие образования осадка: ПИ > ПР
ПИ –
Слайд 37Гетерогенные равновесия в растворе
Малорастворимые соли слабых кислот потому и растворяются
CaC2O4→ Ca+2 + C2O4-2
осадок
2HCl ↔ 2Cl- + 2H+
H2C2O4
или для солей непрочной угольной кислоты:
BaCO3 → Ba+2 + CO3-2
осадок
HCl ↔ 2Cl- + 2H+
Н2СO3=H2O + CO2↑
Исключение составляют малорастворимые соли слабых кислот с ничтожной величиной произведения растворимости, например сульфид ртути (ΙΙ) с ПР=4·10-53 . Сместить равновесие между осадком HgS и раствором, действуя сильной кислотой невозможно, так как сероводородная кислота образует гораздо больше ионов S2-, чем их получается за счет растворимости HgS
HgS↔Hg+2 + S2-
равновесие смещено влево
Слайд 38Гетерогенные равновесия в растворе
Иногда осадки солей растворяются с образованием прочных
AgCl + 2NH3 → [Ag(NH3)2]+ + Cl-
Понижение концентрации ионов Ag+ приводит к нарушению равновесия между раствором и твердой фазой, т.е. приводит к растворению осадка.
Примерами процессов в уравнении реакции которых слева и справа входят труднорастворимые вещества, могут служить:
AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) ΔG˚= - 54кДж
BaCO3↓(k) + Na2SO4(p) ↔ BaSO4↓(k) + Na2CO3(p) ΔG˚≈ 0
Равновесие смещается в сторону образования менее растворимого соединения. В реакции (1) равновесие смещено вправо, т.к.
ПРAgI=1,1·10-16 < ПРAgCl =1,8·10-10. В реакции (2) равновесие лишь несколько сдвинуто в сторону BaSO4 (ПР BaCO3 = 4,9·10-9 > ПР BaSO4 =1,08·10-10).