- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Квалификации химических веществ: презентация
Содержание
- 1. Растворы. Квалификации химических веществ:
- 2. Растворы вокруг нас Все природные жидкости - растворы
- 3. Существуют ли чистые вещества? Квалификации химических веществ:
- 4. Абсолютно чистых веществ нет! Видишь суслика? —
- 5. Классификация растворов Истинные и коллоидные растворы Растворы
- 6. Что такое раствор? Смесь, как минимум, двух
- 7. Что такое раствор? Фаза – однородная область
- 8. Что такое раствор? Компонентами называют не общее
- 9. Что такое раствор? Раствор – многокомпонентная однофазная
- 10. Типичные структуры железоуглеродистых сплавов. Сталь с 0,65%
- 11. Примеры растворов и смесей Белильная известь Молоко
- 12. Коллоидные растворы Это смеси. Очень тонкие. Растворы
- 13. Истинные растворы Истинные растворы – однофазные,
- 14. Истинные растворы В химической практике наиболее важны
- 15. Исинные растворы В конце XIX века в
- 16. Способы выражения концентраций
- 17. Влияние конц. на свойства Свойства растворенного вещества
- 18. Закон Рауля Франсуа Мари Рауль
- 19. Концентрированные и разбавленные растворы.
- 20. Растворы электролитов Растворы веществ проводящих электрический
- 21. Аррениус Отклонения от закона Рауля. Пришлось вводить
- 22. Сильные и слабые электролиты Сильные электролиты –
- 23. Сольватация Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя.
- 24. Сольватация От алхимиков: Подобное в подобном. (лат. similia
- 25. Концентрации сильных электролитов При растворении образуется всегда
- 26. Уравнение электронейтральности
- 27. Правило фаз
- 28. Осмос В случае, если растворитель и раствор
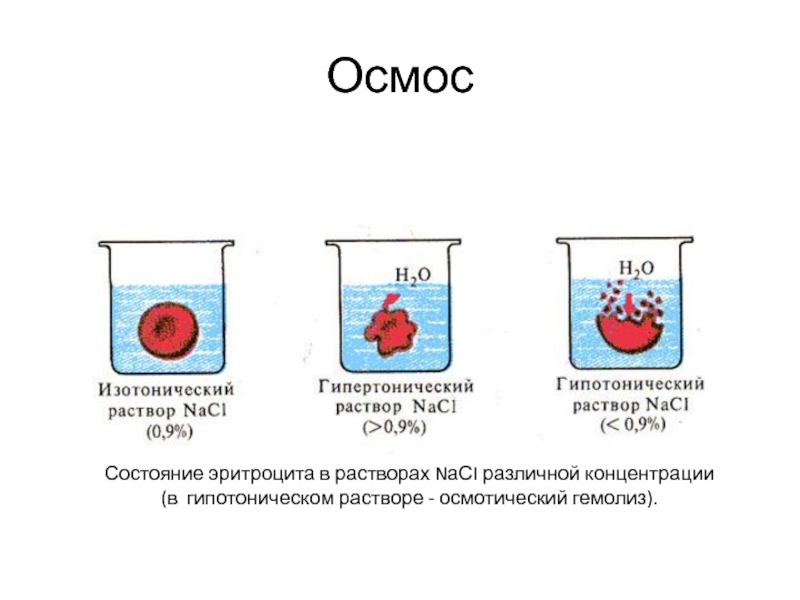
- 29. Осмос Состояние эритроцита в растворах NаСI различной концентрации (в гипотоническом растворе - осмотический гемолиз).
- 30. Осмос
Слайд 3Существуют ли чистые вещества?
Квалификации химических веществ:
«Тех.» Техн. чистый. Не менее основного
«Ч.» Чистый. >98%
«Ч.д.а.» Чистый для анализа. Около 98% в зависимости от области применения.
«Х.ч.» Химически чистый. >99%
«Осч.» Особо чистый. >99.99%
Слайд 5Классификация растворов
Истинные и коллоидные растворы
Растворы электролитов и неэлектролитов
Растворы сильных и слабых
Окрашенные и бесцветные растворы.
И.т.д.
Все классификации условны – растворы так проще описывать.
Слайд 6Что такое раствор?
Смесь, как минимум, двух веществ.
Чем отличается раствор от смеси?
Однородный.
Растворенное
Частицы растворенного вещества свободно перемещаются.
Стабильный.
Слайд 7Что такое раствор?
Фаза – однородная область пространства.
Фаза – область пространства, описываемая
Компоненты (в термодинамике и химии), независимые компоненты - химически индивидуальные вещества, из которых состоит термодинамическая система
Слайд 8Что такое раствор?
Компонентами называют не общее число составляющих систему веществ, а
Так, в системе из CaO и СО2 образуется соединение (карбонат кальция) по реакции CaO + CO2 = CaCO3. В этой системе за независимые компоненты можно принять CaO и CO2, а CaCO3 рассматривать как продукт их соединения. С равным правом за компоненты можно принять CaO и CaCO3, а CO2 считать продуктом термической диссоциации CaCO3.
Слайд 9Что такое раствор?
Раствор – многокомпонентная однофазная система.
Чем раствор отличается от соединения
Раствор углерода в железе – сталь.
Соединение углерода с железом – карбид железа (белый чугун)
Смесь железа с углеродом – серый чугун.
Слайд 10Типичные структуры железоуглеродистых сплавов. Сталь с 0,65% С (сетка феррита и
Цементит, Fe3C
Серый чугун с шаровидным графитом на ферритной основе.
Слайд 11Примеры растворов и смесей
Белильная известь
Молоко
Нефильтрованное пиво
Древесина
Кость
Кровь
Томатный сок
Мясной бульон
Рассол (свежеприготовленный)
Питьевая вода
Водка
Золото 585
Дюралюминий
Березовый сок
Стекло
Иод
«Зеленка»
Слайд 12Коллоидные растворы
Это смеси. Очень тонкие.
Растворы промежуточные между истинными растворами и взвесями
Коллоидные растворы либо не прозрачны, либо рассеивают свет.
Слайд 13Истинные растворы
Истинные растворы – однофазные, термодинамически устойчивые системы, неограниченно стабильные во
Прозрачные системы.
Движущими силами образования растворов являются:
энтропийный ∆Sсмеш= -R(xlnA+(1-x)lnB)
и энтальпийный факторы ∆H = ∆H(A-A) + ∆H(A-A) - ∆H(A-B).
Слайд 14Истинные растворы
В химической практике наиболее важны растворы, приготовленные на основе жидкого
Если растворитель твердое вещество – то образуется твердый раствор. Мы их изучать не будем.
Слайд 15Исинные растворы
В конце XIX века в науке существовало 2 полярных взгляда
Сейчас очевидно, что во многих реальных растворах имеют место специфические межмолекулярные взаимодействия, т.е. такие взаимодействия, причиной которых являются химические свойства конкретных молекул. Они не могут быть описаны с применением какого-либо универсального потенциала, который пригоден во всех случаях.
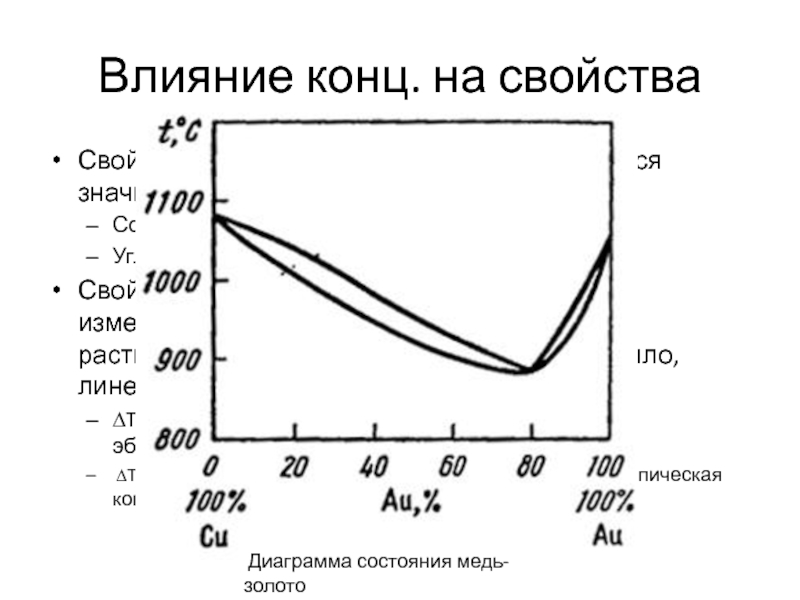
Слайд 17Влияние конц. на свойства
Свойства растворенного вещества изменяются значительно.
Соль. Была белой, твердой,
Углекислый газ. Летучий, без вкуса и запаха.
Свойства растворителя (т.е. уже раствора) изменяются в зависимости от количества растворенного вещества. Плавно и, как правило, линейно.
∆Tкип= i *C* b (i – изотонический коэффициент, b –эбуллиоскопическая константа)
∆Tкип= i *C* k (i – изотонический коэффициент, k – криоскопическая константа)
Диаграмма состояния медь-золото
Слайд 20Растворы электролитов
Растворы веществ проводящих электрический ток.
В XIX веке знали, что проводимость
Однако не понятно, образовались ли ионы в растворе при растворении, или же возникли при приложении электрического поля.
Слайд 21Аррениус
Отклонения от закона Рауля.
Пришлось вводить i – изотонический коэффициент.
Сванте Август Аррениус
Так
Вильгельм Фридрих Оствальд
По измерению изотонического коэффициента измеряют
степень диссоциации, константы комплексообразования.
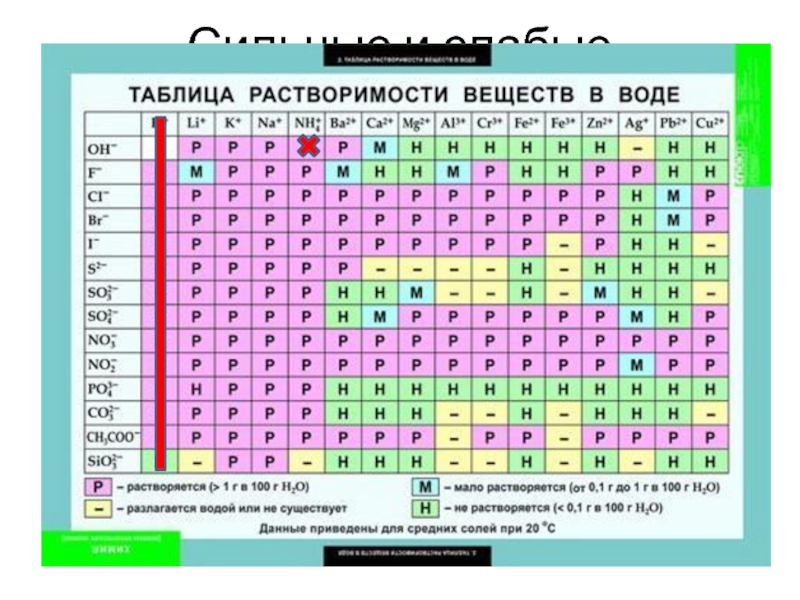
Слайд 22Сильные и слабые электролиты
Сильные электролиты – хорошо проводят электрический ток. Распадаются
Растворы всех хорошо растворимых солей,
Щелочи (M (OH)y (M=Li, Na, K, Rb, Cs, Fr, Sr, Ba, Ra, Tl(I))
Сильные кислоты (HCl, HBr, HI, (внимание! HF - слабая), HClO4, HClO3, H2SO4, H2SeO4, HNO3, CCl3COOH)
Слабые электролиты - плохо проводят электрической ток, но все же проводят.
Все слабые кислоты и щелочи, плохорастворимые слои
Слайд 23Сольватация
Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя.
Слайд 24Сольватация
От алхимиков: Подобное в подобном. (лат. similia similibus curentur)
Вода и масло
Вода, I2
Слайд 25Концентрации сильных электролитов
При растворении образуется всегда больше ионов, чем исходного вещества.
NaCl
С(NaCl) = C(Na+) = C(Cl-)
AlCl3 → Al3+ + 3Cl- - ионов больше в 4 раза. Количество катионов равно количеству хлорида алюминия, количество анионов в три раза больше изначального хлорида алюминия.
С(AlCl3) = C(Al3+) = ⅓C(Cl-)
C(Cl-) = 3 С(AlCl3)
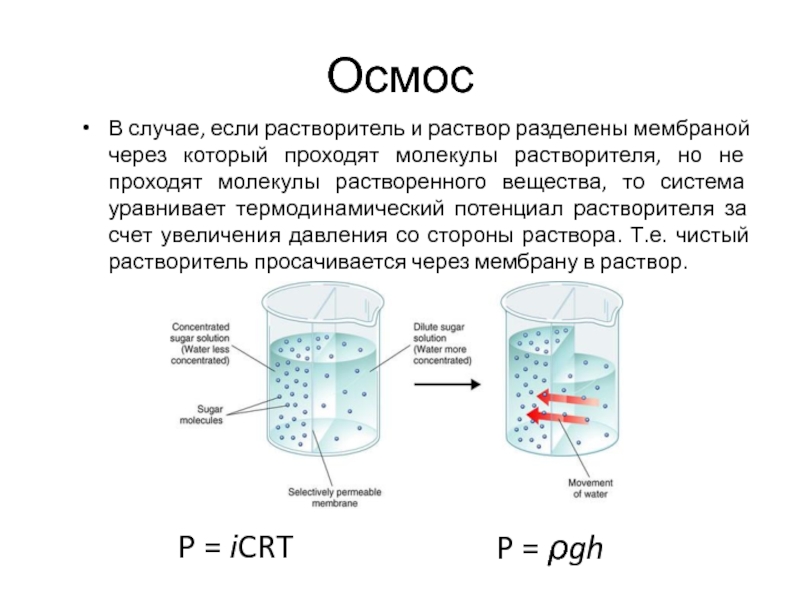
Слайд 28Осмос
В случае, если растворитель и раствор разделены мембраной через который проходят
P = iCRT
P = ρgh