- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы электролитов презентация
Содержание
- 1. Растворы электролитов
- 2. Растворы электролитов Электролиты – вещества с
- 3. II закон Рауля ∆Tкип =iEm ∆Tзам=iKm Закон Вант-Гоффа ∆Pосм=icRT
- 4. i – поправочный коэффициент изотонический i
- 5. Теория электролитической диссоциации Аррениуса Распад молекул
- 6. Количественная характеристика процесса диссоциации выражается степенью электролитической диссоциации – α.
- 7. Современная теория электролитической диссоциации: Гидратация
- 8. 3) Диссоциация ─ + ─ + ─
- 9. Способность гидратироваться зависит: - от природы ионов
- 10. По степени диссоциации: Сильные электролиты – α
- 11. Растворы слабых электролитов Чем больше Кд тем
- 12. Закон разбавления Освальда α
- 13. Растворы сильных электролитов NaCl i≈2 NaCl
- 14. 1907 Льюис → активность (а) → эффективная
- 15. Коэффициент активности зависит от ионной силы раствора
- 16. (H2PO4)- ↔ H+ + (HPO4)2- (HPO4)2-
- 17. Ионное произведение воды. pH – растворов.
- 18. Нейтральный раствор [H+] = 10-7 г-ион/л
- 19. В нейтральной среде: [H+] = 10-7 -Lg[10-7]
- 20. Пример 1: [OH-] = 10-11 pH =
- 21. Пример 2: pH = 2 [OH-] =
Слайд 2Растворы электролитов
Электролиты – вещества с ионной проводимостью.
Это растворы солей, кислоты, оснований,
I – закон Рауля для электролитов:
Слайд 4i – поправочный коэффициент изотонический
i – зависит от:
природы
концентрации раствора
i>1 для растворов солей, кислот и оснований
Слайд 5Теория электролитической диссоциации Аррениуса
Распад молекул электролитов на ионы в среде растворителя
NaCl →
Количество частиц при диссоциации увеличивается.
Cl-
Na+
+
Слайд 6Количественная характеристика процесса диссоциации выражается степенью электролитической диссоциации – α.
Слайд 7Современная теория электролитической диссоциации:
Гидратация
─ +
─ +
─ +
─ +
─ +
─ +
─
─ +
─
+
2) Ионизация
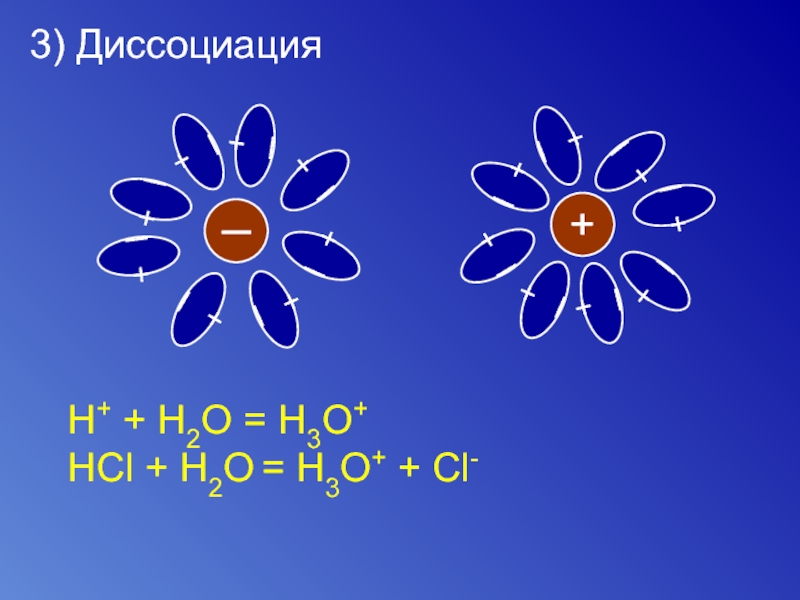
Слайд 83) Диссоциация
─ +
─ +
─ +
─ +
─ +
─ +
─ +
─ +
─
+
─ +
─
─ +
─ +
─ +
─ +
─ +
─ +
H+ + H2O = H3O+
HCl + H2O = H3O+ + Cl-
Слайд 9Способность гидратироваться зависит:
- от природы ионов
от заряда иона
от размера
от строения электронной оболочки
Al3+ > Cr3+ > Zn2+ > Na+
Энтальпия гидратации ионов:
∆Hгид.соли = ∆H+гид+ ∆Н-гид
∆S>0 Гидратация сопровождается значительным разрушением структуры
∆S<0 если структура растворителя упорядочивается
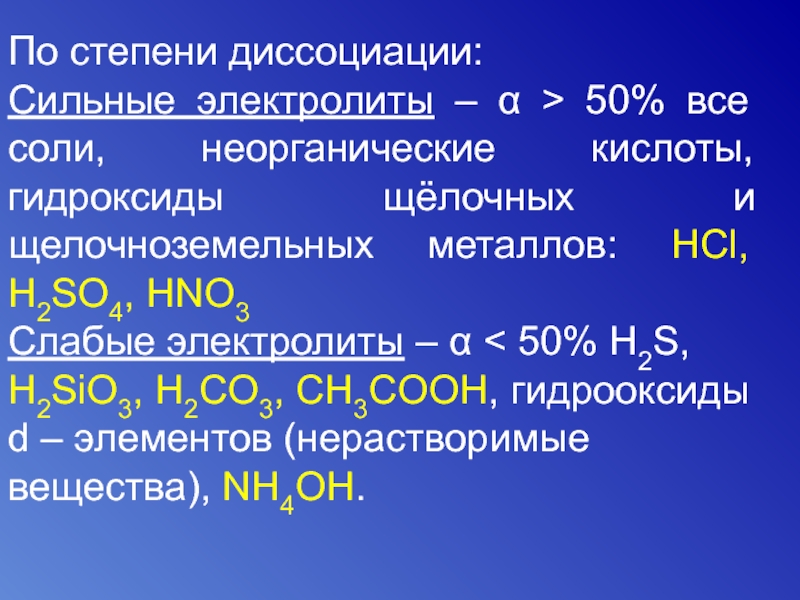
Слайд 10По степени диссоциации:
Сильные электролиты – α > 50% все соли, неорганические
Слабые электролиты – α < 50% Н2S, H2SiO3, H2CO3, CH3COOH, гидрооксиды d – элементов (нерастворимые вещества), NH4OH.
Слайд 11Растворы слабых электролитов
Чем больше Кд тем сильнее диссоциирует электролит.
NH4OH = NH4+
Слайд 12Закон разбавления Освальда
α
С – разбавлением раствора степень диссоциации увеличивается.
с – молярная концентрация электролита
сα – концентрация каждого из ионов
с(1-α) – концентрация недиссоциирующих частиц.
Слайд 13Растворы сильных электролитов
NaCl i≈2
NaCl → Na+ + Cl-
от наличия одноимённых ионов
СН3COONa → CH3COO- + Na+
- от температуры, увеличение t° вызывает ассоциацию ионов.
Слайд 141907 Льюис → активность (а) → эффективная концентрация ионов.
а = f·c;
Активность отражает:
Неполную диссоциацию молекул
Взаимное притяжение разноименных ионов
Влияние гидратации ионов
Взаимодействия между молекулами растворителя.
Слайд 15Коэффициент активности зависит от ионной силы раствора (J).
А – коэффициент пропор.,
Кислоты – диссоциируют на катионы H+ и анион кислотного остатка
HCl → H+ + Cl-
Н3РО4 ↔ [H+][H2PO4]-
Слайд 17Ионное произведение воды.
pH – растворов.
Н2О ↔ H+ + ОН-
Kводы =
K´воды = [H+][OH-] – ионное произведение воды
[H+][OH-] = 1⋅10-14 тогда
[H+] = [OH-] = = 10-7 г-ион/л
Слайд 18Нейтральный раствор
[H+] = 10-7 г-ион/л
[OH-] = 10-7 г-ион/л
Кислый раствор
[H+] >
[OH-] < 10-7 г-ион/л
Щелочной раствор
[H+] < 10-7 г-ион/л
[OH-] > 10-7 г-ион/л
Водородный показатель
-Lg[H+] = pH
Слайд 19В нейтральной среде:
[H+] = 10-7
-Lg[10-7] = 7 → pH = 7
В кислой среде:
[H+] = 10-5
-Lg[10-5] = 5 → pH = 5
pH < 7 ([Н+] < 10-7)
В щелочной среде:
[H+] = 10-9
-Lg[10-9] = 9 → pH = 9
pH > 7 ([Н+] > 10-7)
Слайд 20Пример 1:
[OH-] = 10-11
pH = ?
[H+][OH-] = 10-14
x⋅10-11 = 10-14
[H+] =
-Lg[10-3] = 3
pH = 3 (кислая среда)













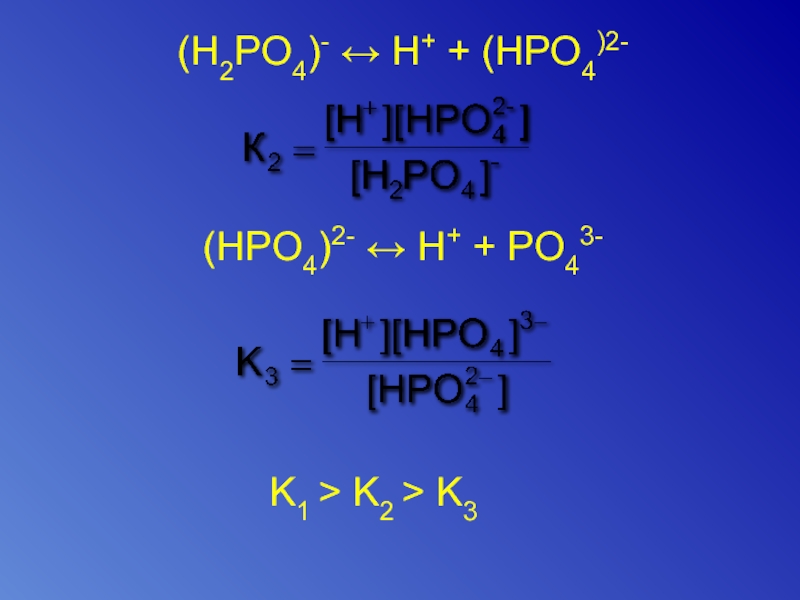
![Ионное произведение воды.pH – растворов. Н2О ↔ H+ + ОН-Kводы = [H+][OH-] = 1,1⋅10-14 г-ион/л](/img/tmb/3/288784/50eab80beeff8a630a446b8c9db62a1f-800x.jpg)
![Нейтральный раствор[H+] = 10-7 г-ион/л [OH-] = 10-7 г-ион/лКислый раствор[H+] > 10-7 г-ион/л[OH-] < 10-7](/img/tmb/3/288784/1e756372d38e16aadb3cd85696b554f9-800x.jpg)
![В нейтральной среде:[H+] = 10-7-Lg[10-7] = 7 → pH = 7 В кислой среде:[H+] =](/img/tmb/3/288784/9a96d0829deaab5ed1536e862b768ead-800x.jpg)
![Пример 1:[OH-] = 10-11pH = ?[H+][OH-] = 10-14x⋅10-11 = 10-14[H+] = 10-3 г-ион/л-Lg[10-3] = 3pH](/img/tmb/3/288784/13e53ea4546919fb53231b3beaf361c3-800x.jpg)
![Пример 2:pH = 2[OH-] = ?[H+] = 10-210-2 ⋅x = 10-14[OH-] = 10-12 г-ион/л](/img/tmb/3/288784/d8c09cd36c8d9b5a7748ce7f222d31d4-800x.jpg)