- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие презентация
Содержание
- 1. Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
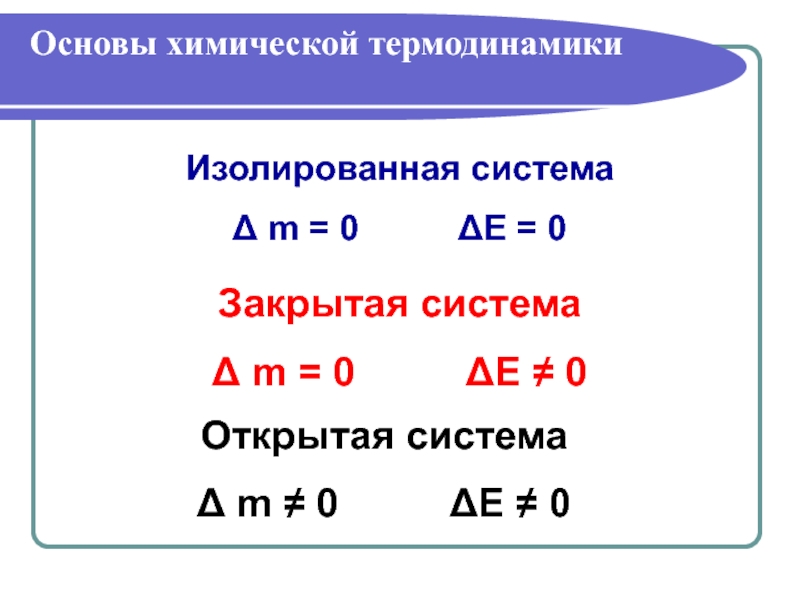
- 2. Основы химической термодинамики Изолированная система Δ
- 3. Основы химической термодинамики Экстенсивные параметры: масса (m)
- 4. Функциями состояния являются следующие величины: Температура
- 5. Основы химической термодинамики Математическое выражение первого начала
- 6. При изохорном процессе V = const, тогда
- 7. При изобарном процессе P = const
- 8. Основы химической термодинамики I закон термодинамики
- 9. ЗАКОН ГЕССА Тепловой эффект реакции при
- 10. Основы химической термодинамики Стандартные условия Т
- 11. Первое следствие из закона Гесса: Основы
- 12. Второе следствие из закона Гесса Основы
- 13. Первое начало термодинамики к живым организмам
- 14. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. S = f (Q) АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ 2-го НАЧАЛА ТЕРМОДИНАМИКИ
- 15. [S] = Дж/К, [ΔS] = Дж/моль×К
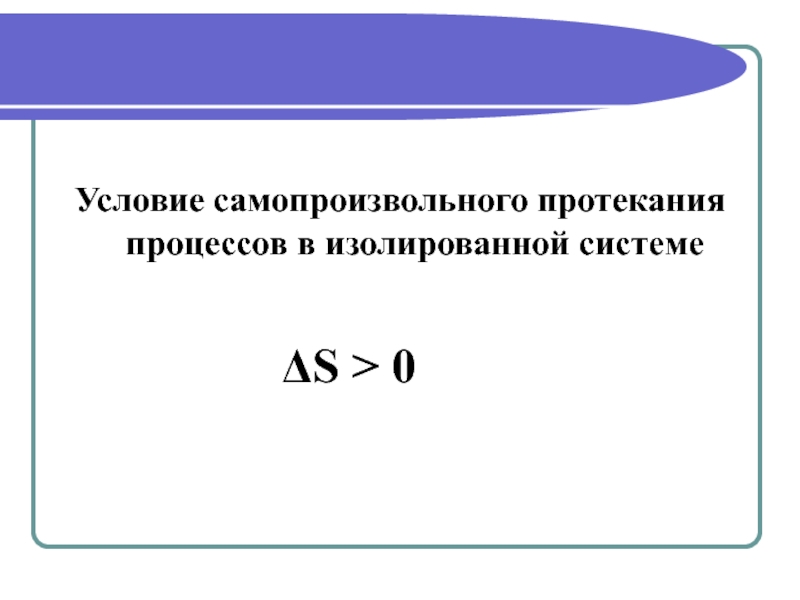
- 16. Условие самопроизвольного протекания процессов в изолированной системе ΔS > 0
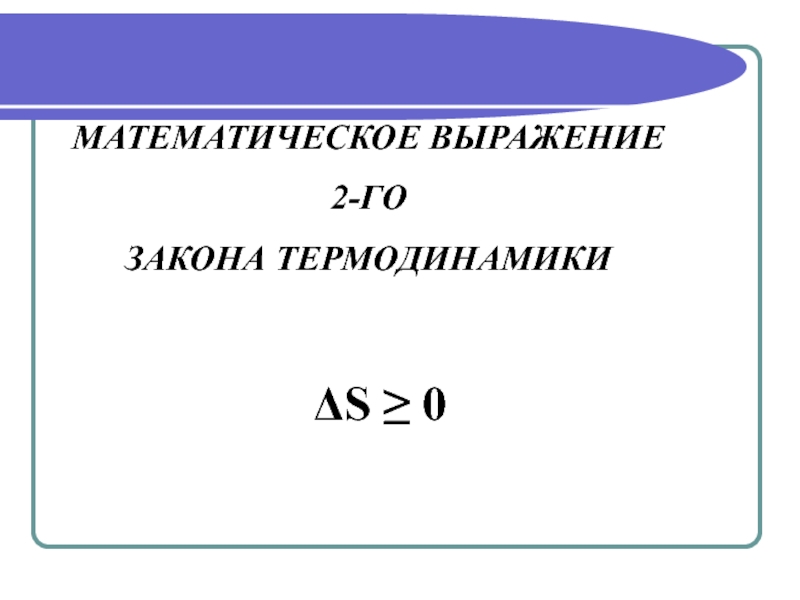
- 17. МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ 2-ГО ЗАКОНА ТЕРМОДИНАМИКИ ΔS ≥ 0
- 18. РАСЧЁТ ЭНТРОПИИ РЕАКЦИИ ΔS0298= ∑n×S0прод. р-ции -∑n×S0 исх. в-в
- 19. Условие возможности протекания реакции в прямом направлении
- 20. Расчёт изменения свободной энергии Гиббса ΔG0 =
- 21. ΔG0 = ΔH0 – TΔS0 УРАВНЕНИЕ ГИББСА
- 22. АНАЛИЗ УРАВНЕНИЯ ГИББСА 1) ΔG0 < 0,
- 23. Химические реакции, протекающие в организме при
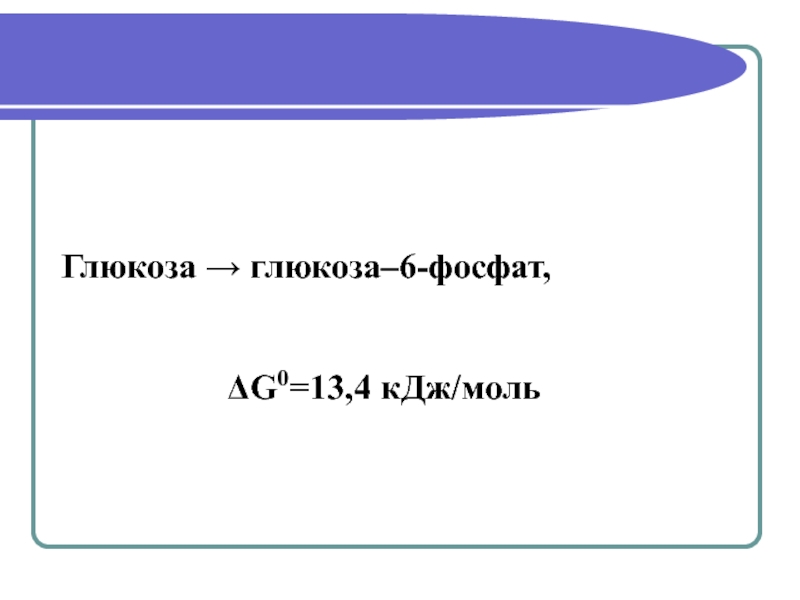
- 24. Глюкоза → глюкоза–6-фосфат, ΔG0=13,4 кДж/моль
- 25. АТФ + 4Н2О →АДФ +Н3РО4, ΔG0= -
- 26. ХИМИЧЕСКОЕ РАВНОВЕСИЕ c, d, a, b –
- 27. Выражение константы равновесия через парциальное давление
- 28. Признаки истинного равновесия 1) Равенство скоростей прямой
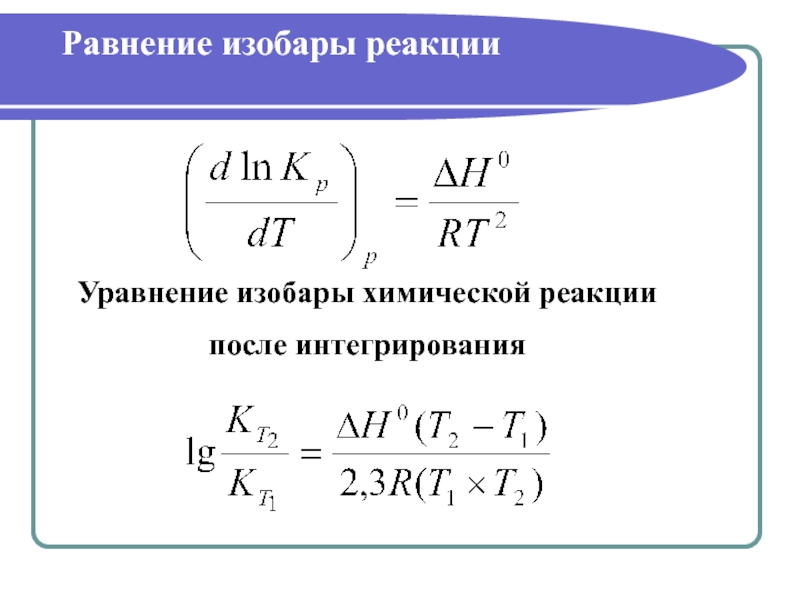
- 29. Уравнение изотермы химической реакции при стандартных условиях Kc - константа равновесия реакции
- 30. УРАВНЕНИЕ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ
- 31. АНАЛИЗ УРАВНЕНИЯ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ -если
- 32. Равнение изобары реакции Уравнение изобары химической реакции после интегрирования
Слайд 1Тема лекции №1:
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое
Слайд 2Основы химической термодинамики
Изолированная система
Δ m = 0
Закрытая система
Δ m = 0 ΔЕ ≠ 0
Открытая система
Δ m ≠ 0 ΔЕ ≠ 0
Слайд 3Основы химической термодинамики
Экстенсивные параметры:
масса (m)
объём (V)
энергия (Е)
энтропия (S)
Интенсивные параметры:
давление (Р)
температура (Т)
плотность
Слайд 4Функциями состояния являются
следующие величины:
Температура (Т)
Объем (V)
Давление (P)
Внутренняя энергия (U)
Энтальпия (H)
Энтропия
Свободная энергия Гиббса (G)
Основы химической термодинамики
Слайд 5Основы химической термодинамики
Математическое выражение первого начала термодинамики
Q = ΔU +
Слайд 6 При изохорном процессе V = const,
тогда Δ V = 0,
W =
Уравнение I начала термодинамики
принимает вид:
Основы химической термодинамики
QV = ΔUV
Слайд 7 При изобарном процессе P = const
Н = U + PV
Основы химической термодинамики
Qp = H2 – H1
Qp = ΔH
Слайд 9ЗАКОН ГЕССА
Тепловой эффект реакции при постоянном объеме или давлении не зависит
Основы химической термодинамики
Слайд 11Первое следствие из закона Гесса:
Основы химической термодинамики
ΔH0 = Σn ΔH0298 обр.
Слайд 12Второе следствие из закона Гесса
Основы химической термодинамики
ΔH0сгор =Σn ΔH0 298
Слайд 13Первое начало термодинамики к живым организмам
Основы химической термодинамики
ΔU = 0, тогда
Q
Все виды работ в организме совершаются за счет эквивалентного количества энергии, выделяющейся при окислении питательных веществ
Слайд 19Условие возможности протекания реакции в прямом направлении без затраты энергии
ΔG
ΔG > 0, то реакция неосуществима в прямом направлении
ΔG = 0, то система находится в состоянии равновесия
Энергия Гиббса
Слайд 20Расчёт изменения свободной энергии Гиббса
ΔG0 = Σn ΔG0 298 обр. пр.р.-
Слайд 22АНАЛИЗ УРАВНЕНИЯ ГИББСА
1) ΔG0 < 0, если ΔН0 < 0, ΔS0
3)ΔG0 < 0, если ΔН0 > 0, ΔS0 > 0 - при высоких температурах, |ТΔS |>|ΔH|
2) ΔG0 < 0, если ΔН0<0, ΔS<0 при низких температурах и ΔS – очень мало
|ΔH|>|ТΔS|
Слайд 23Химические реакции, протекающие в
организме при ΔG
совершается работа, наз. эндергоническими
Слайд 25АТФ + 4Н2О →АДФ +Н3РО4, ΔG0= - 30,6кДж/моль
ΔG0 = 13,4 -
ГЛЮКОЗА + АТФ → ГЛЮКОЗА-6-ФОСФАТ + АДФ, ΔG=-17,2 кДж/моль
Слайд 26ХИМИЧЕСКОЕ РАВНОВЕСИЕ
c, d, a, b – стехиометрические коэффициенты реакции
[C], [D], [A],
веществ, моль/л
Слайд 28Признаки истинного равновесия
1) Равенство скоростей прямой и обратной реакции;
2) Сохранением своего
отсутствии внешних воздействий;
3) Минимальным значением энергии Гиббса Gmin и
максимальным значением энтропии Smax;
Слайд 29Уравнение изотермы химической реакции
при стандартных условиях
Kc - константа равновесия реакции
Слайд 31АНАЛИЗ УРАВНЕНИЯ ИЗОТЕРМЫ
ХИМИЧЕСКОЙ РЕАКЦИИ
-если Kc > Пс, то ΔG
сторону прямой реакции, ;
если Kc < Пс, то ΔG > 0, равновесие сдвинуто в сторону обратной реакции;
если Kс = Пc, то ΔG = 0, наблюдается
химическое равновесие













![[S] = Дж/К,[ΔS] = Дж/моль×К](/img/tmb/5/457365/348386342e83d9bdd5a860a35ff8ea9a-800x.jpg)







![ХИМИЧЕСКОЕ РАВНОВЕСИЕc, d, a, b – стехиометрические коэффициенты реакции[C], [D], [A], [B] – равновесные концентрации](/img/tmb/5/457365/fd17db03e282f768199f4af90f4f431a-800x.jpg)