- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы презентация
Содержание
- 1. Растворы
- 2. Растворы – это гомогенные (однородные) системы, состоящие
- 3. Растворы подразделяются: Молекулярные – водные
- 4. Растворение – физико –
- 5. Растворимость – свойство вещества растворяться в
- 6. Влияние различных факторов на растворимость.
- 7. Концентрация раствора – это содержание вещества в определенной массе или объеме раствора.
- 8. Выражение концентраций растворов. Массовая доля
- 9. Выражение концентраций растворов. Молярность - число
- 10. Выражение концентраций растворов. Эквивалентная концентрация
- 11. Выражение концентраций растворов. Моляльная концентрация (моляльность) – число молей растворенного вещества на 1000 г растворителя.
- 12. Природные растворы. Минеральная вода. Кровь животных. Морская вода.
- 13. Практическое применение растворов. Продукты питания. Лекарственные препараты.
Слайд 2Растворы – это гомогенные (однородные) системы, состоящие из двух и более
Точное определение раствора ( 1887 год Д.И.Менделеев):
Раствор – гомогенная (однородная) система, состоящая из
частиц растворенного
вещества, растворителя
и продуктов
их взаимодействия.
Справочник.
Справочник.
Слайд 3
Растворы подразделяются:
Молекулярные – водные растворы неэлектролитов
( спиртовой
Молекулярно-ионные – растворы слабых электролитов ( азотистая и угольная кислоты, аммиачная вода).
Ионные растворы –
растворы
электролитов.
Справочник.
Слайд 4
Растворение –
физико – химический процесс, в котором наряду с образованием
Справочник.
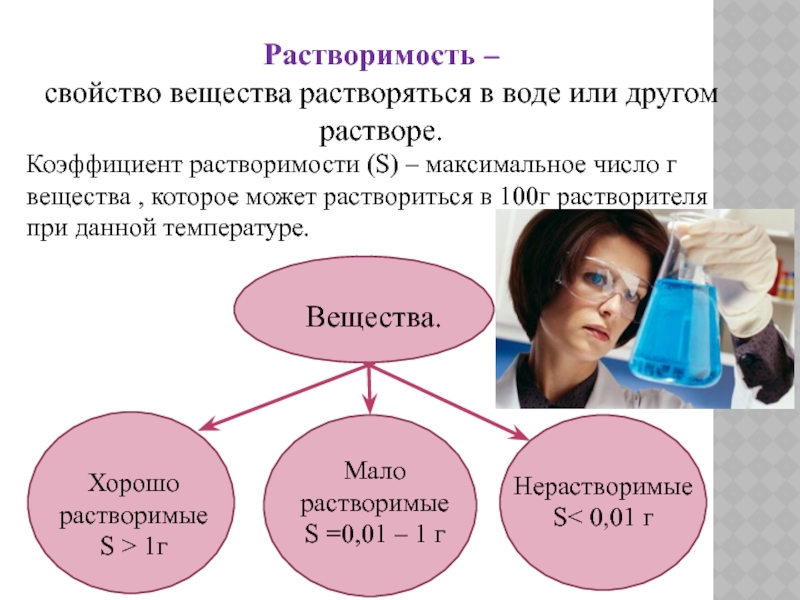
Слайд 5Растворимость –
свойство вещества растворяться в воде или другом растворе.
Коэффициент растворимости
Хорошо растворимые
S > 1г
Мало растворимые
S =0,01 – 1 г
Вещества.
Нерастворимые
S< 0,01 г
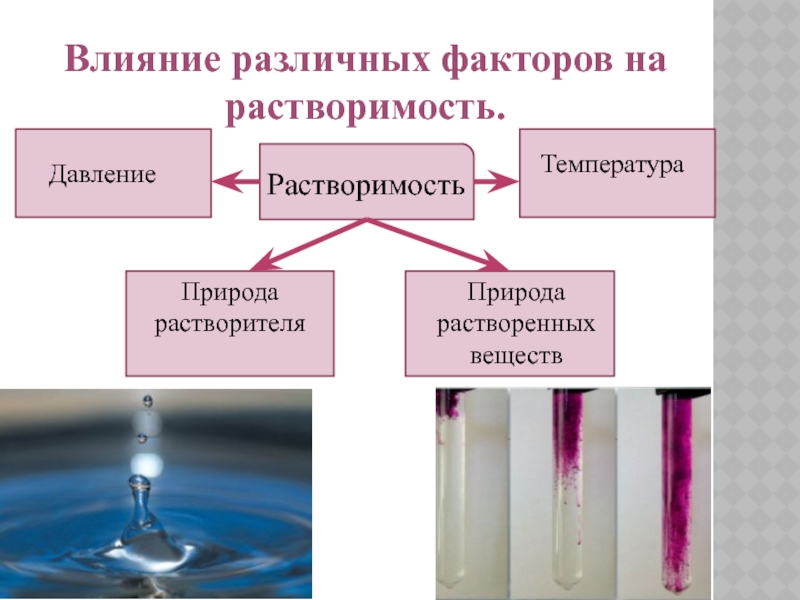
Слайд 6Влияние различных факторов на растворимость.
Растворимость
Температура
Давление
Природа растворенных
Природа растворителя
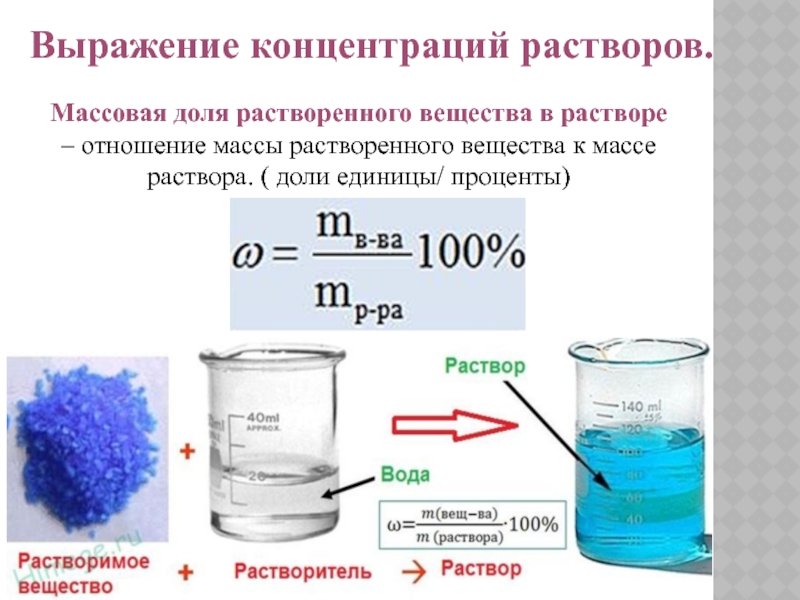
Слайд 8Выражение концентраций растворов.
Массовая доля растворенного вещества в растворе – отношение
Слайд 9Выражение концентраций растворов.
Молярность - число молей растворенного вещества в 1
ʋ - количество вещества (моль);
V – объем раствора (л);
Слайд 10 Выражение концентраций растворов.
Эквивалентная концентрация (нормальность) – число эквивалентов растворенного вещества
ʋ экв. - количество эквивалентов;
V – объём раствора, л.