- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность презентация
Содержание
- 1. Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
- 2. Редокс -процессы (ОВР) и равновесия; редокс- потенциалы,
- 3. окисленная форма (окислитель /Ox, сопряженный восстановитель) является
- 4. Сопряженная окислительно-восстановительная пара Любая ОВР является совокупностью
- 5. Например: Типы редокс- системы 1/ Если между
- 6. Примеры окислителей и восстановителей Окислители и восстановители: S и др. неметаллы, SO2,KNO2,HCl,H2O2
- 7. Классификация ОВР ОВР разделяют на 4-е группы
- 8. 3. Реакции диспропорционирования. При реакциях диспропорцирования (перераспределения)
- 9. Составление уравнений окислительно-восстановительных реакций Существует два
- 10. В целом: Баланс атомов O2 в ОВР, протекающих в различных средах:
- 11. Эквивалент Эквивалент окислителя – реальная или условная
- 13. Факторы, влияющие на протекание ОВР Концентрации реагента
- 14. Для организма перманганаты ядовиты Для обезвреживания острых
- 15. Редокс -потенциал Таким образом, редокс-потенциал
- 16. Уравнение Нернста-Петерса Для расчета редокс-потенциала (единица измерения — вольт (В)) окислительно-восстановительной реакции используют уравнение Нернста:
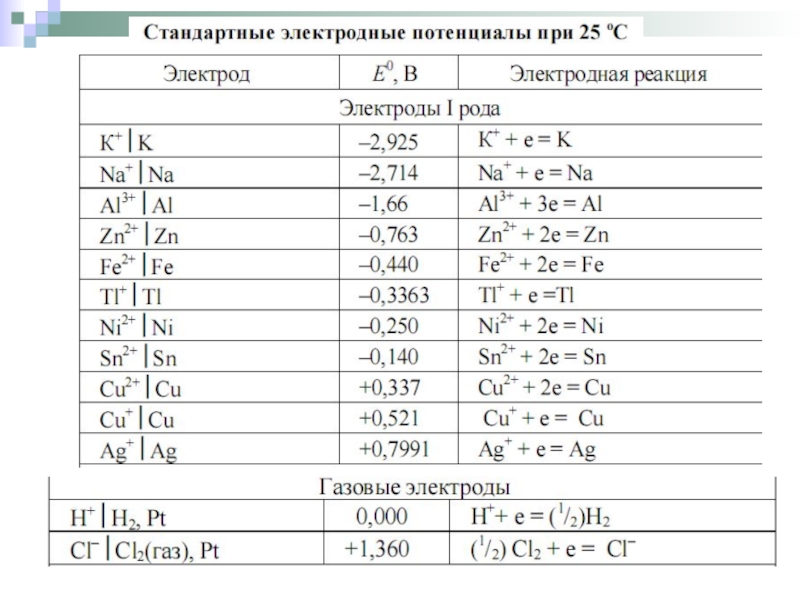
- 17. -значения стандартных рдокс-потенциалов являются справочными;
- 18. Направление самопроизвольного протекания ОВР Согласно второму закону
- 20. Глубина протекания ОВР Чем больше стандартный потенциал
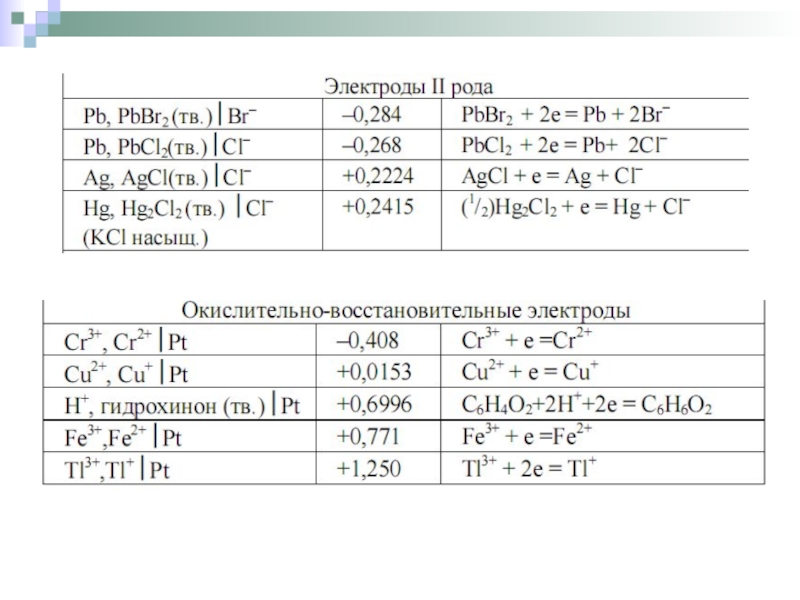
- 21. В общем виде схему сложного окислительно-восстановительного электрода
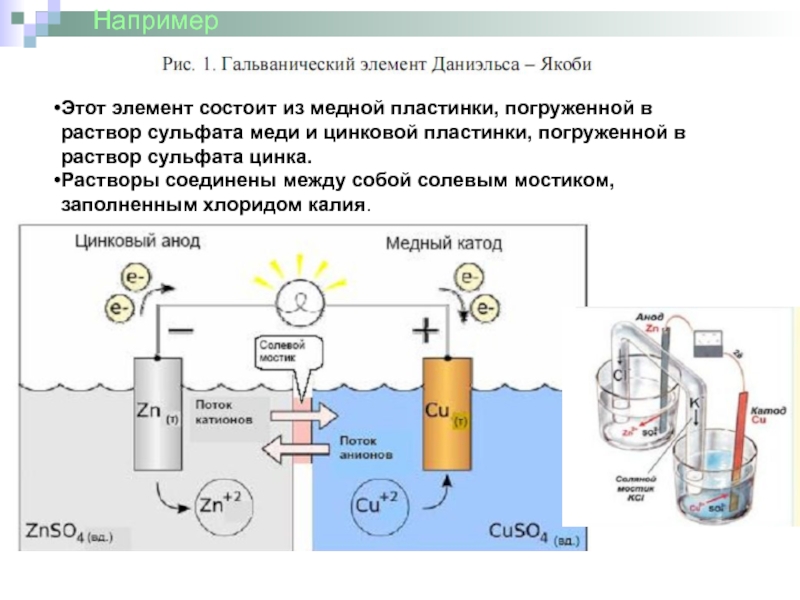
- 28. Гальванический элемент
- 29. Этот элемент состоит из медной пластинки, погруженной
- 30. – электрод, на котором протекает процесс
- 31. – электрод, на котором протекает процесс восстановления
- 32. Условная запись гальванического элемента В
- 34. 1 2 3 4 5
- 38. Электрохимический ряд активности (ряд напряжений, ряд стандартных
- 39. Ряд напряжений используется на практике для сравнительной
- 40. - Металлы, стоящие в ряду правее водорода,
- 41. Электролиз – это окислительно-восстановительный процесс, протекающий на
- 42. Сущность электролиза заключается в том, что за
- 43. Законы Фарадея
- 44. Второй закон Фарадея (формула без эквивалента)
- 46. • В расплавах катионы металла восстанавливаются до
- 48. Электролиз расплава NaCl К(-)
- 49. К(-) CuCl2 А(+)
- 50. Электролиз расплава NaOH К(-) NaOH А(+)
- 51. Электролиз в растворах 1)процесс на катоде
- 53. Процесс на аноде
- 54. Процесс на аноде б) Если анод инертный,
- 55. Электролиз раствора NaCl
- 56. Электролиз раствора CuSO4
- 57. Электролиз раствора NaCl
- 58. Вещества, образующиеся при электролизе некоторых электролитов В целом
- 59. Коррозией называется процесс разрушения металлов вследствие химического
- 60. лита
Слайд 1Редокс- процессы и равновесия
Основы электрохимии
Лекция
Процессы дыхания, брожения, обмена веществ,
Слайд 2Редокс -процессы (ОВР) и равновесия; редокс- потенциалы, его биологическая роль
Окислительно-восстановительный процесс
Признаком протекания редокс- процесса служит изменение степеней окисления.
Основные понятия
Слайд 3окисленная форма (окислитель /Ox, сопряженный восстановитель) является акцептором электронов и восстанавливается,
восстановленная форма (восстановитель /Red, сопряженный окислитель) выступает в роли донора электронов и окисляется, отдавая электроны.
В любой ОВР участвуют, по крайней мере, две редокс-пары.
Редокс –система (или пара)
Редокс- пара- это система из окисленной и восстановленной форм данного вещества, в которой
Например:
Слайд 4Сопряженная окислительно-восстановительная пара
Любая ОВР является совокупностью двух сопряженных процессов – полуреакций:
В общем виде:
Например:
Слайд 5Например:
Типы редокс- системы
1/ Если между окисленной и восстановленной формами осуществляется только
2/ Если осуществляется перенос как электронов, так и протонов (точнее ионов гидроксония Н3О+), то редокс-систему относят ко второму типу.
Например:
Слайд 6Примеры окислителей и восстановителей
Окислители и восстановители:
S и др. неметаллы, SO2,KNO2,HCl,H2O2
Слайд 7Классификация ОВР
ОВР разделяют на 4-е группы или типы:
1. Внутримолекулярные. Реакция внутримолекулярного
2. Межмолекулярные. Реакция межмолекулярного окисления, в которой атомы окислителя и восстановителя находятся в разных веществах.
Например:
Например:
Слайд 83. Реакции диспропорционирования. При реакциях диспропорцирования (перераспределения) атомы одного и того
4. Реакции контрдиспропорционирования. При реакциях кондрдиспропорцирования (реакции конмутация) атомы одного элемента в двух разных степенях окисления принимают одинаковую степень окисления в продуктах реакции
Например:
Например:
Слайд 9Составление уравнений
окислительно-восстановительных реакций
Существует два основных способа составления уравнений окислительно-восстановительных реакций:
Электронно-ионный баланс (метод полуреакций)
При использовании этого метода:
Степени окисления элементов в составе реагирующих веществ не определяют.
В полуреакциях записывают ионы или молекулы сопряженных окисленной и восстановленной форм в том виде, в каком они существуют в растворе в условиях проведения реакции.
Слабые электролиты, газы и малорастворимые вещества записывают в молекулярном виде.
При уравнивании масс кислорода и водорода в правой и левой частях полуреакции можно использовать молекулы H2O, а также ионы Н+ и ОН-, образующиеся при ионизации воды.
Слайд 11Эквивалент
Эквивалент окислителя – реальная или условная частица его, которая в процессе
Эквивалент восстановителя -реальная или условная частица его, которая в процессе восстановления отдает 1ē.
Молярная масса эквивалентов окислителя и восстановителя численно равна произведению молярной массы окислителя или восстановителя на фактор эквивалентности этого окислителя или восстановителя в данной реакции:
Слайд 13Факторы, влияющие на протекание ОВР
Концентрации реагента
Температуры реакции (при нагревании и охлаждении
Наличие катализатора
Влияния характера среды (кислая, нейтральная, щелочная ).
Перманганаты - сильные окислители,
особенно в кислой среде:
Например:
Окисленная
форма
Восстановленная
форма
р-р б/ц
осадок бурый
р-р зел. цвета
Слайд 14Для организма перманганаты ядовиты
Для обезвреживания острых отравлений перманганатом KMnO4 используют восстановитель
В результате реакции между ядом и противоядием образуется нетоксичное или малотоксичное соединение.
Химические противоядия, как антидоты прямого действия могут действовать в любом месте –
до проникновения яда в кровь,
при циркуляции яда в крови,
и после фиксации в тканях.
Слайд 15Редокс -потенциал
Таким образом, редокс-потенциал можно рассматривать как частный случай электродного потенциала,
Редокс- потенциал служит количественной характеристикой окислительно-восстановительной способности редокс – системы.
Редокс –потенциал - это разность потенциалов, возникающая на границе раздела инертный металл- раствор, содержащий редокс- систему.
Слайд 16Уравнение Нернста-Петерса
Для расчета редокс-потенциала (единица измерения — вольт (В)) окислительно-восстановительной реакции
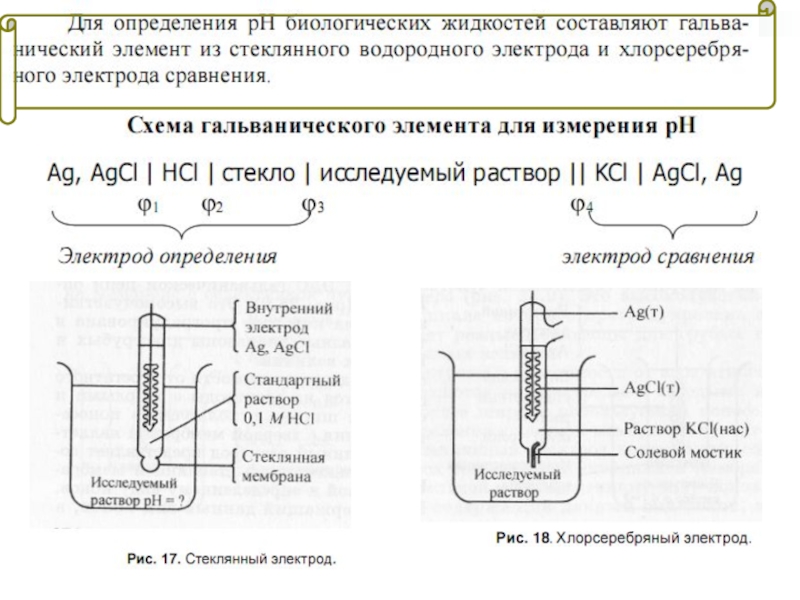
Слайд 17
-значения стандартных рдокс-потенциалов являются справочными;
-измеряются относительно потенциала редокс-системы 2Н+/Н2, значение
Уравнение Нернста-Петерса для биологических систем
Чем больше значение редокс-потенциала редокс-системы, тем выше ее окислительная способность, т.е. тем сильнее окислитель и слабее сопряженный ему восстановитель.
Слайд 18Направление самопроизвольного протекания ОВР
Согласно второму закону термодинамики, самопроизвольно могут протекать только
Для ОВ реакций ΔG < 0 в том случае, если из более сильных окислителя и восстановителя образуются более слабые.
Окислительно-восстановительные потенциалы позволяют количественно судить об активности окислителя и восстановителя.
Условием самопроизвольного протекания ОВР является положительное значение её ЭДС :
Если Δφо > 0, то реакция протекает в прямом направлении в соответствии с записью уравнения реакции (∆Gо < 0).
Если Δφо < 0, то реакция протекает в обратном направлении согласно записи уравнения реакции (∆Gо > 0).
Если Δφо = 0, то система находится в состоянии устойчивого химического равновесия (∆ Gо =0).
Слайд 20Глубина протекания ОВР
Чем больше стандартный потенциал реакции (φо), тем выше ее
где n – количеств перераспределенных электронов
Слайд 21В общем виде схему сложного окислительно-восстановительного электрода можно записать следующим образом
восстановление
окисление
Потенциал
Окислительно-восстановительный электрод-
это электрод, состоящий из инертного материала (металлические платина, золото, вольфрам, титан, а также графит), погруженного в водный раствор, в котором имеются окисленная и восстановленная форма данного вещества.
Слайд 29Этот элемент состоит из медной пластинки, погруженной в раствор сульфата меди
Растворы соединены между собой солевым мостиком, заполненным хлоридом калия.
Например
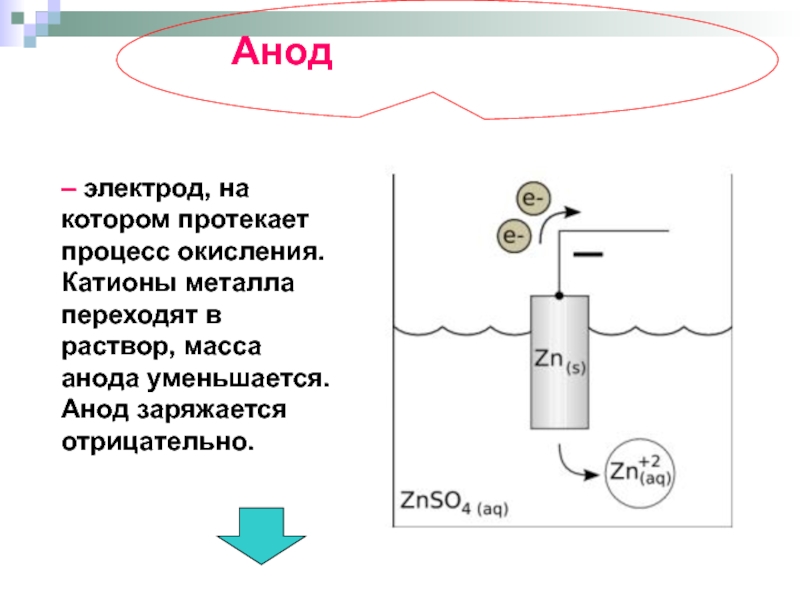
Слайд 30
– электрод, на котором протекает процесс окисления. Катионы металла переходят в
Анод
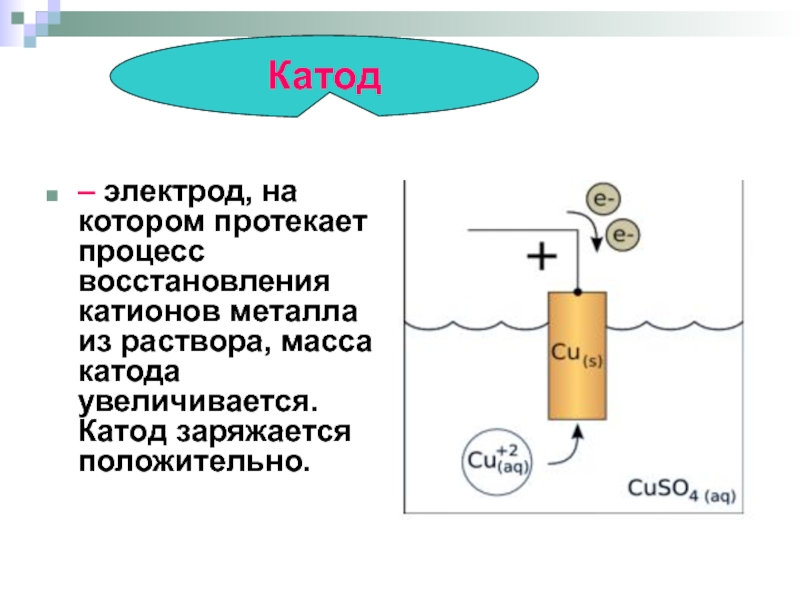
Слайд 31– электрод, на котором протекает процесс восстановления катионов металла из раствора,
Катод
Слайд 32Условная запись
гальванического элемента
В схеме гальванического элемента согласно правилам ИЮПАК (Международный
Границу раздела м/у металлом и раствором обозначают одной вертикальной чертой.
Границу раздела двух растворов – двумя сплошными вертикальными чертами. Компоненты одной фазы записывают через запятую.
Слайд 38Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов- это
последовательность,
расположены в порядке увеличения их стандартных электрохимических потенциалов φо (фи) или Ео, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me.
Слайд 39Ряд напряжений используется на практике для сравнительной оценки химической активности металлов
-Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
-Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
-.
Слайд 40- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей
-При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Электрохимический ряд напряжений металлов
Убывание восстановительной активности
Н
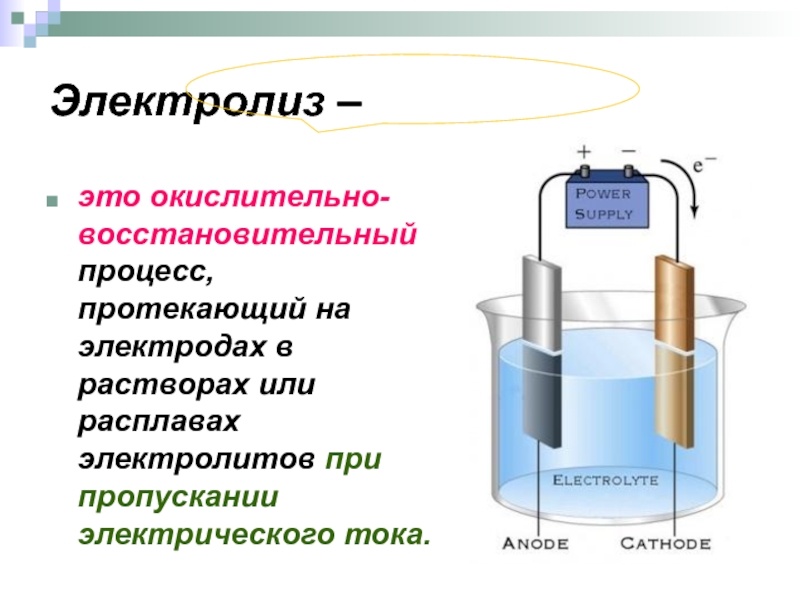
Слайд 41Электролиз –
это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах
Слайд 42Сущность электролиза
заключается в том, что за счет электрической энергии осуществляется химическая
Протекание первичных анодных и катодных процессов подчиняется законам, установленным английским ученым М Фарадеем (1834).
Слайд 46• В расплавах катионы металла восстанавливаются до свободного металла:
Мn+ + nē
На катоде происходит процесс восстановления
Электролиз в расплавах
Слайд 47
• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например:
2Cl– – 2ē = Cl20
• Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
SO42– – 2ē = SO20 + O20.
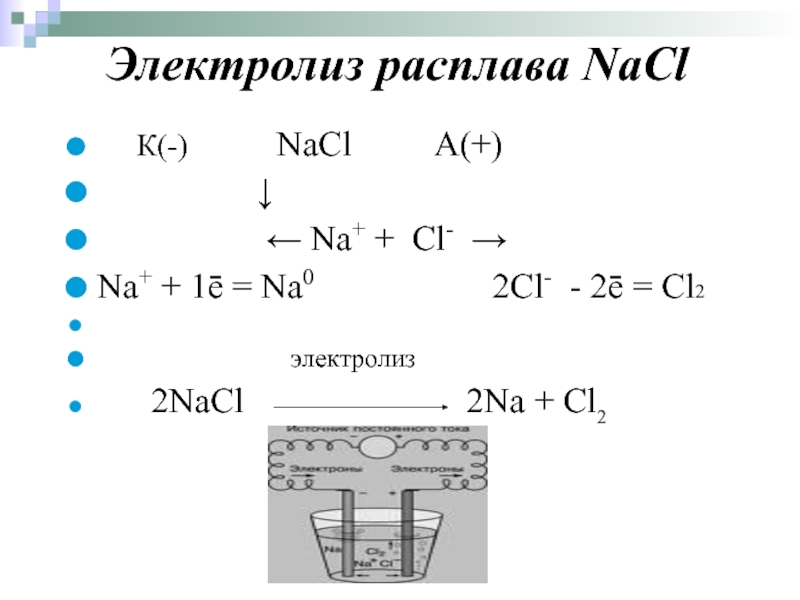
Слайд 48Электролиз расплава NaCl
К(-) NaCl А(+)
← Na+ + Cl- →
Na+ + 1ē = Na0 2Cl- - 2ē = Cl2
электролиз
2NaCl 2Na + Cl2
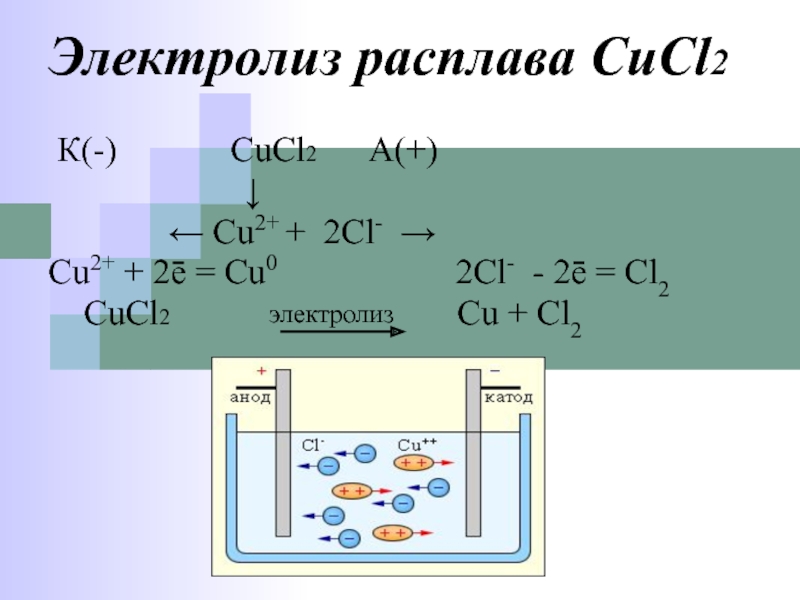
Слайд 49 К(-) CuCl2 А(+)
↓
Cu2+ + 2ē = Cu0 2Cl- - 2ē = Cl2
CuCl2 Cu + Cl2
Электролиз расплава CuCl2
электролиз
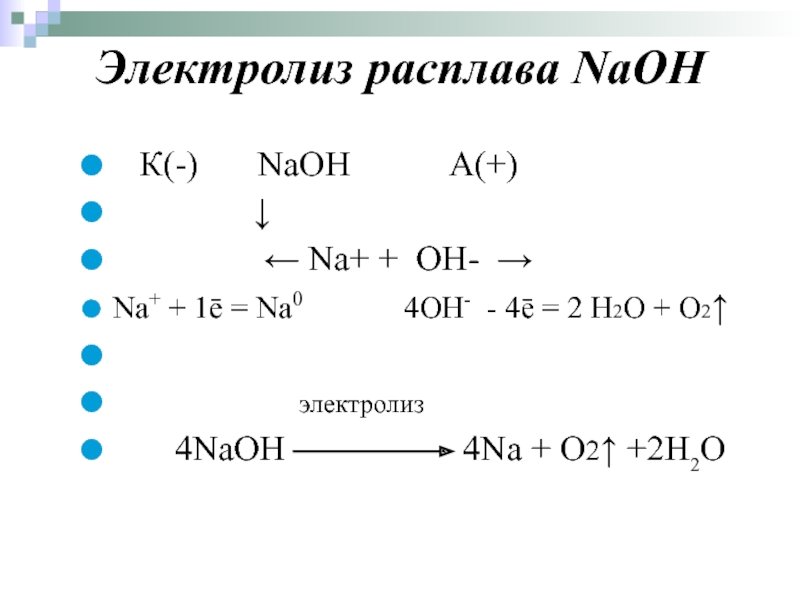
Слайд 50Электролиз расплава NaOH
К(-) NaOH А(+)
↓
← Na+ + OH- →
Na+ + 1ē = Na0 4OH- - 4ē = 2 H2O + O2↑
электролиз
4NaOH 4Na + O2↑ +2H2O
Слайд 51Электролиз в растворах
1)процесс на катоде
В растворах процесс на катоде не
а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды:
2Н2О + 2ē = H20 + 2OH–
Слайд 52
б) Если металл расположен в ряду напряжений между Al и H2 , то на катоде идут одновременно процессы восстановления воды и катионов металла:
2Н2О + 2ē = H20 + 2OH–
Мn+ + nē = М0
в) Если металл расположен в ряду напряжений после Н2, то на катоде идет процесс восстановления катионов металла:
Мn+ + nē = М0
При электролизе растворов кислот идет процесс восстановления ионов водорода:
2Н+ + 2ē = H20
Слайд 53Процесс на аноде
В растворах процесс на аноде зависит от
Аноды могут быть двух видов
– растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза)
- и нерастворимые, или инертные (уголь, графит, платина, золото)
а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
Слайд 54Процесс на аноде
б) Если анод инертный, то в случае бескислородных анионов
2Cl– – 2ē = Cl20
В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе:
2H2O – 4ē = O20 + 4H+
При электролизе растворов щелочей идет окисление гидроксид-ионов:
4OH– – 4ē = O20 + 2H2O
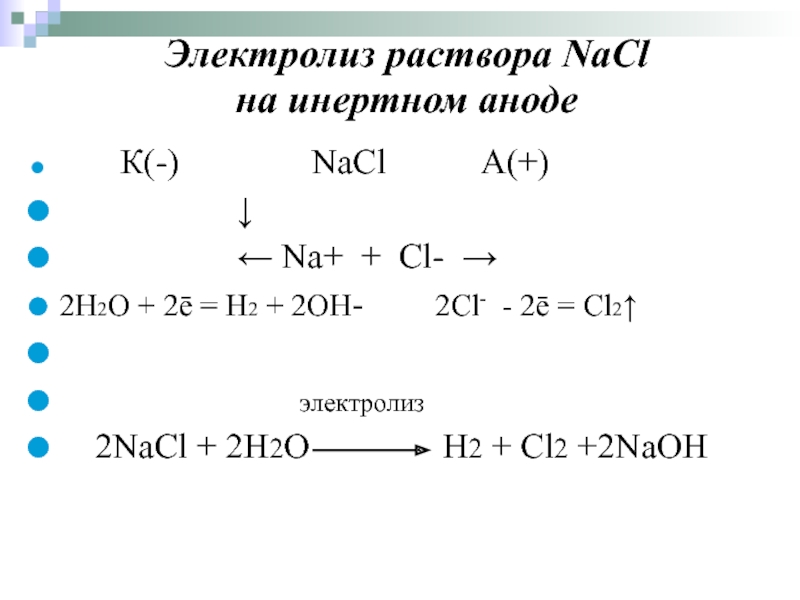
Слайд 55Электролиз раствора NaCl
К(-) NaCl А(+)
↓
← Na+ + Cl- →
2Н2О + 2ē = H2 + 2OH- 2Cl- - 2ē = Cl2↑
электролиз
2NaCl + 2H2O H2 + Cl2 +2NaOH
Слайд 56Электролиз раствора CuSO4
К(-) CuSO4 А(+)
↓
← Cu2+ + SO42- →
Cu2+ + 2ē = Cu0 2H2O – 4ē = O2↑ + 4H+
электролиз
2CuSO4 + 2 H2O 2Cu + O2 + 2 H2SO4
Слайд 57Электролиз раствора NaCl
К(-) NaCl А(+)
↓ (Cu)
← Na+ + Cl- →
Cu2+ + 2ē = Cu0 Cu0 – 2ē =Cu2+
(т.к. Cu2+ в ряду напряжений
стоят после H+)
Происходит переход ионов меди с анода на катод. Концентрация NaCl в растворе не меняется.
Слайд 59Коррозией называется процесс разрушения металлов вследствие химического или электрохимического взаимодействия их
Химическая коррозия
развивается в агрессивных средах, не проводящих электрического тока, например, газах при высоких температурах, Так, железо при нагревании соединяется с кислородом воздуха с образованием оксидов (окалины)
наблюдается в зубопротезировании в основном при изготовлении и починке протезов.
В условиях эксплуатации протезов может развиваться электрохимическая коррозия