- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Производство серной кислоты презентация
Содержание
- 1. Производство серной кислоты
- 2. Серная кислота H2SO4 : сильная двухосновная кислота, отвечающая высшей
- 3. бесцветная маслянистая жидкость Кислота серная техническая.
- 4. Структурная формула серной кислоты Сырьём
- 5. Основные стадии получения серной кислоты: Обжиг сырья
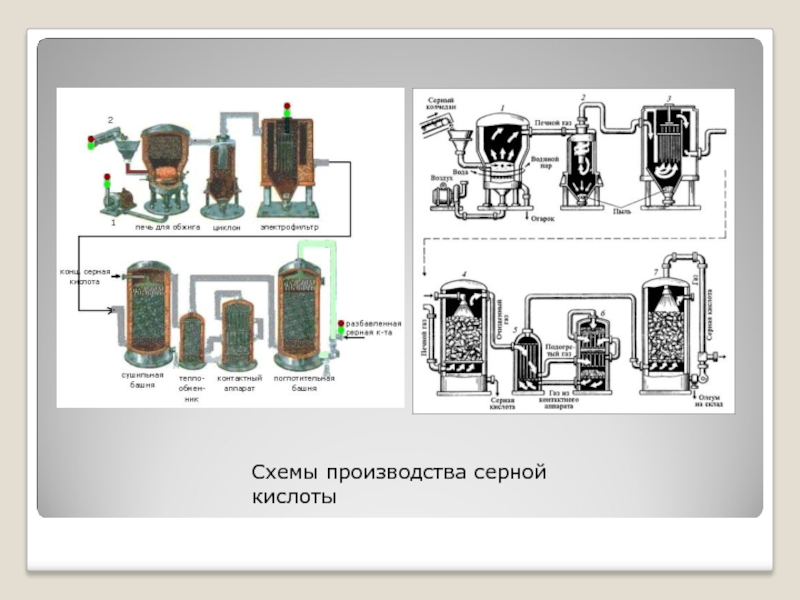
- 6. Схемы производства серной кислоты
- 7. реакции по производству серной кислоты из
- 8. При реакции SO3 с водой выделяется огромное количество
- 9. Естественные источники серной кислоты
- 10. установки очистки серной кислоты Производство серной кислоты
Слайд 1Презентация на тему
«Производство серной кислоты»
Выполнила:
Ученица 11 французского класса
Александрова Валентина
Слайд 2 Серная кислота H2SO4 :
сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
тяжёлая маслянистая жидкость без цвета и запаха
в технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
в технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Слайд 4
Структурная формула серной кислоты
Сырьём для получения серной кислоты служат
сера
сульфиды металлов
сероводород
отходящие газы теплоэлектростанций
сульфаты железа
кальция
Слайд 5Основные стадии получения серной кислоты:
Обжиг сырья с получением SO2
Окисление SO2 в SO3
Абсорбция SO3
В промышленности применяют
два метода окисления SO2 в производстве серной кислоты:
контактный — с использованием твердыхкатализаторов(контактов)
нитрозный — с оксидами азота.
контактный — с использованием твердыхкатализаторов(контактов)
нитрозный — с оксидами азота.
Слайд 7 реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде
ванадия (V).
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 (V2O5) → 2SO3
Нитрозный метод получения серной кислоты
SO2 + NO2 → SO3 + NO↑.
2NO+O2 → 2NO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 (V2O5) → 2SO3
Нитрозный метод получения серной кислоты
SO2 + NO2 → SO3 + NO↑.
2NO+O2 → 2NO2
Слайд 8При реакции SO3 с водой выделяется огромное количество теплоты и серная кислота начинает закипать
с образованием "туманов"
SO3 + H2O = H2SO4 + Q Поэтому SO3смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум
Получение серной кислоты из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси
2FeSO4·7H2O→Fe2O3+SO2+H2O+O2
SO2+H2O+O2 ⇆ H2SO4
SO3 + H2O = H2SO4 + Q Поэтому SO3смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум
Получение серной кислоты из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси
2FeSO4·7H2O→Fe2O3+SO2+H2O+O2
SO2+H2O+O2 ⇆ H2SO4
Слайд 10установки очистки серной кислоты
Производство серной кислоты на Бийском олеумном заводе
цеха по
производства серной кислоты концерна Стирол