меңгерушісі,
АҚШ академигі,х.ғ.д., профессор Әлиев Н.Ө.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация презентация
Содержание
- 1. Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
- 2. ДӘРІС ЖОСПАРЫ Адам термодинамикалық жүйе ретінде. Тірі
- 3. ТЕРМОДИНАМИКА. НЕІЗГІ ТҮСІНІКТЕРІ. Термодинамика – энергияның бір
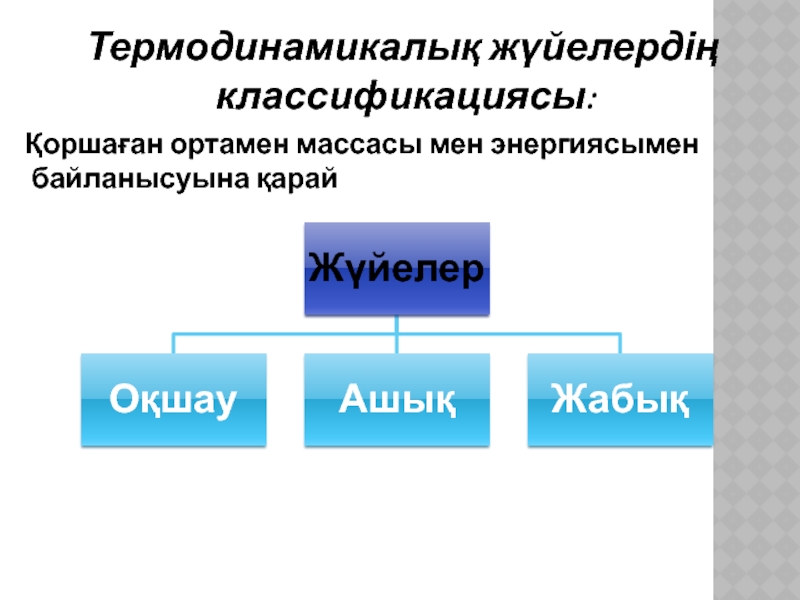
- 4. Термодинамикалық жүйелердің классификациясы: Қоршаған ортамен массасы мен энергиясымен байланысуына қарай
- 5. Интенсивті -
- 6. изохоралық процесс (V=const,ΔV=0) изобаралық процесс (р=const,Δp=0) Термодинамикалық
- 7. изотермиялық процесс (Т=const,ΔT=0) Термодинамикалық процесс - берілген
- 8. Ішкі энергия(U) – берілген жүйені құрайтын
- 9. Термодинамиканың бірінші бастамасы (энергияның сақталу және
- 10. ТЕРМОДИНАМИКАНЫҢ БІРІНШІ БАСТАМАСЫНЫҢ МАТЕМАТИКАЛЫҚ ТЕҢДЕУІ: Q=∆U+A
- 11. Энтальпия - тұрақты қысымдағы жүйенің энергиясы;
- 12. Энтропия (S)- жүйенің ретсіздіктің сандық өлшемі ретінде
- 13. Изобаралық-изотермиялық потенциал (Гиббстің бос энергиясы) dG-
- 14. Изобаралық-изотермиялық жағдайда термодинамикалық процестердің өздігінен жүру критерийлері: Процесс өздігінен жүреді dG0 (dH>0, dS
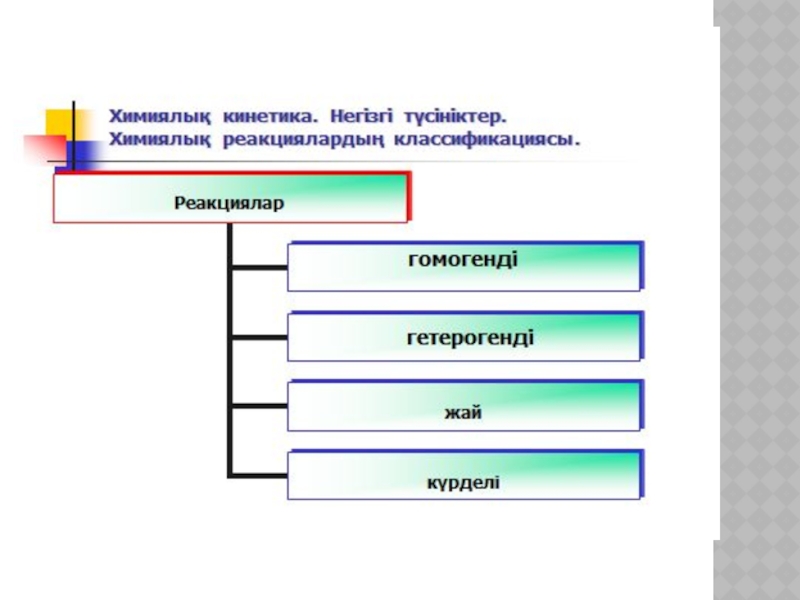
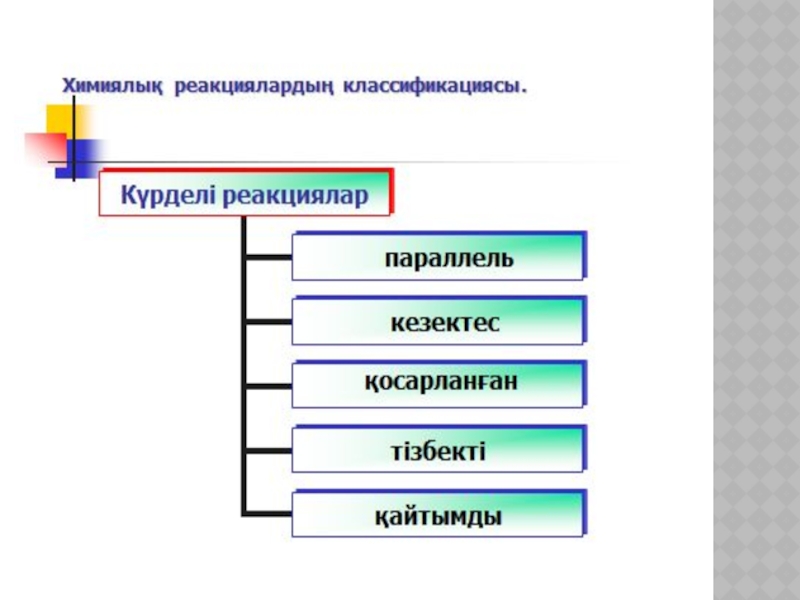
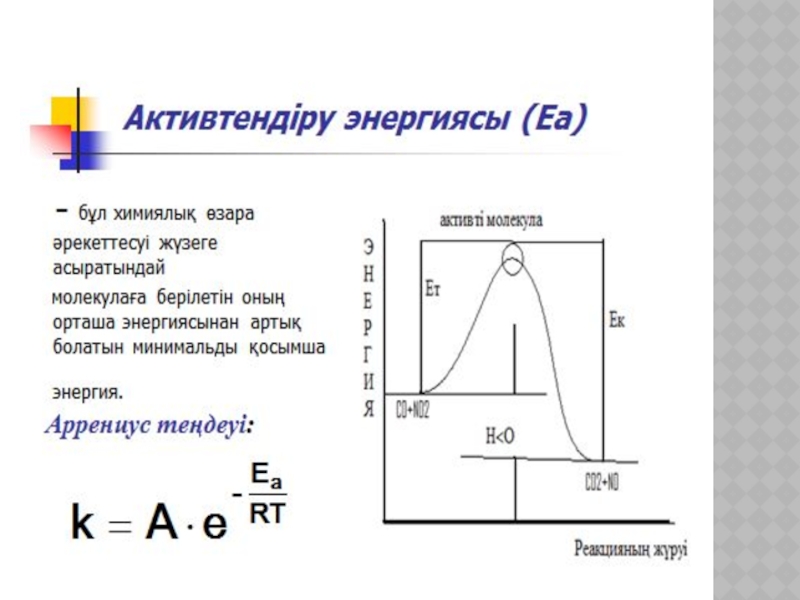
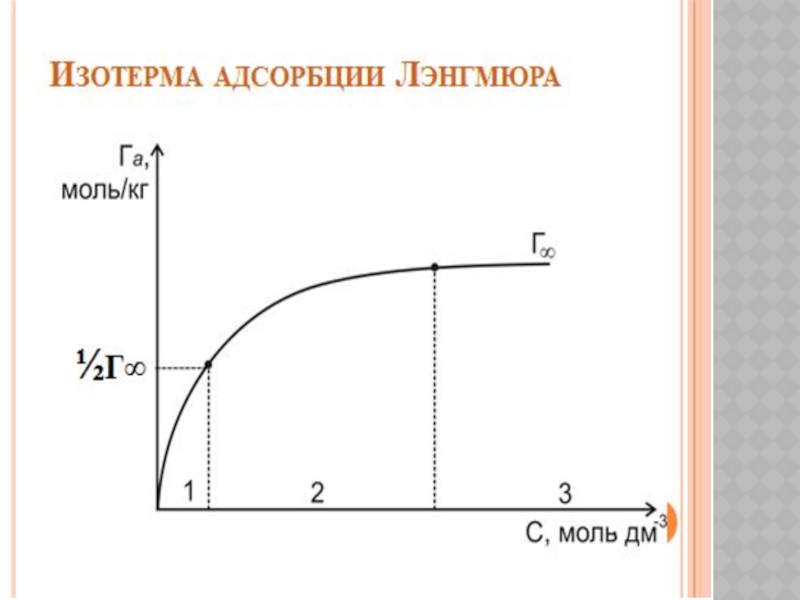
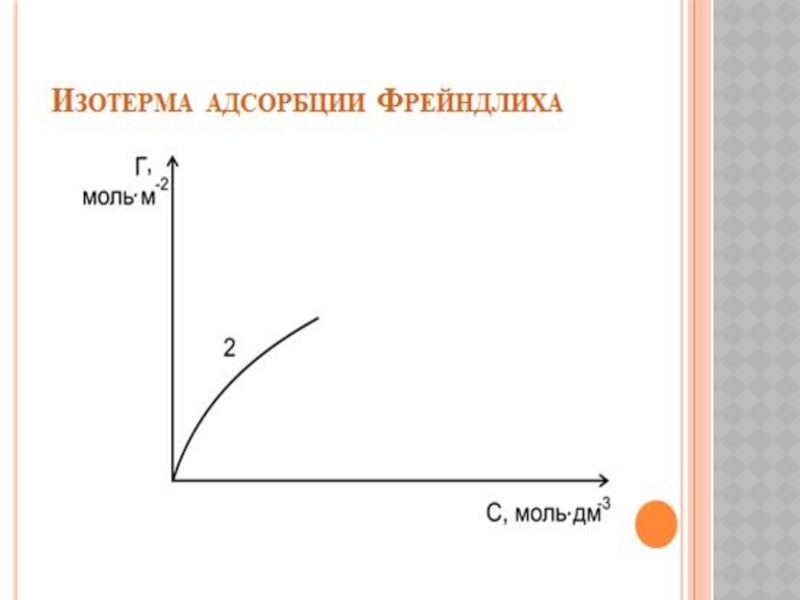
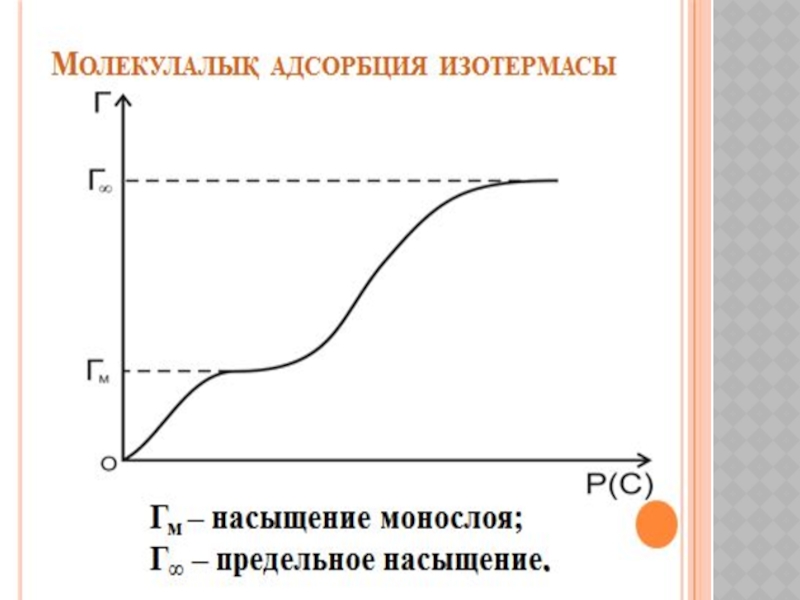
- 19. ХИМИЯЛЫҚ КИНЕТИКА ЖӘНЕ КАТАЛИЗ
Слайд 1С.Ж. АСФЕНДИЯРОВ АТЫНДАҒЫ ҚАЗҰМУ
ХИМИЯ КАФЕДРАСЫ
Тірі ағзада жүретін процесстер –
физика-химиялық интерпретация
Дәріскер:
кафедра
Слайд 2ДӘРІС ЖОСПАРЫ
Адам термодинамикалық жүйе ретінде. Тірі ағзаның термодинамикалық жүйе ретіндегі ерекшеліктері.
Пригожин принципі.
Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы.
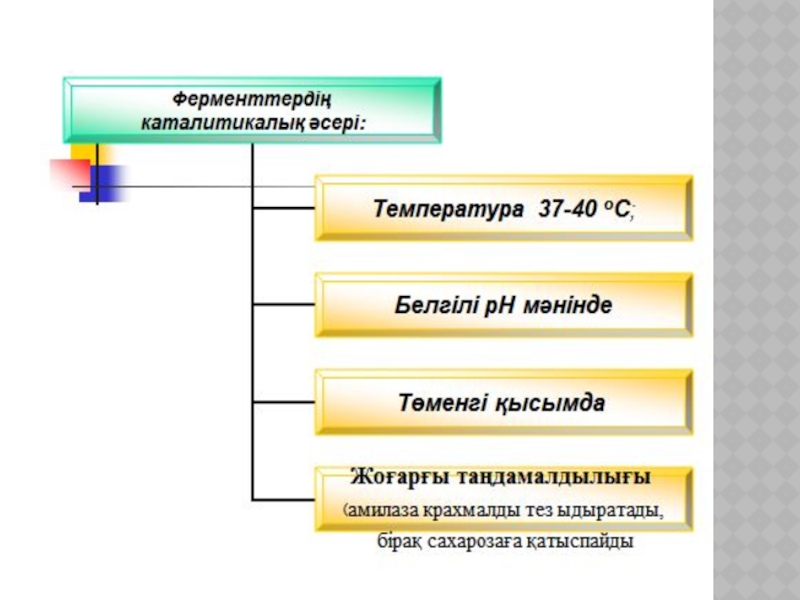
Тірі ағзадағы катализ. Ферменттер биохимиялық процестердің катализаторлары ретінде. Фермента-тивті реакциялар кинетикасының ерекшеліктері.
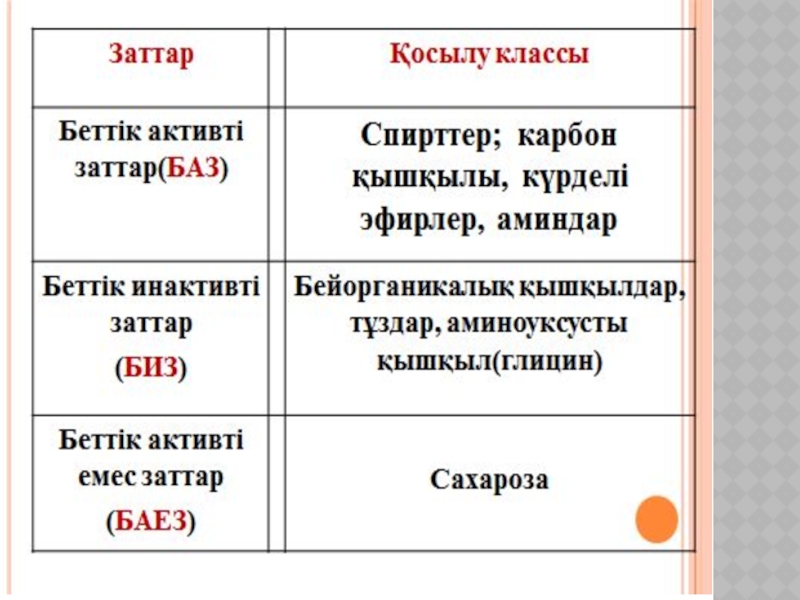
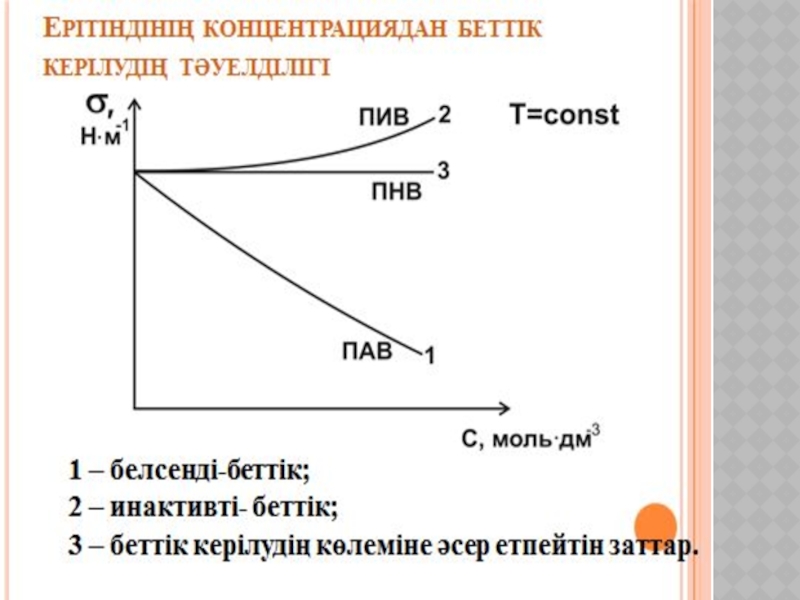
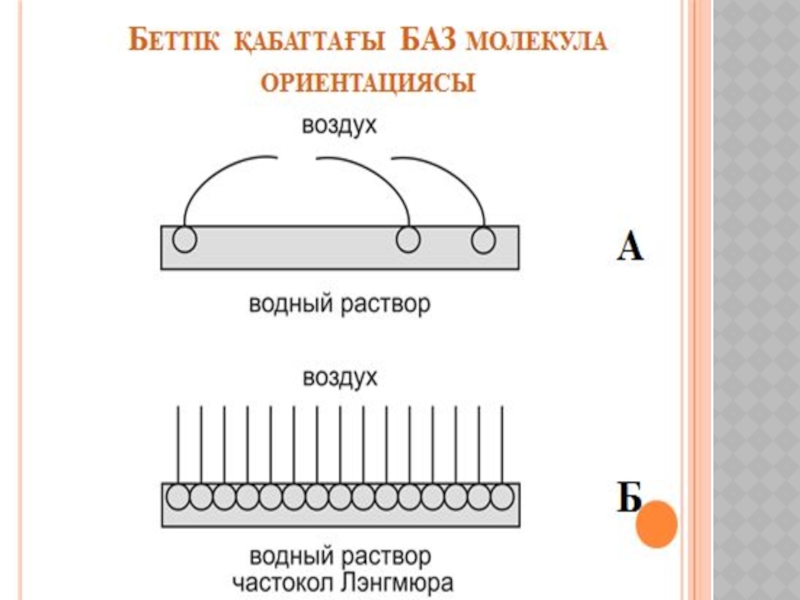
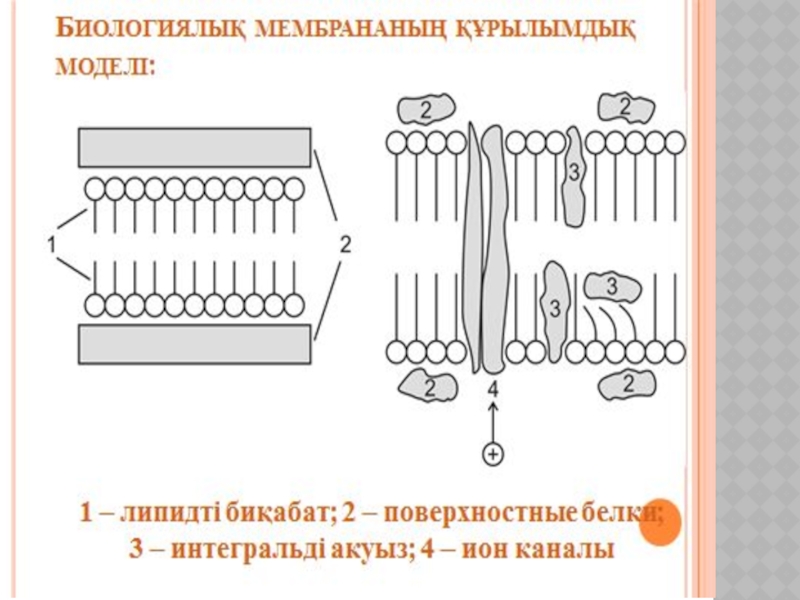
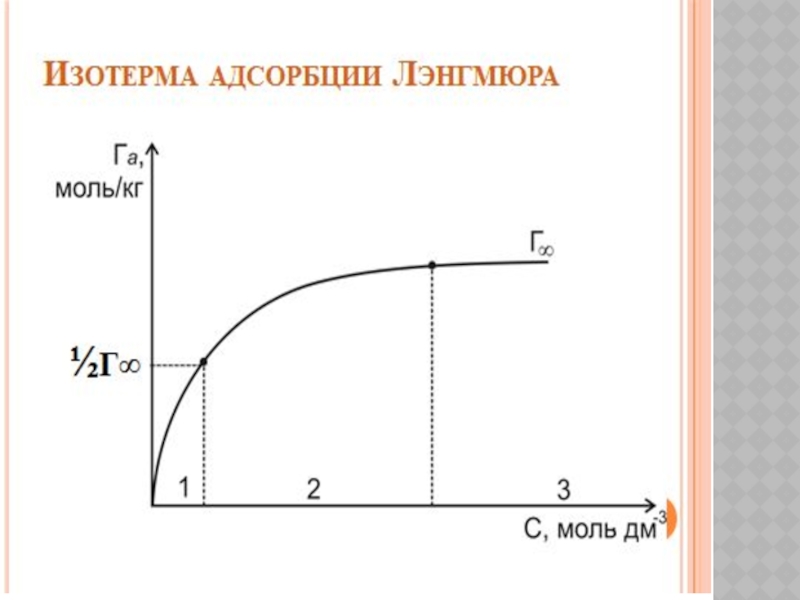
Беттік құбылыстар. Хроматография негіздері және оның медициналық-биологиялық зерттеулерде қолданылуы.
Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы.
Тірі ағзадағы катализ. Ферменттер биохимиялық процестердің катализаторлары ретінде. Фермента-тивті реакциялар кинетикасының ерекшеліктері.
Беттік құбылыстар. Хроматография негіздері және оның медициналық-биологиялық зерттеулерде қолданылуы.
Слайд 3ТЕРМОДИНАМИКА. НЕІЗГІ ТҮСІНІКТЕРІ.
Термодинамика – энергияның бір түрінен екінші түріне ауысуын зерттейтін
ғылым, яғни химиялық тұрғыдан термодинамика – тірі ағзадағы зат және энергия алмасу процестерін зерттейді.
Термодинамиканың бірінші заңы – энергияның бір түрден екінші түрге берілуі және энергияның сақталу заңы. Энтальпия.
Термодинамиканың екінші заңы термодинамикалық процестің жүру бағытын сипаттайды. Энтропия.
Термодинамиканың бірінші заңы – энергияның бір түрден екінші түрге берілуі және энергияның сақталу заңы. Энтальпия.
Термодинамиканың екінші заңы термодинамикалық процестің жүру бағытын сипаттайды. Энтропия.
Слайд 4 Термодинамикалық жүйелердің классификациясы:
Қоршаған ортамен массасы мен энергиясымен байланысуына қарай
Слайд 5
Интенсивті - термодинамикалық жүйенің өлшеміне тәуелсіз шамалар
Температура, қысым, концентрация, жылу сыйымдылық, химиялық потенциал және т.б.
Экстенсивті - термодинамикалық жүйенің өлшеміне тәуелді шамалар:
Көлем, масса, зат мөлшері, ішкі энергия, энтальпия, энтропия, Гиббс энергиясы
және т.б.
Экстенсивті - термодинамикалық жүйенің өлшеміне тәуелді шамалар:
Көлем, масса, зат мөлшері, ішкі энергия, энтальпия, энтропия, Гиббс энергиясы
және т.б.
Слайд 6изохоралық процесс (V=const,ΔV=0)
изобаралық процесс (р=const,Δp=0)
Термодинамикалық процесс - берілген жүйені сипаттайтын қандай-да
бір параметрдің қайтымды немесе қайтымсыз өзгеруімен жүретін жүйенің бір күйінен екінші күйіне ауысуы:
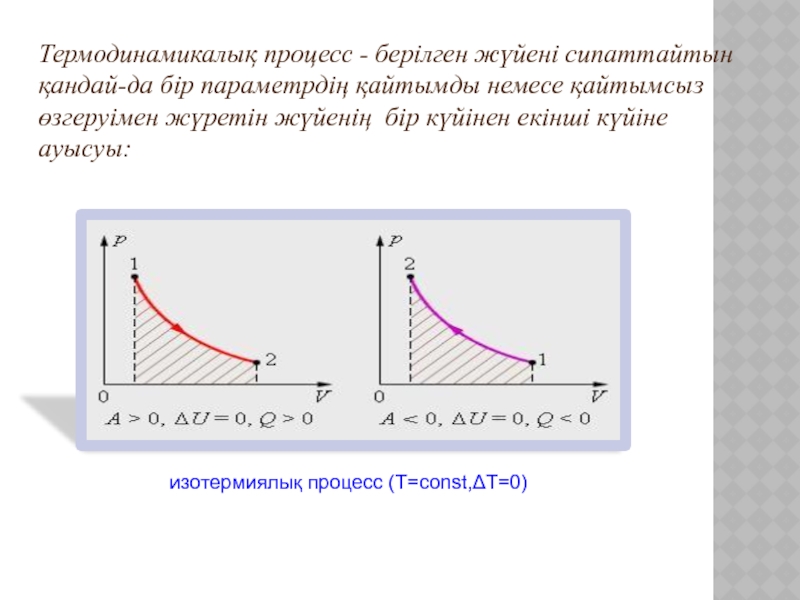
Слайд 7изотермиялық процесс (Т=const,ΔT=0)
Термодинамикалық процесс - берілген жүйені сипаттайтын қандай-да бір параметрдің
қайтымды немесе қайтымсыз өзгеруімен жүретін жүйенің бір күйінен екінші күйіне ауысуы:
Слайд 8 Ішкі энергия(U) – берілген жүйені құрайтын бөлшектердің қозғалыстары мен өзара
әрекеттесулерінің барлық түрлерін қамтитын энергияның толық қоры;
жүйенің барлық бөлшектерінің: молекулалар, атомдар,иондар,электрондар,протондар және т.б. қозғалыс,айналу,тербеліс қимылдарының энергиясы;
бөлшектердің күштік өзара әрекеттесуінің энергиясы (электромагниттік,гравитациялық және т.б.)
Энергияның мүмкін болатын басқа түрлері.
ΔU=U2 –U1
жүйенің барлық бөлшектерінің: молекулалар, атомдар,иондар,электрондар,протондар және т.б. қозғалыс,айналу,тербеліс қимылдарының энергиясы;
бөлшектердің күштік өзара әрекеттесуінің энергиясы (электромагниттік,гравитациялық және т.б.)
Энергияның мүмкін болатын басқа түрлері.
ΔU=U2 –U1
Слайд 9Термодинамиканың бірінші бастамасы
(энергияның сақталу және айналу заңы):
Термодинамикалық жүйенің бір күйінен
екінші күйіне өткенде энергия ешқайдан пайда болмайды және ешқайда жоғалып кетпейді,бір түрінен екінші түріне қатаң эквивалентті мөлшерде айналады.
жүйе
қоршаған дене
Слайд 10ТЕРМОДИНАМИКАНЫҢ БІРІНШІ БАСТАМАСЫНЫҢ МАТЕМАТИКАЛЫҚ ТЕҢДЕУІ:
Q=∆U+A
Q - жүйеге берілетін жылу;
∆U-жүйенің
ішкі энергиясының өзгерісі;
A-термодинамикалық жүйенің сыртқы күшке қарсы атқаратын жұмысы.
A-термодинамикалық жүйенің сыртқы күшке қарсы атқаратын жұмысы.
Слайд 11 Энтальпия - тұрақты қысымдағы жүйенің энергиясы; энтальпия сандық жағынан ішкі
энергия U мен потенциалдық энергияның pV қосындысына тең.
Реакция энтальпиясы(∆Нr)- изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері.
Реакция энтальпиясы(∆Нr)- изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері.
Слайд 12Энтропия (S)- жүйенің ретсіздіктің сандық өлшемі ретінде термодинамикалық функция болып табылады,
ретсіздік артқан сайын жоғарылайды.
Энтропия мен термодинамикалық мүмкіндік арасындағы байланыс (Больцман):
S=k lnWi ,мұндағы
W- термодинамикалық мүмкіндік;
k- Больцман тұрақтысы.
Энтропия мен термодинамикалық мүмкіндік арасындағы байланыс (Больцман):
S=k lnWi ,мұндағы
W- термодинамикалық мүмкіндік;
k- Больцман тұрақтысы.
Слайд 13Изобаралық-изотермиялық потенциал
(Гиббстің бос энергиясы) dG- термодинамикалық жүйенің күй функциясы, қайтымды
изотермиялық процесте жүйе атқара алатын жұмысқа абсолютті мәні бойынша тең және таңбасына қарама-қарсы.
Слайд 14 Изобаралық-изотермиялық жағдайда термодинамикалық процестердің өздігінен жүру критерийлері:
Процесс өздігінен жүреді
dG
(dH<0, dS>0)
Процесс өздігінен жүре алмайды dG>0 (dH>0, dS<0)
Термодинамикалық тепе-теңдік күйі dG=0
Процесс өздігінен жүре алмайды dG>0 (dH>0, dS<0)
Термодинамикалық тепе-теңдік күйі dG=0