- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Поверхностные явления. Адсорбция презентация
Содержание
- 1. Поверхностные явления. Адсорбция
- 2. Поверхностные явления – это явления, происходящие на
- 4. Молекулы поверхностного слоя обладают некоторым избытком энергии
- 5. Поверхностное натяжение – это сила, стягивающая гипотетическую
- 6. Из определения следует: G = σ∙s σ
- 7. Поверхностное натяжение измеряют следующими способами: - измерение
- 9. С повышением температуры поверхностное натяжение уменьшается и
- 10. 2. Адсорбция. Основные понятия и определения. Виды
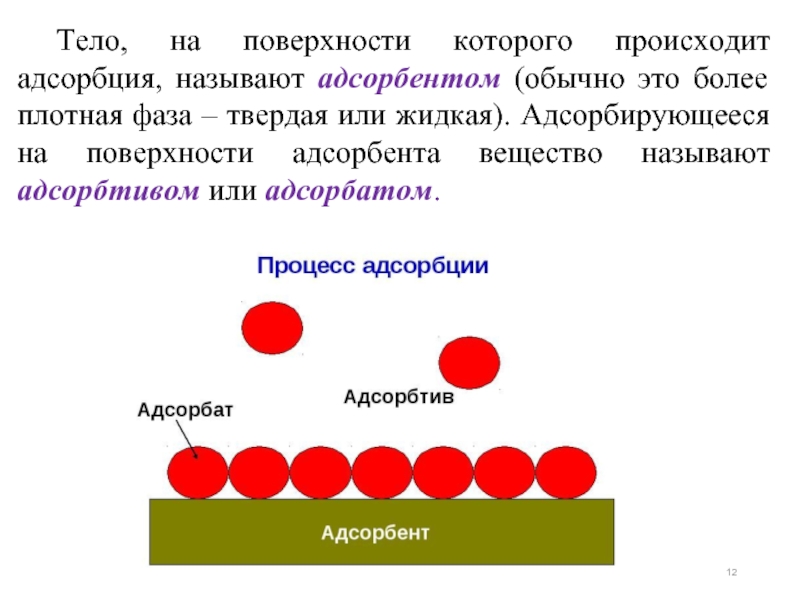
- 12. Тело, на поверхности которого происходит адсорбция, называют
- 13. Измеряют адсорбцию как количество адсорбата, отнесенное к
- 14. Из второго закона термодинамики следует, адсорбция протекает
- 15. Термодинамический смысл процесса адсорбции: Вблизи поверхности твердого
- 16. В зависимости от агрегатных состояний адсорбента и
- 17. Если процесс перехода вещества из объема фазы
- 18. Если растворенное вещество не изменяет σ адсорбция
- 20. При адсорбции одновременно протекают как физические, так
- 22. Применение адсорбции: для очистки газовых промышленных выбросов
- 23. 3. Адсорбция на границе раствор-газ Процесс адсорбции
- 24. Из уравнения следует, что если: (с повышением
- 25. Значение производной dσ/dC, взятой с обратным знаком
- 26. Графический метод определения адсорбции Находят экспериментально зависимость
- 29. 4. Классификация веществ по поверхностной активности. Правило
- 30. Большой поверхностной активностью обладают вещества дифильного строения
- 33. ПАВ адсорбируются на поверхности раздела фаз, ориентируясь полярной частью к полярной среде, неполярной – неполярной.
- 35. Классификация ПАВ по типу гидрофильных групп
- 36. -По типу гидрофильных групп различают неионные (неионогенные) и ионные (ионогенные) ПАВ. Неионогеные
- 37. Анионактивные ПАВ: карбоновые кислоты и их соли
- 38. Поверхностно-инактивные вещества – это вещества, добавление которых
- 39. Поверхностно-неактивные вещества – это вещества, добавление которых
- 41. При экспериментальном изучении адсорбции на границе жидкость-газ
- 42. Правило выполняется при следующих условиях: при комнатной
- 43. Адсорбция газов и жидкостей на поверхности твердого
- 44. Основные положение теории Ленгмюра: 1). Поверхность адсорбента ограничена.
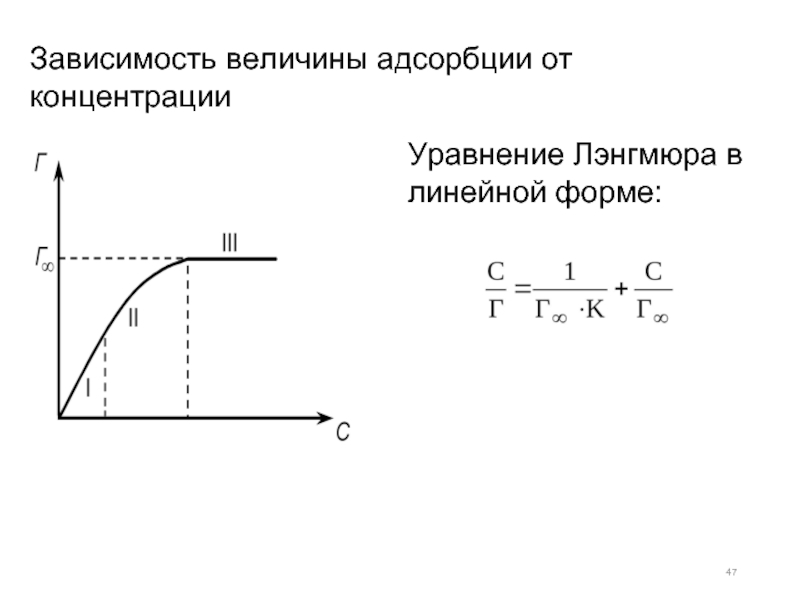
- 45. Уравнение изотермы мономолекулярной адсорбции Ленгмюра имеет вид:
- 46. Уравнение Лэнгмюра для адсорбции из растворов: где
- 47. Зависимость величины адсорбции от концентрации Уравнение Лэнгмюра в линейной форме:
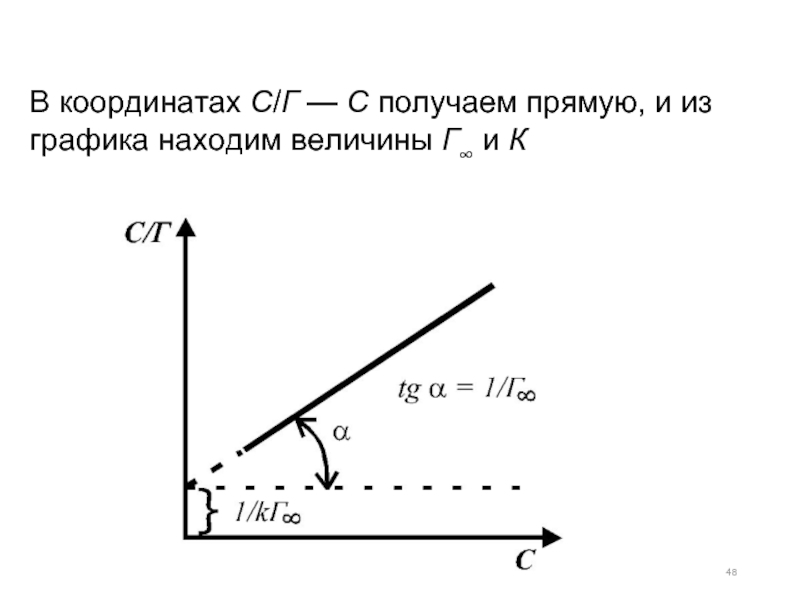
- 48. В координатах С/Г — С получаем прямую, и из графика находим величины Г∞ и К
- 49. Уравнением Фрейндлиха Адсорбция из растворов может быть
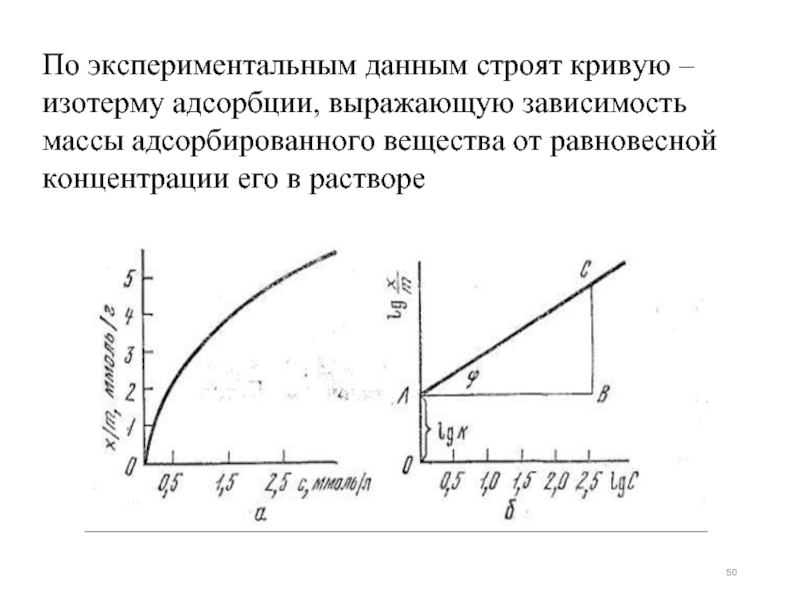
- 50. По экспериментальным данным строят кривую – изотерму
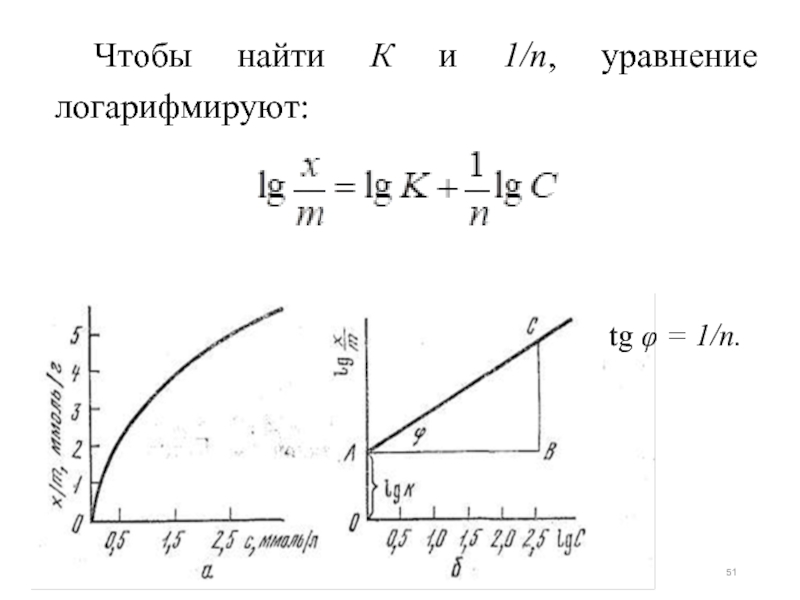
- 51. Чтобы найти К и 1/n, уравнение логарифмируют: tg φ = 1/n.
- 52. Полимолекулярная адсорбция (теория БЭТ). Основные положения.
- 53. Адсорбция из растворов электролитов Адсорбция из водных
- 54. Обменная адсорбция представляет собой процесс обмена ионов между
- 55. При специфической адсорбции адсорбция на поверхности твердой фазы ионов
- 56. Пример. Рассмотрим адсорбцию ионов раствора КI на
- 58. Если кристаллы AgI находятся в контакте с
- 59. Мицеллообразование в растворах ПАВ Под мицеллой (МЦ) ПАВ понимают ассоциат
- 60. Критическая концентрация мицеллообразования (ККМ) — концентрация поверхностно-активного вещества в растворе, при которой образуются устойчивые мицеллы.
- 61. Растворы МЦобразующих ПАВ делят на 2 группы:
- 62. При увеличении концентрации СПАВ мицеллы проходят ряд равновесных состояний,
- 64. При ↑ концентрации СПАВ, превышающую ККМ в
- 65. Мицеллы ионогенных ПАВ обычно заряжены, их заряд
- 66. Явление растворения веществ в МЦПАВ называется солюбилизацией.
- 67. Способы включения в водных растворах солюбилизата : 1)
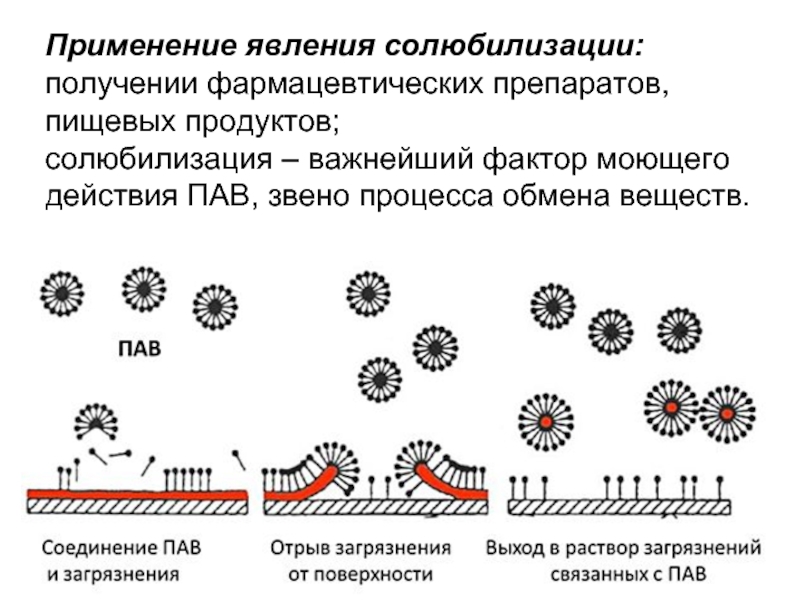
- 68. Применение явления солюбилизации: получении фармацевтических препаратов, пищевых
Слайд 2Поверхностные явления – это явления, происходящие на поверхности, на границе раздела
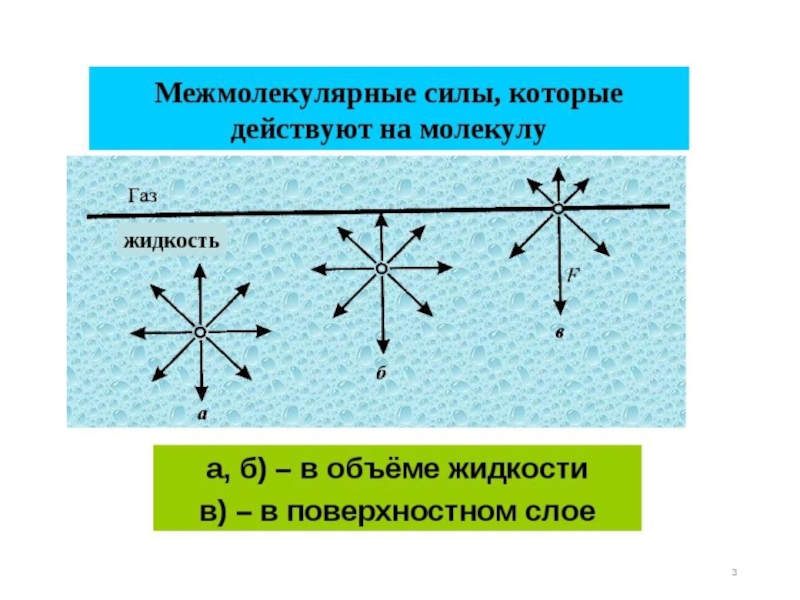
1. Особенности поверхностного слоя вещества. Поверхностное натяжение
Слайд 4Молекулы поверхностного слоя обладают некоторым избытком энергии по сравнению со внутренними,
Свободная энергия молекул поверхности площадью 1 м2 называется удельной поверхностной энергией или поверхностным натяжением (σ).
Слайд 5Поверхностное натяжение – это сила, стягивающая гипотетическую пленку на поверхности жидкости
Увеличение поверхности сопровождается ростом поверхностной энергии, поэтому жидкость стремится к уменьшению своей поверхности (стремится к форме шара).
Другое определение σ:
Слайд 6Из определения следует:
G = σ∙s
σ = [Дж/м2=Н∙м/м2= Н/м] – поверхностное натяжение;
s
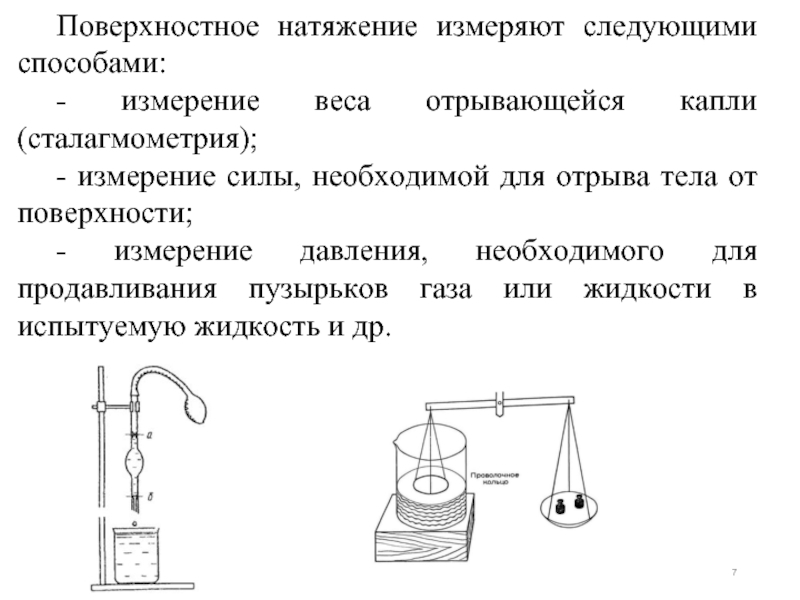
Слайд 7Поверхностное натяжение измеряют следующими способами:
- измерение веса отрывающейся капли (сталагмометрия);
- измерение
- измерение давления, необходимого для продавливания пузырьков газа или жидкости в испытуемую жидкость и др.
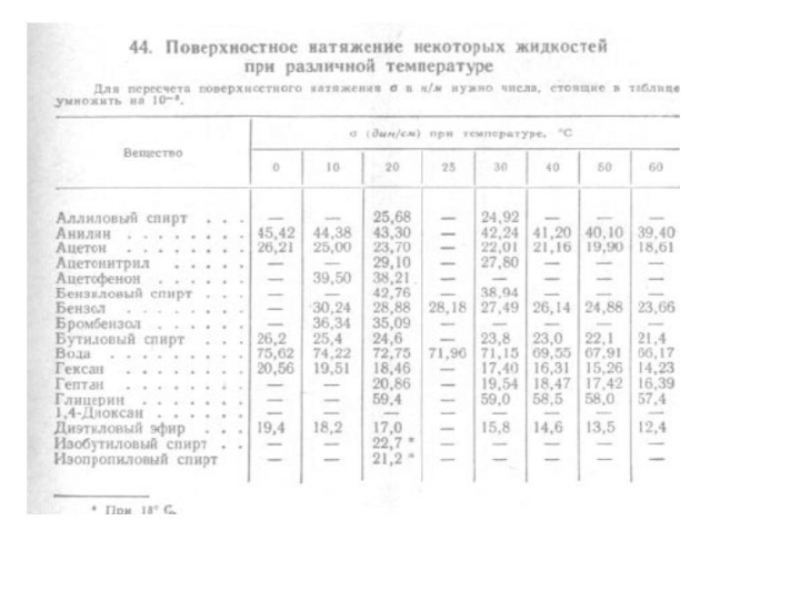
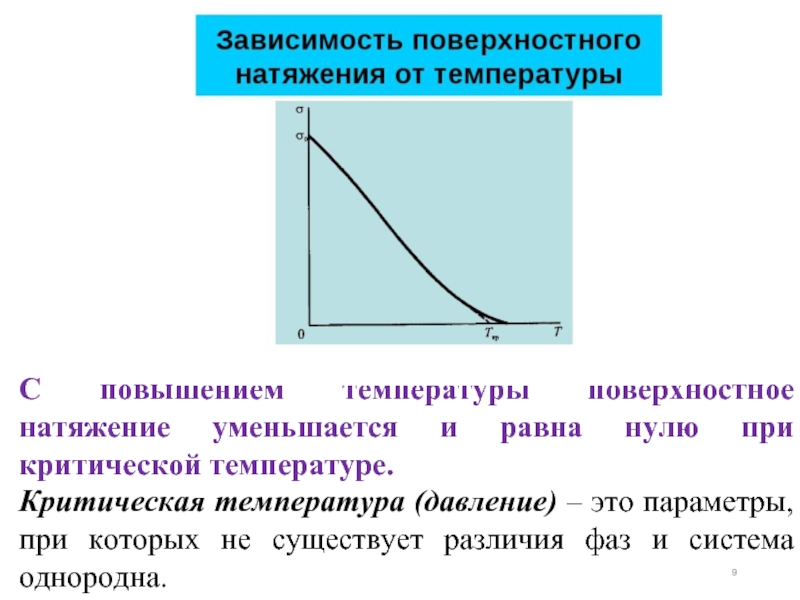
Слайд 9С повышением температуры поверхностное натяжение уменьшается и равна нулю при критической
Критическая температура (давление) – это параметры, при которых не существует различия фаз и система однородна.
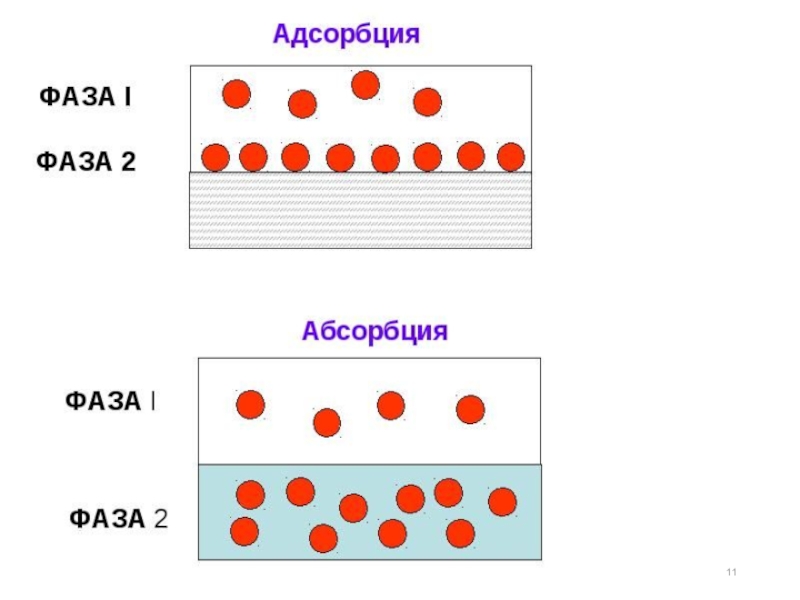
Слайд 102. Адсорбция. Основные понятия и определения. Виды адсорбции и их применение
Адсорбция
Адсорбция зависит от природы вещества, температуры и концентрации вещества в объеме.
Слайд 12Тело, на поверхности которого происходит адсорбция, называют адсорбентом (обычно это более
Слайд 13Измеряют адсорбцию как количество адсорбата, отнесенное к единице площади или массы
Г (гамма) = кмоль/м2; кмоль/кг; кг/м2; кг/кг
Слайд 14Из второго закона термодинамики следует, адсорбция протекает самопроизвольно в случае, если
∆G < 0
или ∆G = ∆ (σs) < 0
Данное условие выполняется при уменьшении поверхностного натяжения ∆ σ < 0
Вывод: адсорбция возможна и протекает самопроизвольно, если данный процесс идет с уменьшением свободной поверхностной энергии, что достигается за счет уменьшения величины поверхностного натяжения
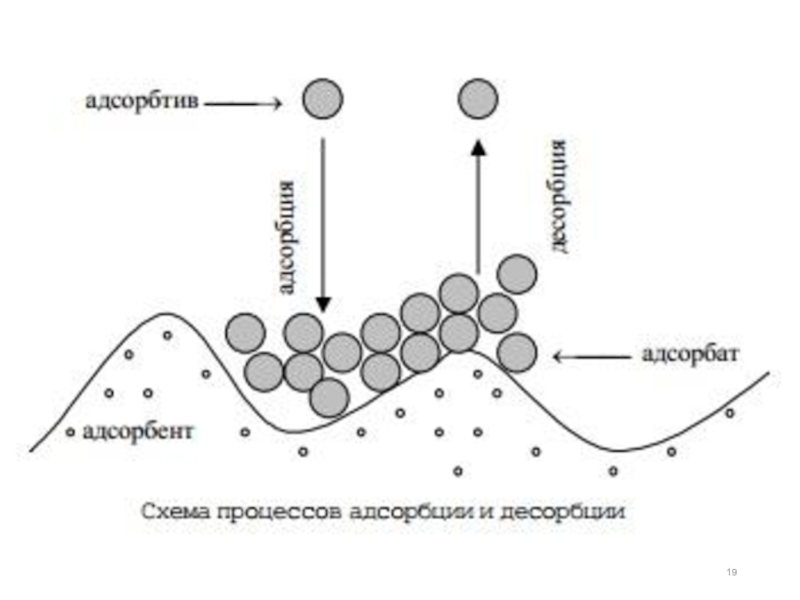
Слайд 15Термодинамический смысл процесса адсорбции: Вблизи поверхности твердого тела или жидкости в
Вследствие концентрирования частиц адсорбтива на поверхности раздела фаз происходит уменьшение свободной поверхностной энергии.
Слайд 16В зависимости от агрегатных состояний адсорбента и адсорбтива различают следующие виды
- адсорбция газа на твердых адсорбентах;
- адсорбция растворенных веществ на границе твердое тело–жидкость и жидкость–жидкость;
- адсорбция на границе жидкий раствор–газ.
Слайд 17Если процесс перехода вещества из объема фазы к поверхности сопровождается снижением
∆ σ < 0
Г > 0 – адсорбция положительная
Если процесс перехода вещества из объема фазы к поверхности сопровождается увеличением величины σ, то вещество будет самопроизвольно переходить с поверхности вглубь.
Это отрицательная адсорбция или десорбция:
∆ σ > 0
Г < 0 – адсорбция отрицательная (десорбция)
Слайд 18Если растворенное вещество не изменяет σ адсорбция Г=0 и вещество равномерно
∆ σ < 0
Г= 0
Слайд 20При адсорбции одновременно протекают как физические, так и химические взаимодействия. В
1. Физическая адсорбция
2. Химическая адсорбция (хемосорбция)
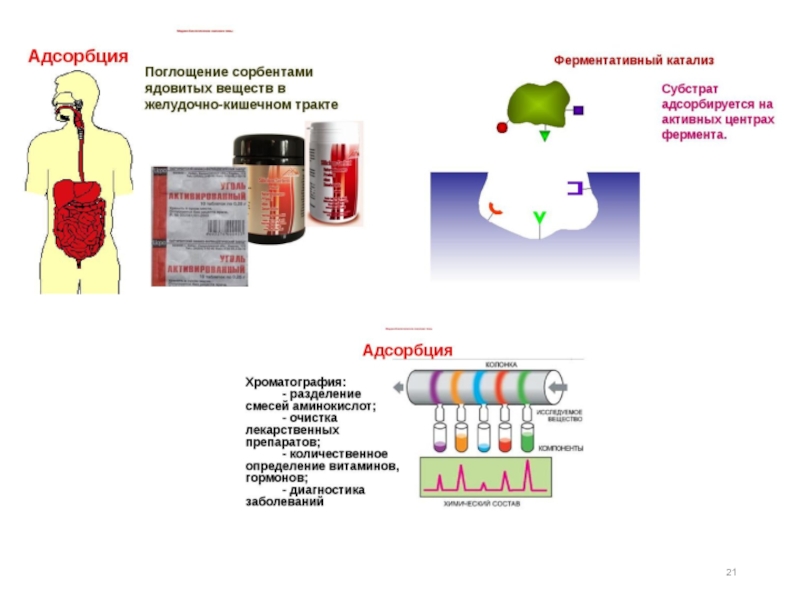
Слайд 22Применение адсорбции:
для очистки газовых промышленных выбросов от вредных примесей (SO2, SH2
очистка воды (фильтры);
адсорбция сопровождает любые гетерогенные химические реакции, в том числе гетерогенный катализ;
в лабораторной практике для разделения и анализа смесей (хроматография);
в природных процессах. Например, при дыхании кислород адсорбируется на поверхности легких. Углекислый газ адсорбируется на поверхности листа;
иммобилизация ферментов;
в быту (мытье рук, стирка).
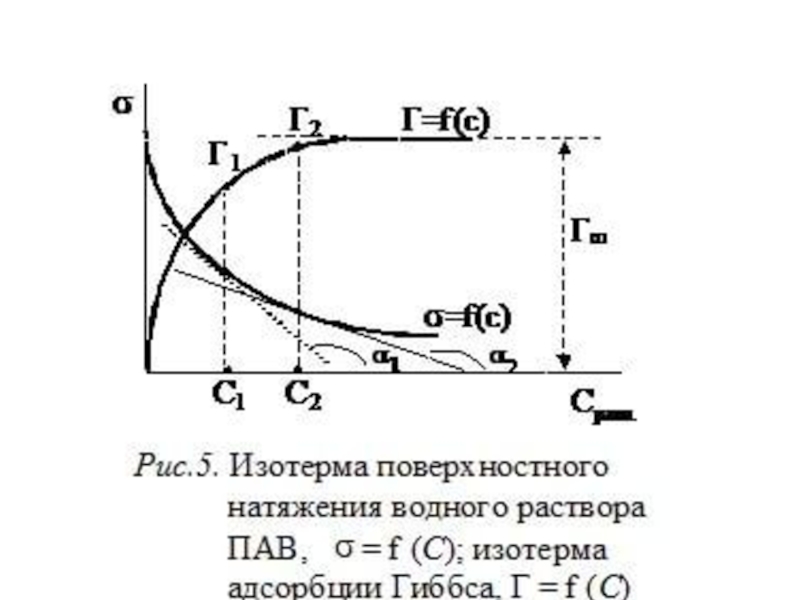
Слайд 233. Адсорбция на границе раствор-газ
Процесс адсорбции на границе описывается уравнение изотермы
С – равновесная концентрация адсорбтива в объеме фазы, граничащей с адсорбирующей поверхностью, моль/ м3;
σ – поверхностное натяжение, Н/м;
R – универсальная газовая постоянная
Слайд 24Из уравнения следует, что если:
(с повышением концентрации σ
то Г>0 – адсорбция идет
(с повышением концентрации σ увеличивается),
то Г<0 – десорбция
< 0
> 0
Чем выше температура, тем меньше адсорбция.
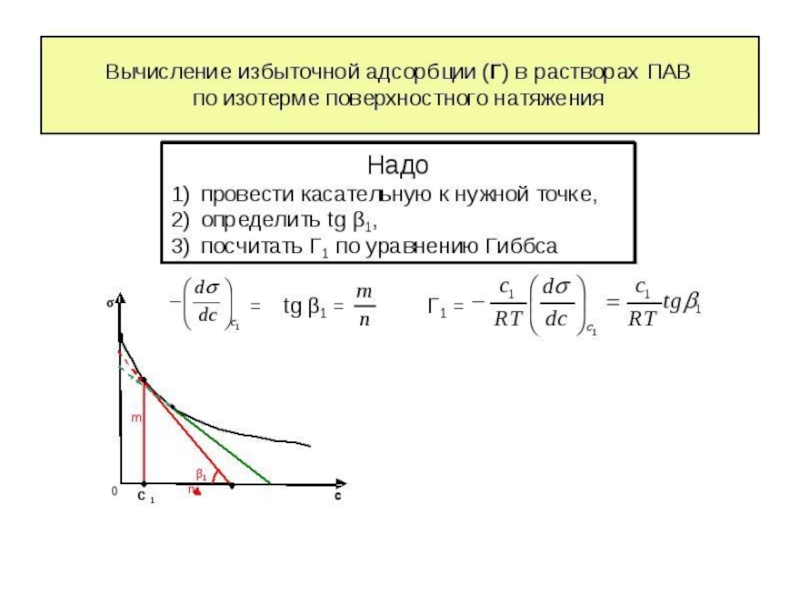
Слайд 25Значение производной dσ/dC, взятой с обратным знаком называется, поверхностной активностью (g):
g = - dσ/dC
Поверхностная активность является важнейшей адсорбционной характеристикой вещества, определяющей их свойства и области применения.
Слайд 26Графический метод определения адсорбции
Находят экспериментально зависимость σ = f (C) (изотерма
Проводят графическое дифференцирование зависимости σ = f (C). Для этого в нескольких точках кривой σ = f (C) проводят касательные и определяют тангенс угла наклона по отношению к оси х, которые соответствуют значениям производной dσ/dC в данных точках
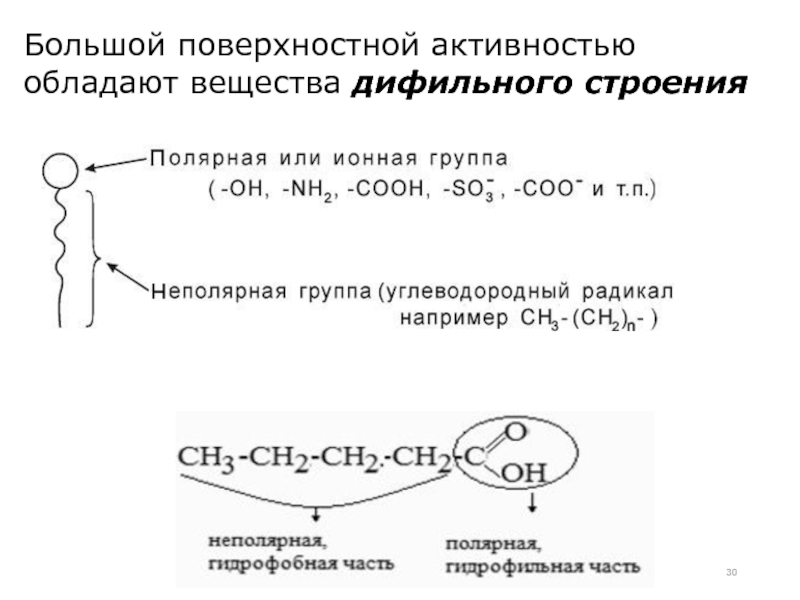
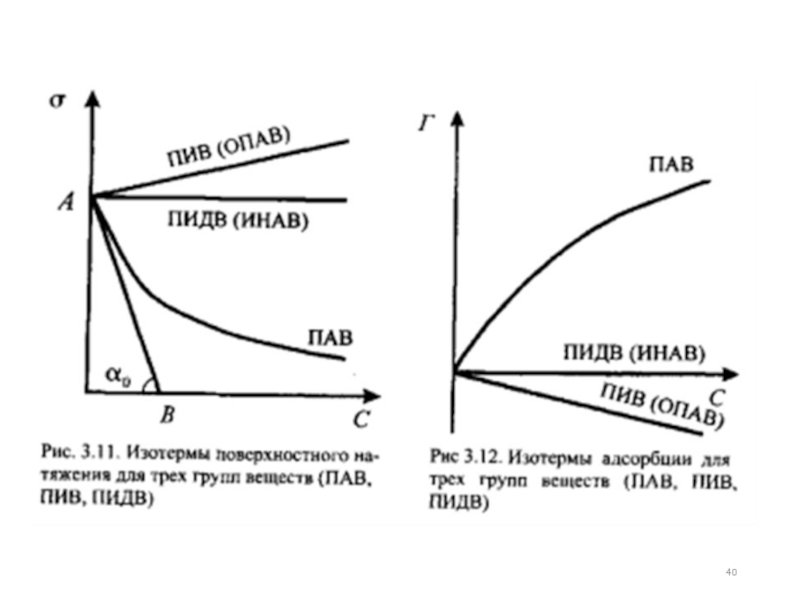
Слайд 294. Классификация веществ по поверхностной активности. Правило Дюкло-Траубе
Поверхностно-активные вещества – это
< 0
g > 0
Г > 0
Например: Спирты, жирные кислоты, сложные эфиры, липиды, белки, мыла
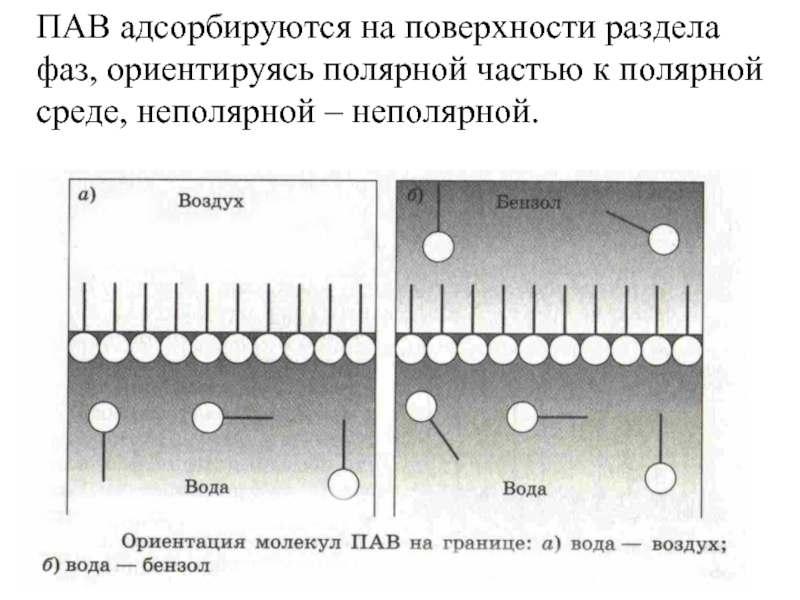
Слайд 33ПАВ адсорбируются на поверхности раздела фаз, ориентируясь полярной частью к полярной
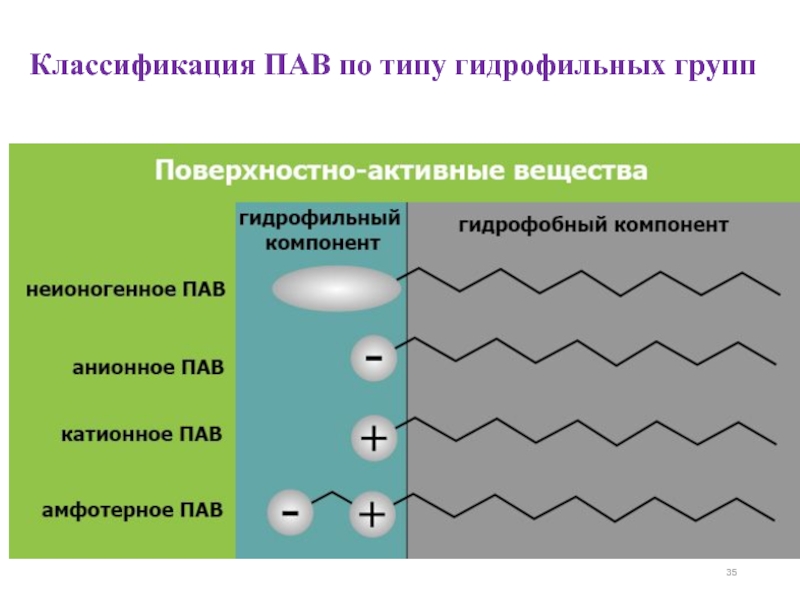
Слайд 36-По типу гидрофильных групп различают неионные (неионогенные) и ионные (ионогенные) ПАВ.
Неионогеные существуют в растворе в виде
Ионогенные диссоциируют в растворе на ионы, одни их которых собственно и обладают поверхностной активностью, а другие - нет. В зависимости от знака заряда поверхностно-активного иона ПАВ делят на катион-активные, анион-активные и амфотерные.
Слайд 37Анионактивные ПАВ: карбоновые кислоты и их соли (мыла), алкилсульфаты, алкилсульфонаты, алкиларилсульфонаты,
Катионактивные ПАВ: производные алкиламинов, первичных, вторичных и третичных.
Амфотерные ПАВ: аминокислоты, белки. К катионактивным ПАВ относятся и многие алкалоиды
Слайд 38Поверхностно-инактивные вещества – это вещества, добавление которых к жидкости увеличивает ее
> 0
g < 0
Г < 0
Например: Неорганические кислоты, основания, соли, глицерин, аминокислоты
Слайд 39Поверхностно-неактивные вещества – это вещества, добавление которых к жидкости не изменяет
= 0
g = 0
Г = 0
Например: Сахароза
Слайд 41При экспериментальном изучении адсорбции на границе жидкость-газ Дюкло и Траубе установили
поверхностная активность в гомологическом ряду карбоновых кислот, аминов, спиртов возрастает в 3,2 раза при переходе к каждому следующему гомологу.
Или:
увеличение углеводородной части молекулы ПАВ на одно звено – СН2- повышает поверхностную активность в 3,2 раза.
Слайд 42Правило выполняется при следующих условиях:
при комнатной температуре;
при малых концентрациях ПАВ (при
только для полярных растворителей (в случае неполярных правило становится обратным, т.к. увеличение углеводородной цепи приводит к увеличению растворимости, что способствует уходу в глубь раствора).
Слайд 43Адсорбция газов и жидкостей на поверхности твердого тела
Теория мономолекулярной адсорбции Ленгмюра.
В
Слайд 44Основные положение теории Ленгмюра:
1). Поверхность адсорбента ограничена. Адсорбция вещества происходит не на
2). Каждый активный центр удерживает только одну молекулу.
3). Когда все активные центры заняты и поверхность адсорбента покрыта слоем толщиной в одну молекулу (мономолекулярный слой), наступает адсорбционное равновесие и дальнейшее увеличение адсорбции невозможно.
4). Процесс адсорбции имеет динамический характер. При равновесии скорость адсорбции и десорбции одинакова. Адсорбированные молекулы остаются некоторое время связанными с активными центрами, а затем покидают поверхность (десорбируются) и их место занимают другие молекулы Время пребывания молекулы на активном центре зависит от температуры.
5). Адсорбированные на активных центрах молекулы не взаимодействуют друг с другом.
Слайд 45Уравнение изотермы мономолекулярной адсорбции Ленгмюра имеет вид:
где А и А∞ ‑ соответственно
К – константа адсорбционного равновесия
р – равновесное давление газа или пара.
Слайд 46Уравнение Лэнгмюра для адсорбции из растворов:
где Г – Гиббсовская адсорбция при
Г∞– максимальная или предельная адсорбция, соответствующая образованию монослоя,
С – равновесная концентрация вещества в растворе.
Уравнение Лэнгмюра применяют при очень низких или высоких давлениях (концентрациях)
Слайд 49Уравнением Фрейндлиха
Адсорбция из растворов может быть описана уравнением Фрейндлиха, которое в
где х – количество адсорбировавшегося адсорбтива, ммоль;
m – масса адсорбента, г;
С – равновесная концентрация адсорбтива (растворенного вещества), ммоль/л;
К, 1/n – константы, характерные для данного процесса адсорбции; определяют экспериментально.
Уравнение применяют при средних концентрациях
Слайд 50По экспериментальным данным строят кривую – изотерму адсорбции, выражающую зависимость массы
Слайд 53Адсорбция из растворов электролитов
Адсорбция из водных растворов электролитов происходит, как правило,
Слайд 54Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой,
Слайд 55При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается
Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило (правило Пескова – Фаянса):
На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение.
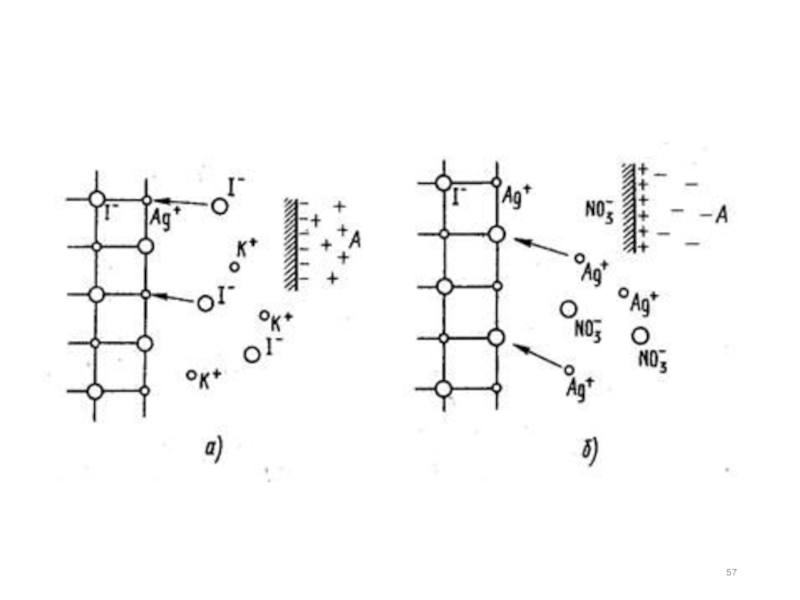
Слайд 56Пример. Рассмотрим адсорбцию ионов раствора КI на поверхности кристалла AgI. На
Слайд 58Если кристаллы AgI находятся в контакте с раствором AgNO3, то на
Таким образом, на поверхности кристаллического твердого тела из раствора адсорбируются тот ион, который входит в состав кристаллической решетки или может образовывать с одним из ионов решетки малорастворимое соединение.
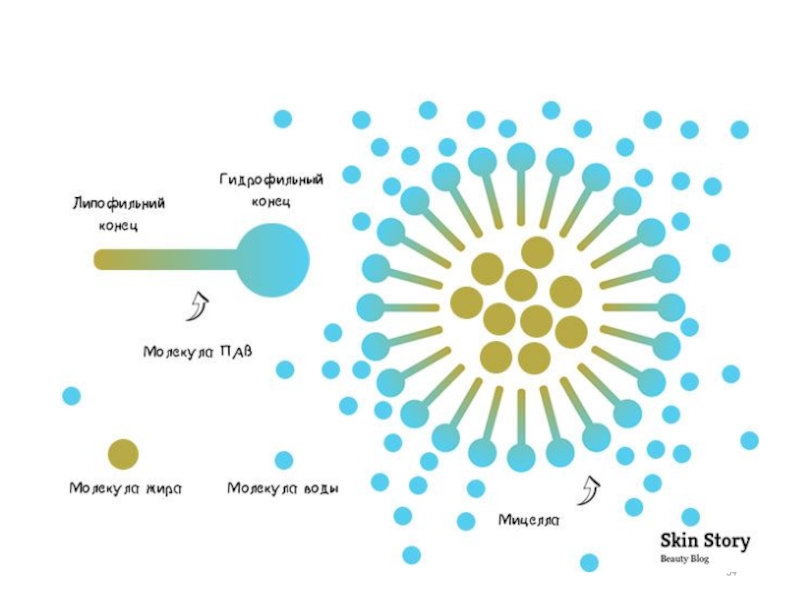
Слайд 59Мицеллообразование в растворах ПАВ
Под мицеллой (МЦ) ПАВ понимают ассоциат дифильных молекул, лиофильные группы которых
Число молекул в мицелле n – число агрегации (она чаще в пределах n= 20-100), а сумма молекулярных масс молекул в мицелле определяет молярную массу мицеллы.
МЦ, образующиеся в водном растворе, называются прямыми, а в неполярной – обратными.
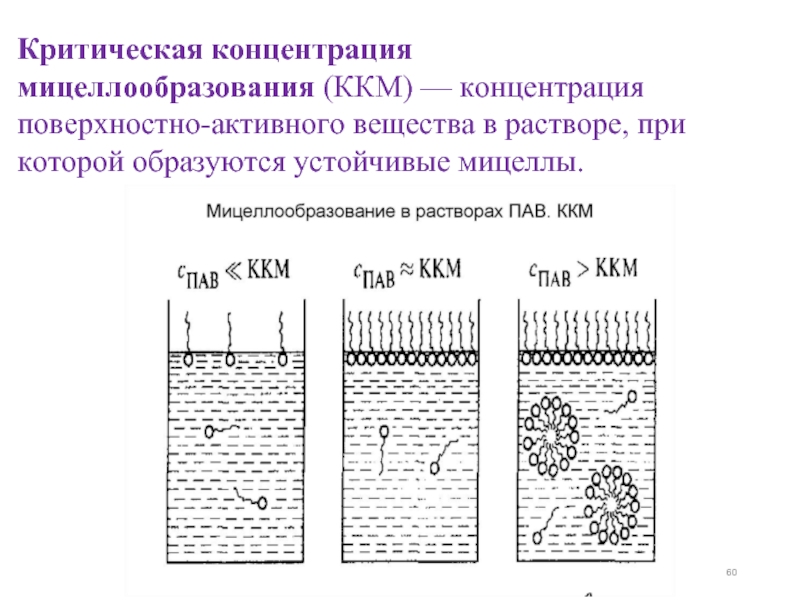
Слайд 60Критическая концентрация мицеллообразования (ККМ) — концентрация поверхностно-активного вещества в растворе, при которой образуются
Слайд 61Растворы МЦобразующих ПАВ делят на 2 группы:
1) гомогенные при С< СККМ
2)
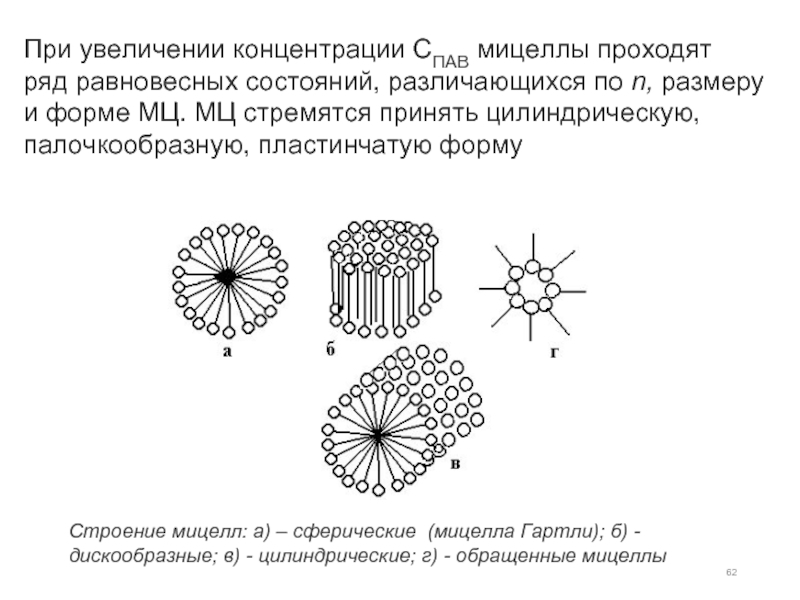
Слайд 62При увеличении концентрации СПАВ мицеллы проходят ряд равновесных состояний, различающихся по n, размеру и форме
Строение мицелл: а) – сферические (мицелла Гартли); б) - дискообразные; в) - цилиндрические; г) - обращенные мицеллы
Слайд 64При ↑ концентрации СПАВ, превышающую ККМ в 10-50 раз в системе,
При дальнейшем удалении дисперсионной среды гель переходит в твердую макрофазу – кристалл со слоистым строением.
Слайд 65Мицеллы ионогенных ПАВ обычно заряжены, их заряд зависит от кислотно-основных свойств
При этом возможны электрофоретическая подвижность. Положительно заряженные мицеллы движутся к катоду и наоборот
Слайд 66Явление растворения веществ в МЦПАВ называется солюбилизацией.
В водных МЦ ПАВ солюбилизируются
Вещество, солюбилизируемое раствором ПАВ называется солюбилизатом, а МЦ ПАВ – солюбилизатором.
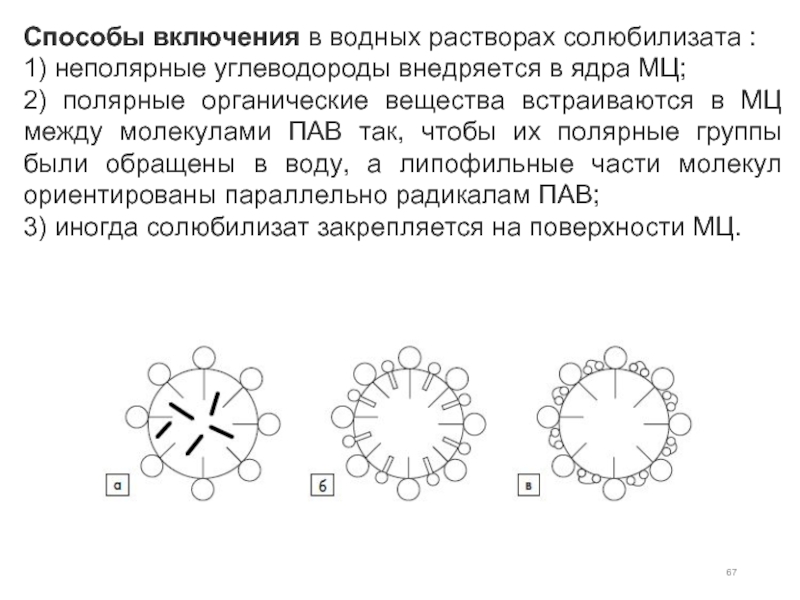
Слайд 67Способы включения в водных растворах солюбилизата :
1) неполярные углеводороды внедряется в ядра
2) полярные органические вещества встраиваются в МЦ между молекулами ПАВ так, чтобы их полярные группы были обращены в воду, а липофильные части молекул ориентированы параллельно радикалам ПАВ;
3) иногда солюбилизат закрепляется на поверхности МЦ.




![Из определения следует:G = σ∙sσ = [Дж/м2=Н∙м/м2= Н/м] – поверхностное натяжение;s – площадь поверхности, м2.](/img/tmb/1/10002/108da7fd0aee6ceb780612c176a57dfb-800x.jpg)