- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон. Периодическая система элементов. (Лекция 2) презентация
Содержание
- 1. Периодический закон. Периодическая система элементов. (Лекция 2)
- 2. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- 3. 1869 г. Периодическая система элементов -
- 4. Периоды - ряды элементов, в пределах которых
- 5. В 6 периоде находятся лантаноиды,
- 6. Группа состоит из двух подгрупп: главной
- 7. СТРОЕНИЕ АТОМА. Модели атома Демокрит Свойства вещества определяются характеристиками образующих его атомов.
- 8. СТРОЕНИЕ АТОМА. Модели атома Томсон Атом
- 9. СТРОЕНИЕ АТОМА. Модели атома 1911 г. Э.
- 10. СТРОЕНИЕ АТОМА. Модели атома Современная модель атома.
- 11. Современная модель атома Но: е движется
- 12. Современная модель атома Орбиталь - пространство вблизи
- 13. Современная модель атома Орбитали изображают квадратиком
- 14. Современная модель атома Изотопы – атомы
- 15. Состояние е в атоме. 4 квантовых числа
- 16. 4 квантовых числа Орбитальное квантовое число L показывает форму орбиталей
- 17. Орбитальное квантовое число s-орбиталь имеет сферическую форму,
- 18. 4 квантовых числа Магнитное квантовое число m
- 19. Магнитное квантовое число L = 0, то
- 20. Магнитное квантовое число L = 2, m
- 21. 4 квантовых числа Спиновое квантовое число s
- 22. Распределение электронов Принцип минимума энергии
- 23. Распределение электронов Первое правило Клечковского: Заполнение
- 24. Распределение электронов Второе правило Клечковского: При
- 25. Распределение электронов Принцип Паули Число
- 26. Распределение электронов Правило Хунда Если
- 27. Строение электронной оболочки изображается электронной формулой: Энергетические
- 28. современная формулировка периодического закона Строение и свойства
- 29. современная формулировка периодического закона и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов
- 30. Закономерности 1. Число энергетических уровней в атоме = номеру периода.
- 31. Закономерности 2. Общее число е в атоме = порядковому номеру элемента в Периодической системе.
- 32. Закономерности 3. У элементов главных подгрупп
- 33. Закономерности 4. У элементов побочных подгрупп III-VII
- 34. Закономерности 5. У элементов побочных подгрупп
- 35. Периодические свойства атома количество электронов на внешней электронной оболочке
- 36. Периодические свойства атома атомный и ионный радиусы
- 37. Периодические свойства атома энергия ионизации
- 38. Периодические свойства атома сродство к электрону
- 39. Периодические свойства атома восстановительная активность
- 40. Периодические свойства атома окислительная активность
- 41. Периодические свойства атома электроотрицательность способность
- 42. Периодические свойства атома степень окисления условный
- 43. Правила определения степени окисления В простых веществах
- 44. Правила определения степени окисления Водород в соединениях
- 45. Правила определения степени окисления Фтор имеет степень
- 46. Правила определения степени окисления Алгебраическая сумма степеней
- 47. Периодические свойства атома Валентность число
- 48. Валентность и степень окисления Степень окисления атома
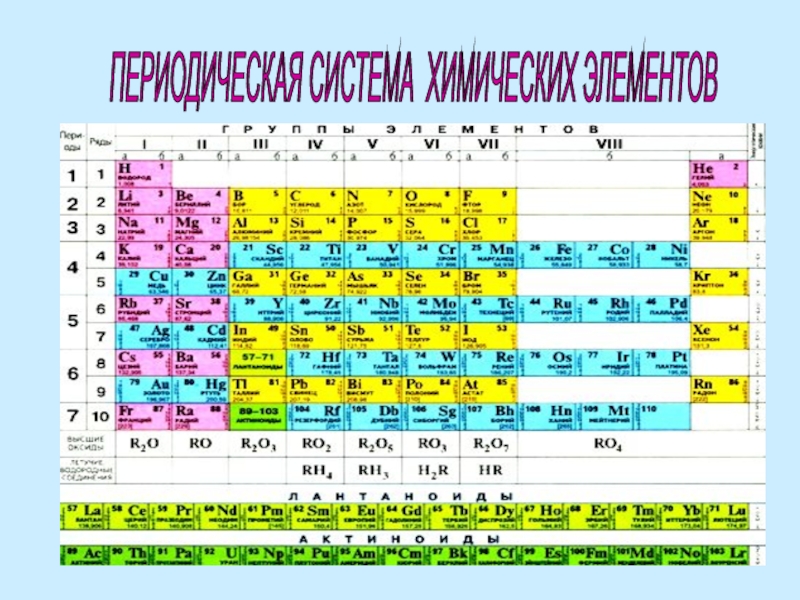
Слайд 3 1869 г.
Периодическая система элементов - графическое изображение периодического закона.
Состоит
из 10 горизонтальных рядов
и 8 вертикальных групп.
и 8 вертикальных групп.
Слайд 4Периоды - ряды элементов, в пределах которых свойства изменяются последовательно. По горизонтали
семь периодов (1-7). Периоды 1, 2, 3 состоят из одного ряда элементов - малые, остальные периоды - большие.
2 и 3 периоды типические
Слайд 5
В 6 периоде находятся лантаноиды,
в 7 периоде – актиноиды,
их
помещают вне общей таблицы
и не относят к какой-либо группе.
и не относят к какой-либо группе.
Слайд 6 Группа состоит из двух подгрупп:
главной
(содержит типические элементы и сходные
с ними по химическим свойствам элементы больших периодов)
и побочной
(содержит только металлы – элементы больших периодов).
8 группа содержит 3 побочные подгруппы: железа, кобальта и никеля.
и побочной
(содержит только металлы – элементы больших периодов).
8 группа содержит 3 побочные подгруппы: железа, кобальта и никеля.
Слайд 7СТРОЕНИЕ АТОМА.
Модели атома
Демокрит
Свойства вещества определяются характеристиками образующих его атомов.
Слайд 8СТРОЕНИЕ АТОМА.
Модели атома
Томсон
Атом – положительно заряженное тело
с заключенными внутри него
е.
Слайд 9СТРОЕНИЕ АТОМА.
Модели атома
1911 г. Э. Резерфорд, Н. Бор
Планетарная модель атома.
е – частица.
Слайд 10СТРОЕНИЕ АТОМА.
Модели атома
Современная модель атома. Развитие планетарной модели.
Атом – ядро
и окружающее его электронное облако.
Ядро атома: р (+), n (0). Окружено e (-).
Ядро атома: р (+), n (0). Окружено e (-).
Слайд 11Современная модель атома
Но:
е движется не по определенным траекториям, а характеризуется
плотностью вероятности нахождения частицы в данной точке пространства в данный момент времени.
Слайд 12Современная модель атома
Орбиталь - пространство вблизи ядра, в котором достаточно велика
вероятность нахождения е.
На одной орбитали может находиться не более 2 е.
На одной орбитали может находиться не более 2 е.
Слайд 13Современная модель атома
Орбитали изображают квадратиком
(квантовая ячейка).
Стрелки обозначают, что на
орбитали находится е.
Слайд 14Современная модель атома
Изотопы
– атомы с одним количеством р, но разным
количеством n; разными физическими и одними химическими свойствами
(Н – с 1 n – дейтерий,
с 2 n – тритий).
(Н – с 1 n – дейтерий,
с 2 n – тритий).
Слайд 15Состояние е в атоме.
4 квантовых числа
Главное квантовое число n определяет число
энергетических уровней
n = N периода
если атом в невозбужденном состоянии
n = N периода
если атом в невозбужденном состоянии
Слайд 17Орбитальное квантовое число
s-орбиталь имеет сферическую форму,
р-орбиталь - форму гантели,
d-орбиталь
– форму цветка,
f-орбиталь – еще более сложную форму
L от 0 до n-1
f-орбиталь – еще более сложную форму
L от 0 до n-1
Слайд 184 квантовых числа
Магнитное квантовое число m
Определяет расположение орбитали в пространстве
m от
-L до +L
(включая 0)
(включая 0)
Слайд 19Магнитное квантовое число
L = 0, то m = 0,
s-орбитали имеют
1 положение в пространстве,
L = 1, m = -1, 0, +1,
р-орбитали – 3 положения,
L = 1, m = -1, 0, +1,
р-орбитали – 3 положения,
Слайд 20Магнитное квантовое число
L = 2, m = -2, -1, 0, +1,
+2,
d-орбитали – 5 положений,
L = 3, m = -3, -2, -1, 0, +1, +2, +3,
f-орбитали – 7.
d-орбитали – 5 положений,
L = 3, m = -3, -2, -1, 0, +1, +2, +3,
f-орбитали – 7.
Слайд 214 квантовых числа
Спиновое квантовое число s
характеризует два возможных направления вращения электронов
вокруг собственной оси
S = +1/2 и -1/2
S = +1/2 и -1/2
Слайд 22Распределение электронов
Принцип минимума энергии
электрон в первую очередь располагается в
пределах электронной подоболочки с наименьшей энергией.
Слайд 23Распределение электронов
Первое правило Клечковского:
Заполнение электронных орбиталей идет от меньшего значения
суммы (n + L) к большему.
Слайд 24Распределение электронов
Второе правило Клечковского:
При одинаковой сумме (n + L)
заполнение
идет от меньшего
n к большему.
n к большему.
Слайд 25Распределение электронов
Принцип Паули
Число электронов
на энергетическом уровне N равно:
N
= 2n2,
где n - главное квантовое число
где n - главное квантовое число
Слайд 26Распределение электронов
Правило Хунда
Если только возможно, электроны
в атомах стремятся
оставаться неспаренными
Слайд 27Строение электронной оболочки изображается электронной формулой:
Энергетические уровни обозначаются цифрами 1, 2,
3, 4,..
подуровни - буквами s, р, d, f,..
электроны - индексами над ними 2p6
подуровни - буквами s, р, d, f,..
электроны - индексами над ними 2p6
Слайд 28современная формулировка периодического закона
Строение и свойства элементов и их соединений находятся
в периодической зависимости от заряда ядра атомов
Слайд 29современная формулировка периодического закона
и определяются периодически повторяющимися однотипными электронными конфигурациями их
атомов
Слайд 31Закономерности
2. Общее число е в атоме = порядковому номеру элемента
в
Периодической системе.
Слайд 32Закономерности
3. У элементов главных подгрупп число e на внешнем энергетическом
уровне = номеру группы Периодической системы
(валентные e).
(валентные e).
Слайд 33Закономерности
4. У элементов побочных подгрупп III-VII групп, элементов побочной подгруппы железа
VIII группы
общее число e на s-подуровне внешнего энергетического уровня атома и d-подуровне предпоследнего уровня = номеру группы (все они - валентные e).
общее число e на s-подуровне внешнего энергетического уровня атома и d-подуровне предпоследнего уровня = номеру группы (все они - валентные e).
Слайд 34Закономерности
5. У элементов побочных подгрупп
I и II групп d-подуровень предпоследнего
энергетического уровня завершен (d10), а на внешнем энергетическом уровне
число e = номеру группы.
число e = номеру группы.
Слайд 36Периодические свойства атома
атомный и ионный радиусы
по периоду заряд
ядра ↑, атомный радиус ↓ (например, от лития к фтору);
по главным и третьей побочной подгруппам сверху вниз число электронных оболочек ↑, атомный радиус ↑ (например, от лития к францию)
по главным и третьей побочной подгруппам сверху вниз число электронных оболочек ↑, атомный радиус ↑ (например, от лития к францию)
Слайд 37Периодические свойства атома
энергия ионизации
количество энергии,
необходимой для отрыва e от
атома
(по периоду ↑, по группе ↓)
(по периоду ↑, по группе ↓)
Слайд 38Периодические свойства атома
сродство к электрону
количество энергии,
выделяющейся при присоединении дополнительного
e к атому
(по периоду ↑, по группе ↓)
(по периоду ↑, по группе ↓)
Слайд 39Периодические свойства атома
восстановительная активность
способность атома
отдавать e другому атому
(вдоль
по периоду ↓,
вниз по группе ↑)
вниз по группе ↑)
Слайд 40Периодические свойства атома
окислительная активность
способностью атома
присоединять e от другого атома
(вдоль по периоду ↑,
вниз по группе ↓)
Слайд 41Периодические свойства атома
электроотрицательность
способность атома в соединении притягивать к себе e
(в периоде ↑, в группе ↓)
Слайд 42Периодические свойства атома
степень окисления
условный заряд атома в соединении, вычисленный исходя
из предположения, что оно состоит только из ионов.
Выражается арабскими цифрами со знаками «+», «-», «0» над символом элемента
Выражается арабскими цифрами со знаками «+», «-», «0» над символом элемента
Слайд 43Правила определения степени окисления
В простых веществах (N2 , Cl2, …) степень
окисления атомов равна 0.
Щелочные металлы (Na, K, …) имеют степень окисления +1, щелочноземельные (Са, Ва, …) +2.
Щелочные металлы (Na, K, …) имеют степень окисления +1, щелочноземельные (Са, Ва, …) +2.
Слайд 44Правила определения степени окисления
Водород в соединениях с неметаллами (Н2О, Н2S) имеет
степень окисления +1,
а с металлами
(в гидридах - CaH2 , NaH) -1.
а с металлами
(в гидридах - CaH2 , NaH) -1.
Слайд 45Правила определения степени окисления
Фтор имеет степень окисления -1.
Кислород проявляет степень окисления
-2.
Искл. OF2, его степень окисления +2.
Искл. OF2, его степень окисления +2.
Слайд 46Правила определения степени окисления
Алгебраическая сумма степеней окисления всех атомов,
входящих в
состав молекулы, всегда равна нулю,
а в сложном ионе – заряду.
а в сложном ионе – заряду.
Слайд 47Периодические свойства атома
Валентность
число химических связей, которыми данный атом соединен с
другими.
Число связей = числу его неспаренных e.
Число связей = числу его неспаренных e.
Слайд 48Валентность и степень окисления
Степень окисления атома не всегда совпадает с числом
образуемых им связей, т.е. не равна валентности данного элемента.
Например, СО – валентности = III, а степени окисления +2 и -2
Например, СО – валентности = III, а степени окисления +2 и -2