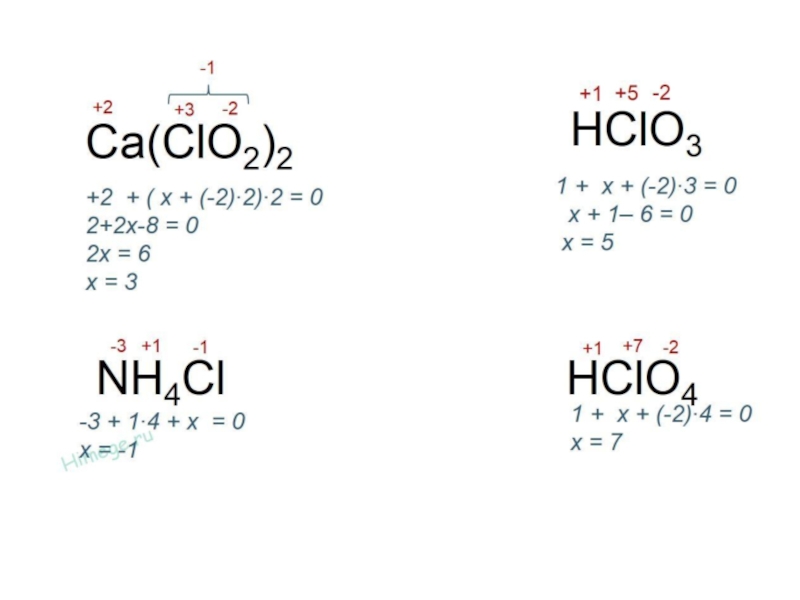- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодическая система Д.И. Менделеева (Занятие 3) презентация
Содержание
- 1. Периодическая система Д.И. Менделеева (Занятие 3)
- 2. Периодический закон: свойства элементов, а также свойства
- 3. Периодическая система (таблица) - это графическое выражение Периодического закона.
- 6. Порядковый номер – наиболее важная
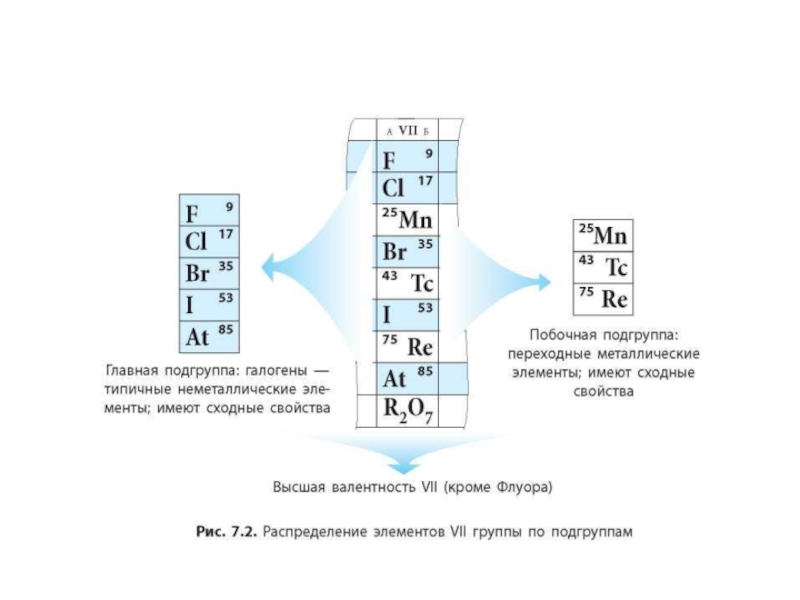
- 7. Группы - вертикальные столбцы. В периодической системе 8 групп. Группы делятся на подгруппы.
- 8. Подгруппы: Главные (А) – содержат элементы малых
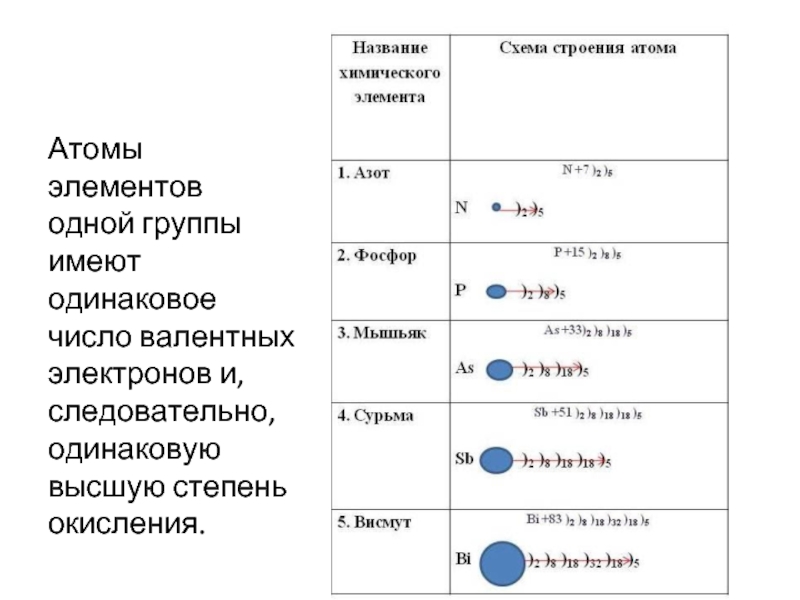
- 10. Атомы элементов одной группы имеют
- 11. Период - Горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер атомов.
- 13. Каждый период начинается щелочным металлом и заканчивается инертным газом.
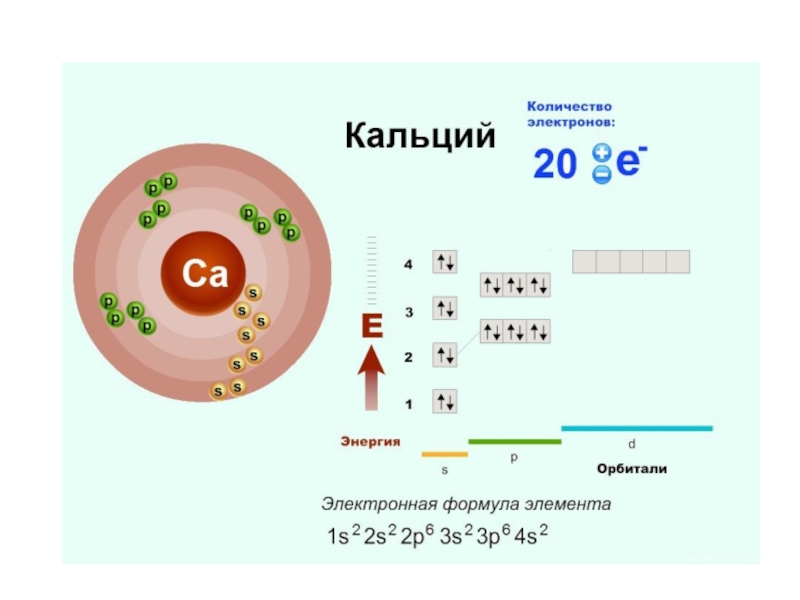
- 14. Номер периода указывает на число энергетических уровней, на которых расположены электроны в этом атоме.
- 16. На что указывает порядковый номер элемента?
- 17. Порядковый номер элемента указывает на общее число электронов атоме.
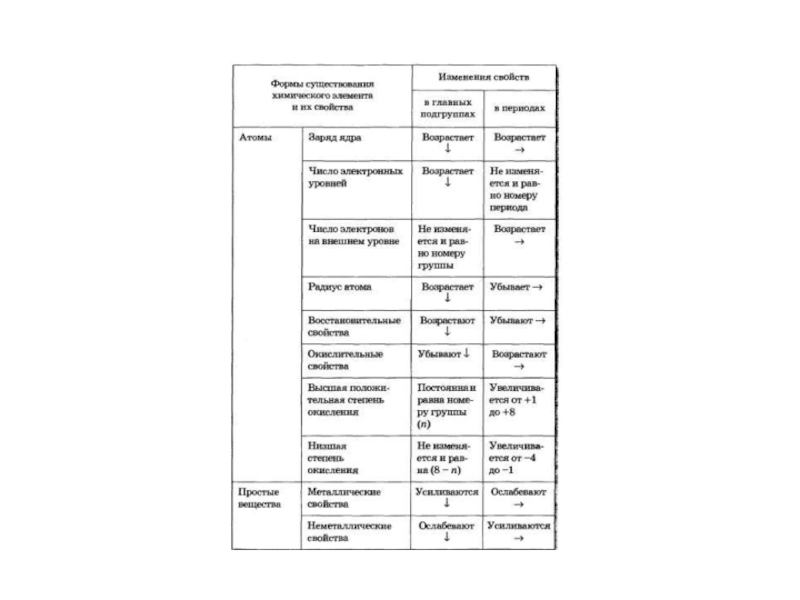
- 18. Изменение свойств элементов в главных подгруппах и периодах
- 19. Химическая связь и строение вещества Химическая связь
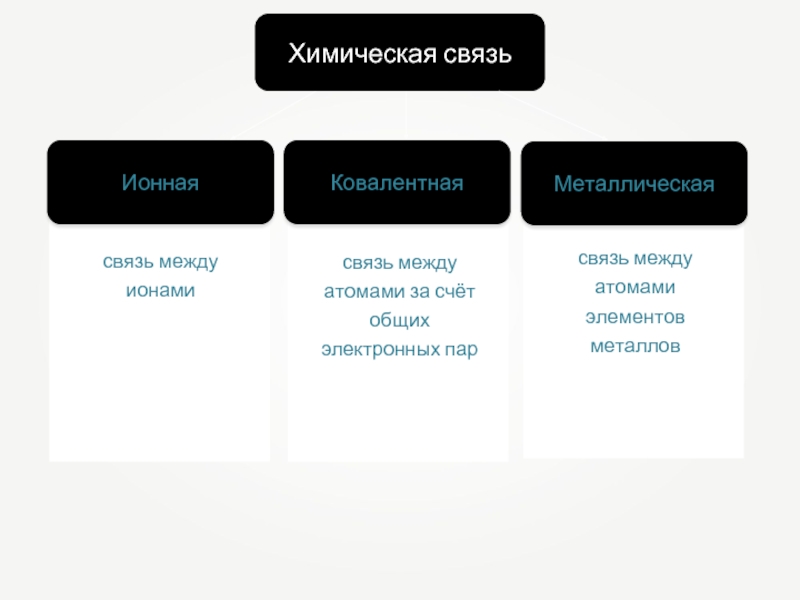
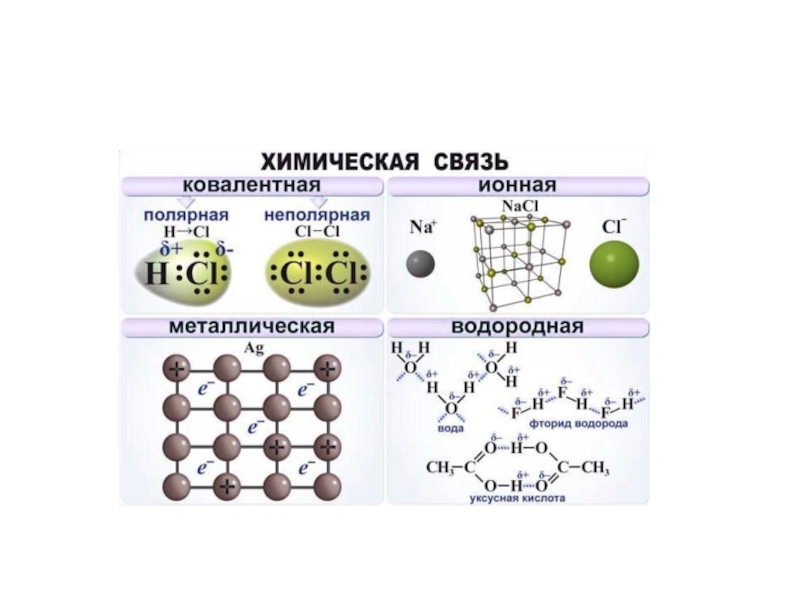
- 20. Типы химических связей Ковалентная. Ионная. Металлическая. Водородная.
- 21. Химическая связь — это связь между
- 22. Ионная Химическая связь Ковалентная Металлическая
- 23. Ковалентная связь — химическая связь, возникающая в результате образования общих электронных пар.
- 24. Полярная Ковалентная связь Неполярная
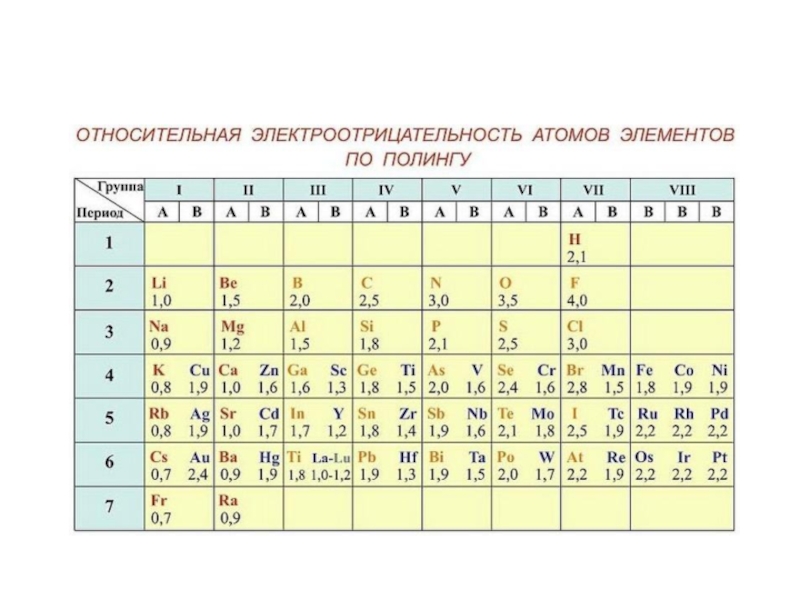
- 25. Электроотрицательность — это способность атомов химического
- 26. Валентность — это число ковалентных связей,
- 29. Ковалентная связь Осуществляется за счет образования общих
- 30. Ковалентная неполярная связь – образование молекулы водорода.
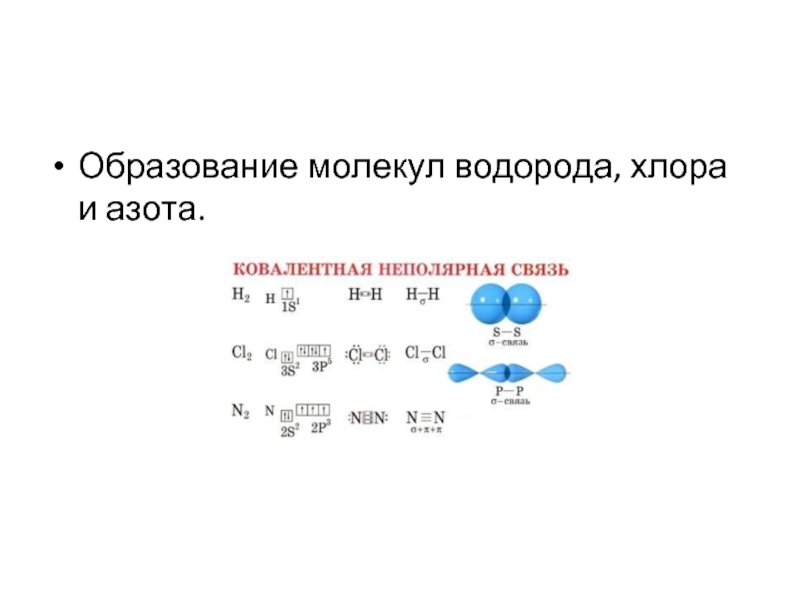
- 31. Образование молекул водорода, хлора и азота.
- 32. Ковалентная полярная связь образуется между атомами (обычно неметаллов), отличающимися по электроотрицательности.
- 34. Характеристики связи Длина. Энергия.
- 35. Длина связи – расстояние между ядрами
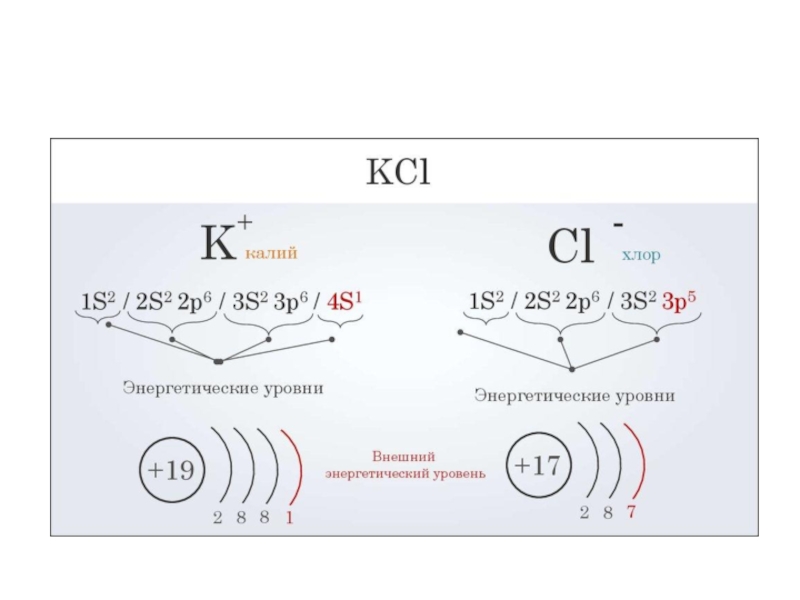
- 36. Ионная связь – осуществляется за счет
- 37. Взаимодействие атомов натрия и хлора
- 39. В твердом (кристаллическом) состоянии каждый положительно
- 41. Металлическая связь – осуществляется между атомами
- 42. В узлах
- 43. Свойства металлов: Электропроводность. Теплопроводность. Металлический блеск. Пластичность. Ковкость.
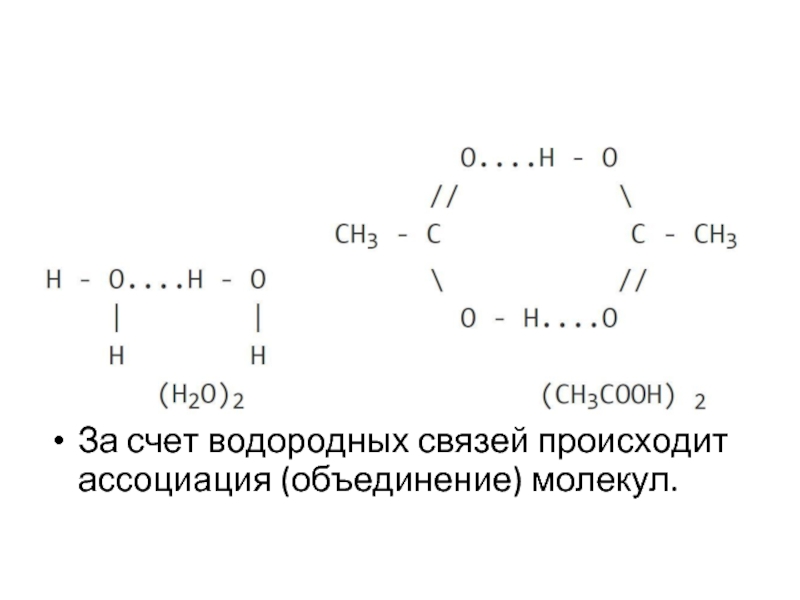
- 45. Водородная связь – возникает между молекулами,
- 46. За счет водородных связей происходит ассоциация (объединение) молекул.
- 47. Электроотрицательность – способность атома в соединении смещать к себе электронную плотность от соседних атомов.
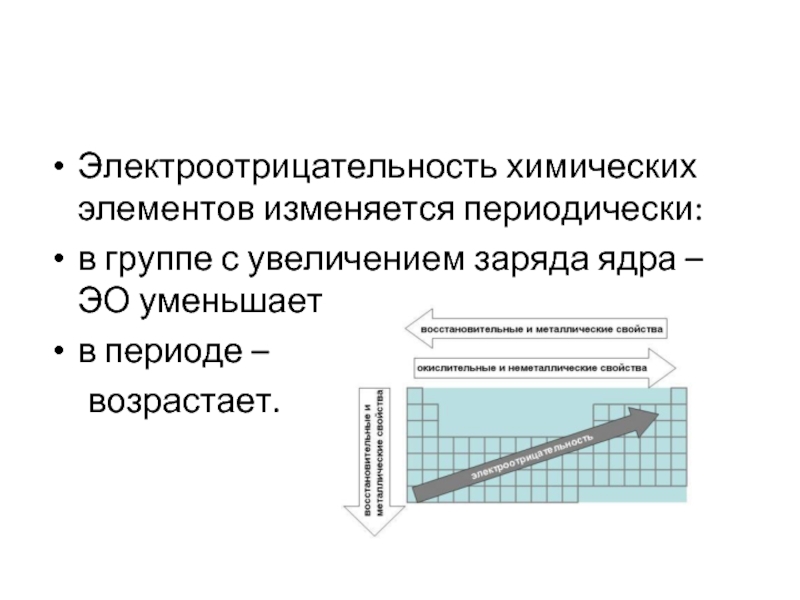
- 49. Электроотрицательность химических элементов изменяется периодически: в
- 51. Углерод более ЭО, чем водород, но
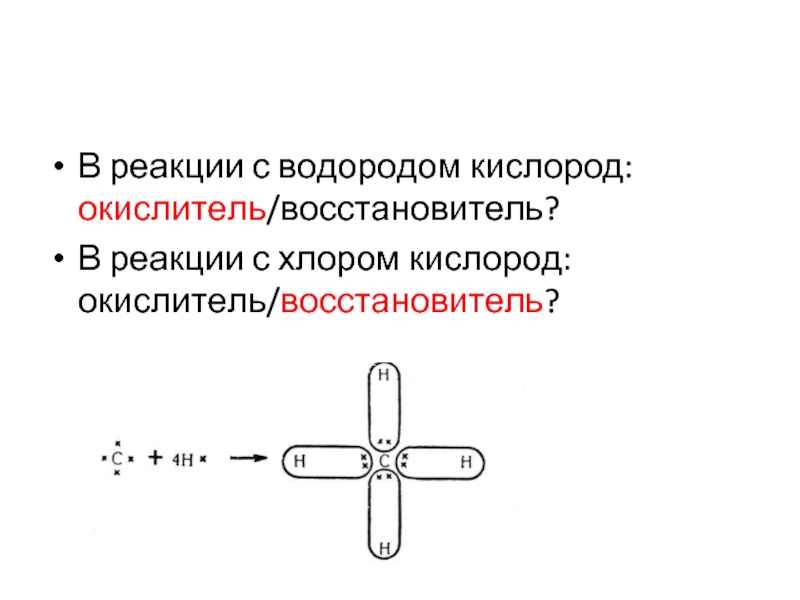
- 52. В реакции с водородом кислород: окислитель/восстановитель? В реакции с хлором кислород: окислитель/восстановитель?
- 53. Углерод более ЭО, чем водород, но менее ЭО, чем хлор.
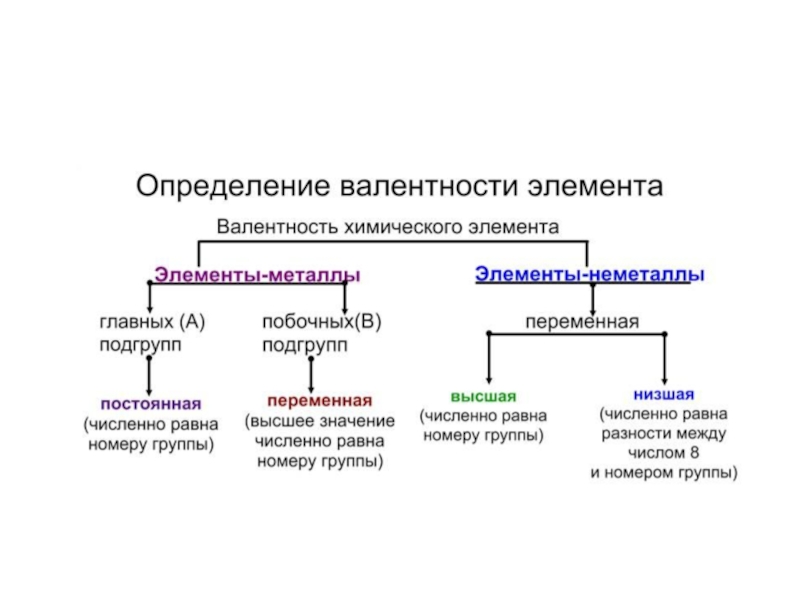
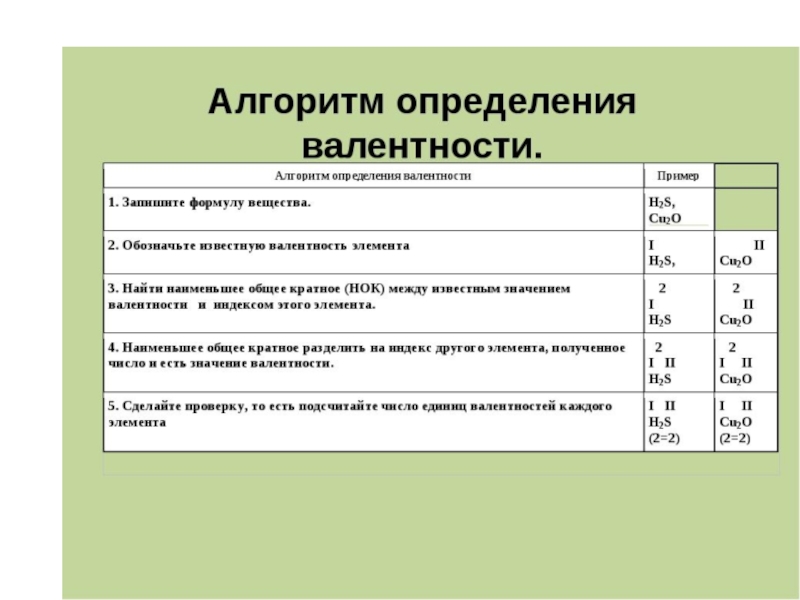
- 54. Валентность – способность атомов химического элемента к образованию химических связей.
- 55. Валентность определяется числом: неспаренных электронов (одноэлектронных орбиталей); неподеленных электронных пар; вакантных свободных орбиталей.
- 59. Степень окисления – условный заряд атома
- 60. Степень окисления может быть отрицательной, нулевой и положительной.
Слайд 2Периодический закон:
свойства элементов, а также свойства образуемых ими соединений находятся в
периодической зависимости от величины заряда ядер их атомов.
Слайд 6
Порядковый номер – наиболее важная характеристика элемента.
Порядковый номер указывает на число
протонов в ядре и число электронов в атоме.
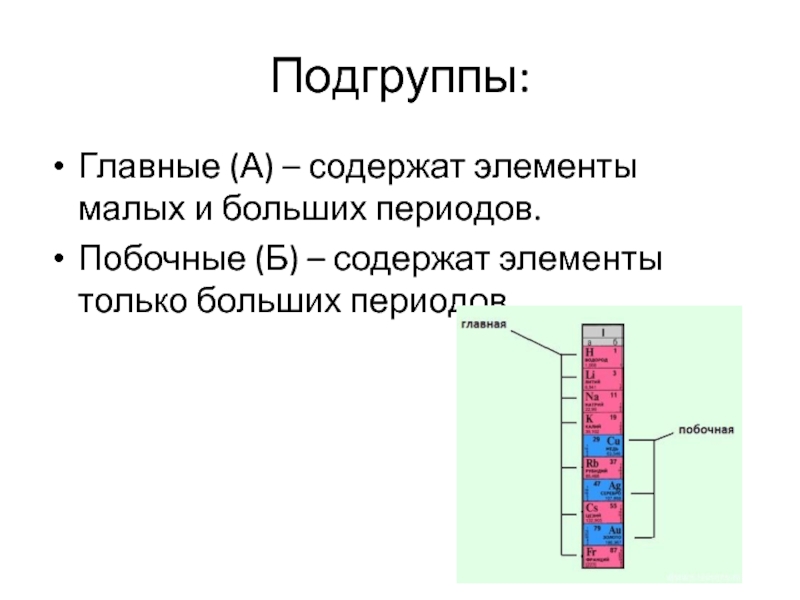
Слайд 8Подгруппы:
Главные (А) – содержат элементы малых и больших периодов.
Побочные (Б) –
содержат элементы только больших периодов.
Слайд 10
Атомы элементов одной группы имеют одинаковое число валентных электронов и, следовательно,
одинаковую высшую степень окисления.
Слайд 11Период -
Горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер
атомов.
Слайд 14
Номер периода указывает на число энергетических уровней, на которых расположены электроны
в этом атоме.
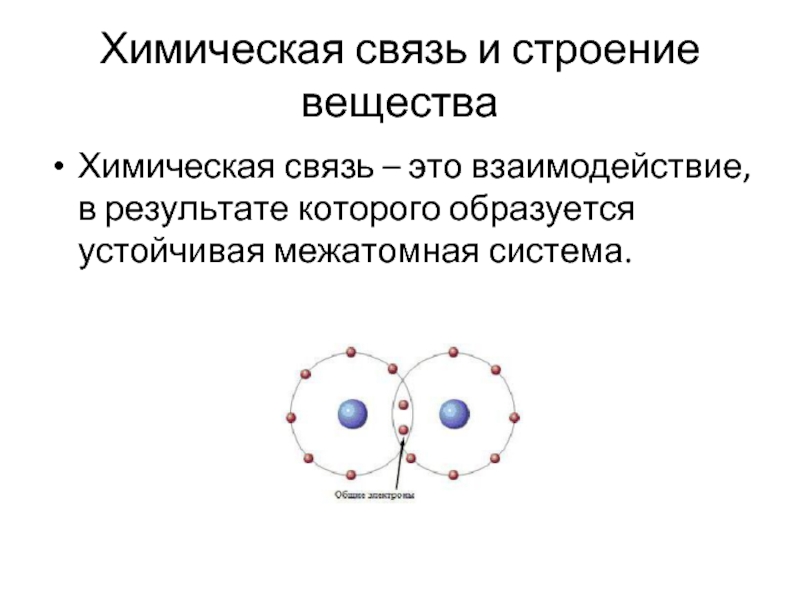
Слайд 19Химическая связь и строение вещества
Химическая связь – это взаимодействие, в результате
которого образуется устойчивая межатомная система.
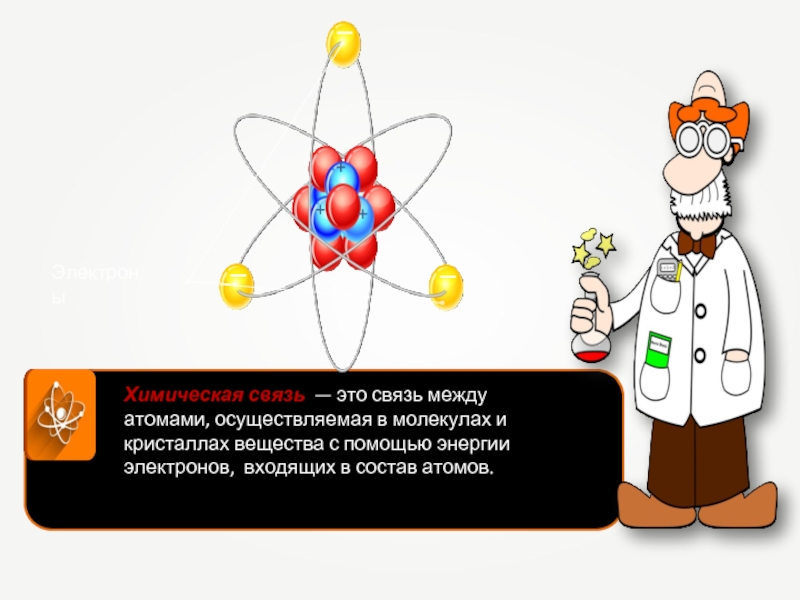
Слайд 21
Химическая связь — это связь между атомами, осуществляемая в молекулах и
кристаллах вещества с помощью энергии электронов, входящих в состав атомов.
+
+
+
—
—
—
Слайд 23
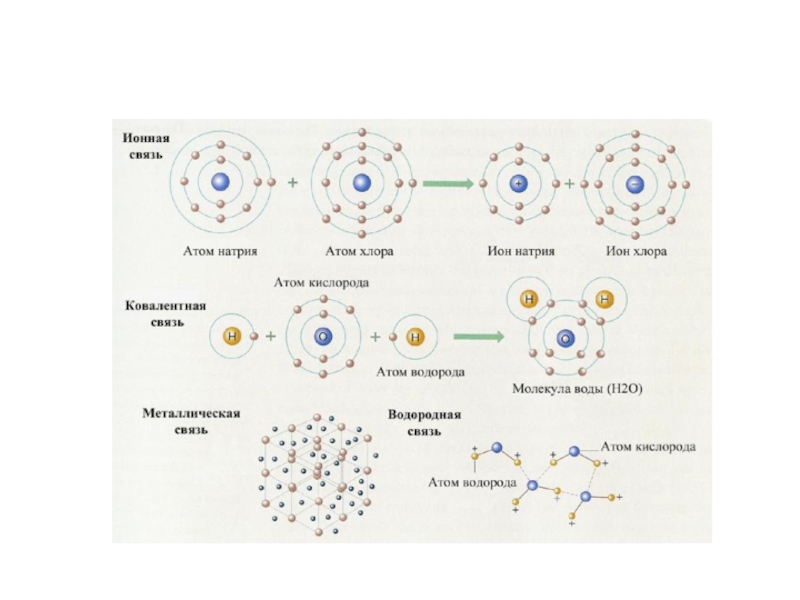
Ковалентная связь — химическая связь, возникающая в результате образования общих электронных
пар.
Слайд 25
Электроотрицательность — это способность атомов химического элемента смещать к себе общие
электронные пары, участвующие в образовании химической связи.
Слайд 26
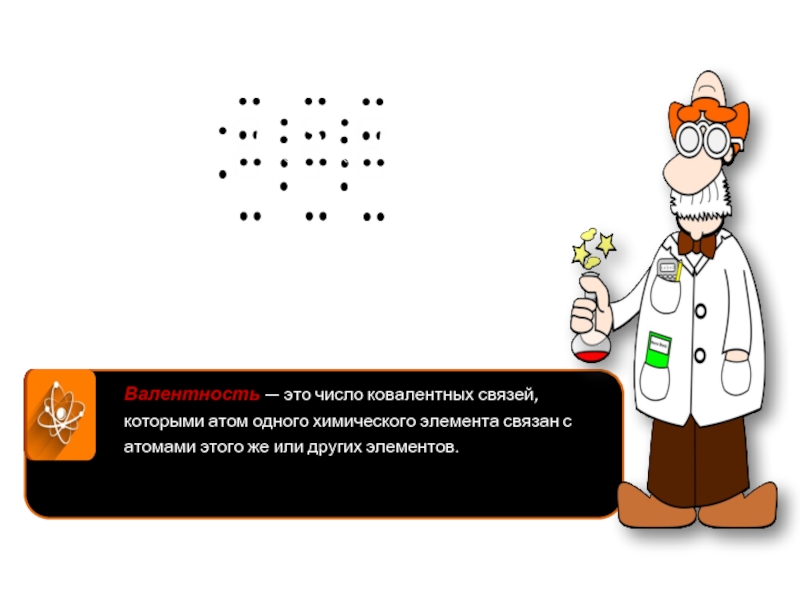
Валентность — это число ковалентных связей, которыми атом одного химического элемента
связан с атомами этого же или других элементов.
Слайд 29Ковалентная связь
Осуществляется за счет образования общих электронных пар.
Ковалентная неполярная связь образуется
между атомами одного и того же химического элемента.
Слайд 32
Ковалентная полярная связь образуется между атомами (обычно неметаллов), отличающимися по электроотрицательности.
Слайд 35
Длина связи – расстояние между ядрами взаимодействующих атомов.
Энергия связи – энергия,
выделяющаяся при образовании одного моля связей (кДж/моль).
Слайд 36
Ионная связь – осуществляется за счет электростатического взаимодействия ионов с разными
зарядами.
Ион – заряженная частица, которая образуется при присоединении электрона к атому или молекуле / или при отдаче электрона атомом или молекулой.
Ион – заряженная частица, которая образуется при присоединении электрона к атому или молекуле / или при отдаче электрона атомом или молекулой.
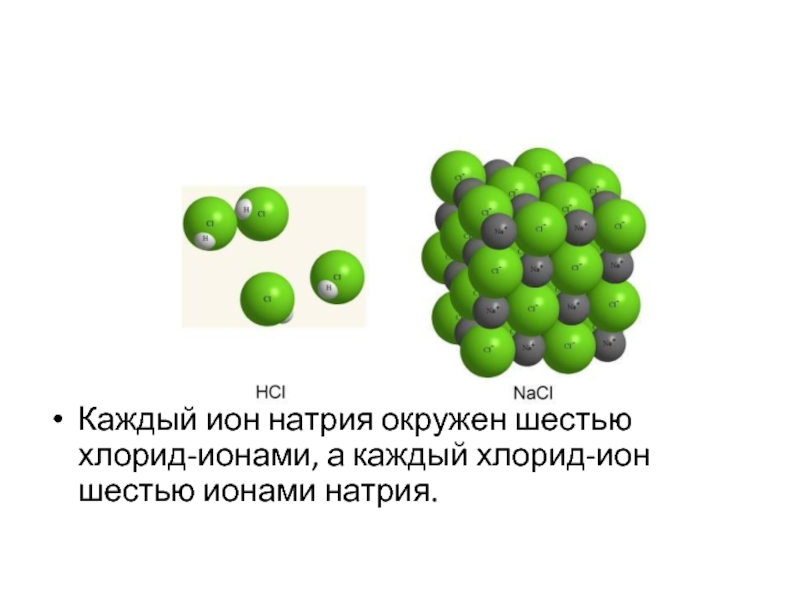
Слайд 39
В твердом (кристаллическом) состоянии каждый положительно заряженный ион взаимодействует не с
одним отрицательно заряженным ионом, а со множеством. Это является следствием ненаправленности и ненасыщаемости ионной связи.
Слайд 41
Металлическая связь – осуществляется между атомами с небольшим числом валентных электронов,
слабо удерживаемых ядром, и большим числом валентных орбиталей.
Металлическая связь существует в твердых металлах и их сплавах.
Металлическая связь существует в твердых металлах и их сплавах.
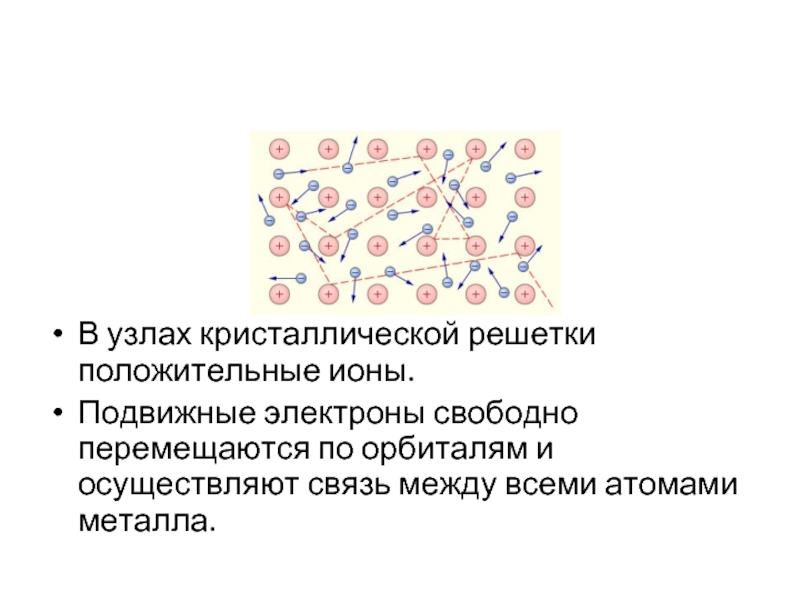
Слайд 42
В узлах кристаллической решетки положительные ионы.
Подвижные электроны свободно перемещаются по орбиталям
и осуществляют связь между всеми атомами металла.
Слайд 43Свойства металлов:
Электропроводность.
Теплопроводность.
Металлический блеск.
Пластичность.
Ковкость.
Слайд 45
Водородная связь – возникает между молекулами, в состав которых входят атомы
водорода и наиболее электроотрицательных элементов: фтор, кислород, азот.
Слайд 47
Электроотрицательность – способность атома в соединении смещать к себе электронную плотность
от соседних атомов.
Слайд 49
Электроотрицательность химических элементов изменяется периодически:
в группе с увеличением заряда ядра –
ЭО уменьшается;
в периоде –
возрастает.
в периоде –
возрастает.
Слайд 51
Углерод более ЭО, чем водород, но менее отрицателен, чем хлор.
В реакции
с водородом кислород: окислитель/восстановитель?
В реакции с хлором кислород: окислитель/восстановитель?
В реакции с хлором кислород: окислитель/восстановитель?
Слайд 52
В реакции с водородом кислород: окислитель/восстановитель?
В реакции с хлором кислород: окислитель/восстановитель?
Слайд 55
Валентность определяется числом:
неспаренных электронов (одноэлектронных орбиталей);
неподеленных электронных пар;
вакантных свободных орбиталей.
Слайд 59
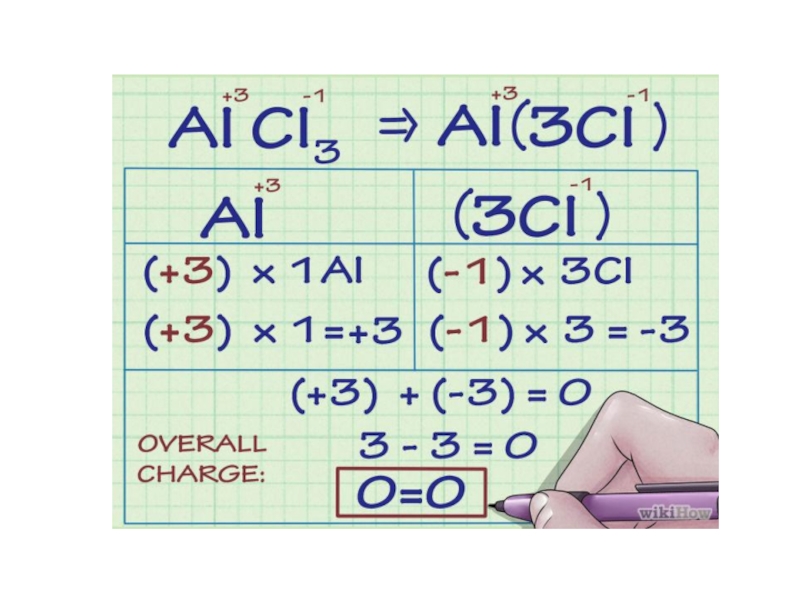
Степень окисления – условный заряд атома в соединении, вычисленный в предположении,
что все связи в этом соединении ионные (все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).