- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Особенности строения, реакционной способности и методы синтеза аренов презентация
Содержание
- 1. Особенности строения, реакционной способности и методы синтеза аренов
- 2. Арены (Ароматические соединения) Они представляют собой –
- 3. Арены Ароматические соединения, или арены, —
- 4. История открытия Впервые бензол описал немецкий химик
- 5. Второе рождение Своё второе рождение бензол
- 6. Новое получение В 1833 году немецкий
- 7. Фридрих Кекуле Фридрих Август Кекуле фон Штрадониц
- 8. Формула строения бензола Ф.Кекуле(1865 г.)
- 9. Строение бензола В свое время было
- 10. Арены Строение молекулы бензола
- 11. Арены Строение молекулы бензола
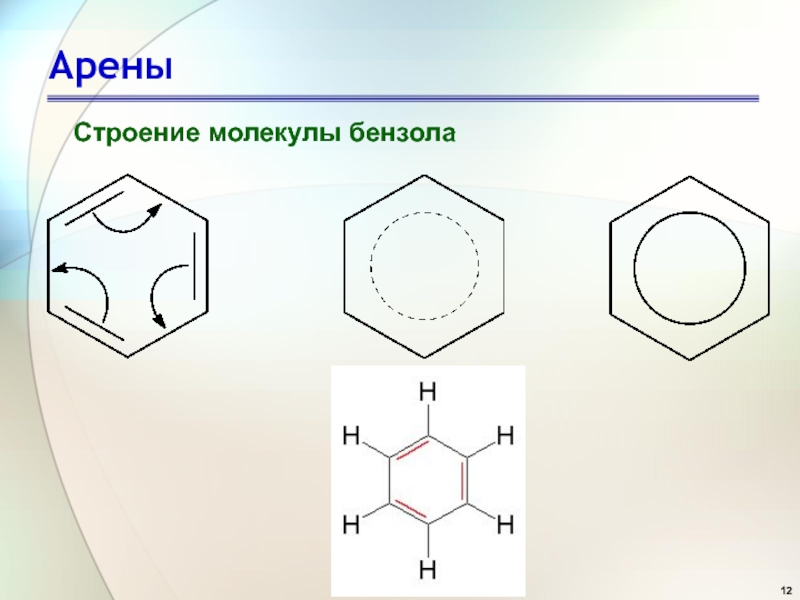
- 12. Арены Строение молекулы бензола
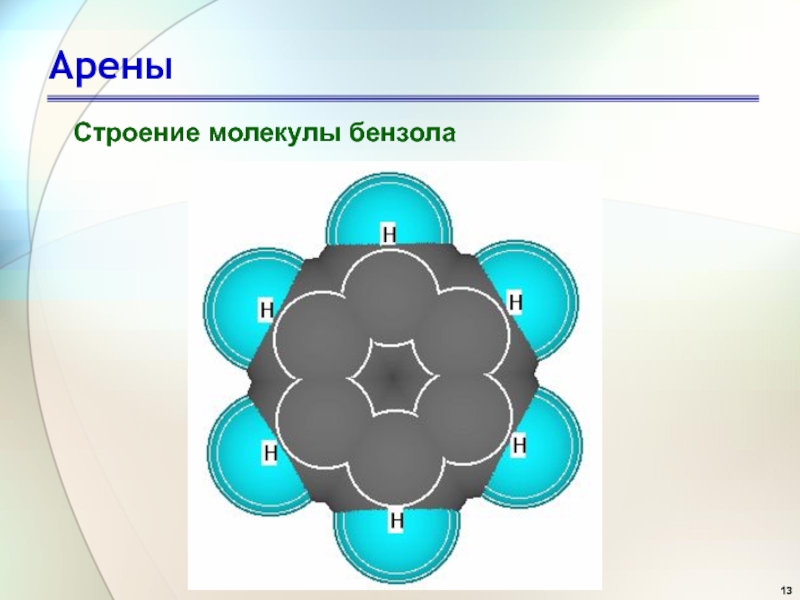
- 13. Арены Строение молекулы бензола
- 14. Арены «Ароматичность» – совокупность особых
- 15. Арены «Ароматичность» – совокупность особых
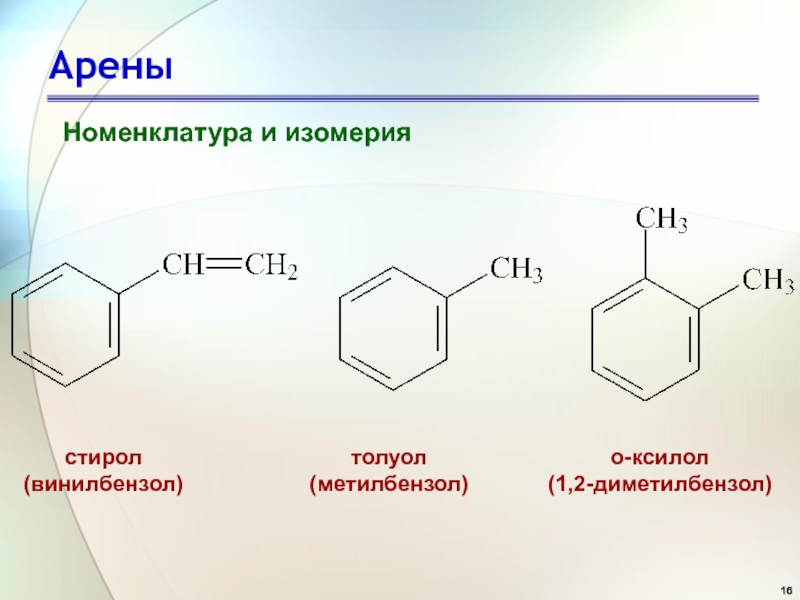
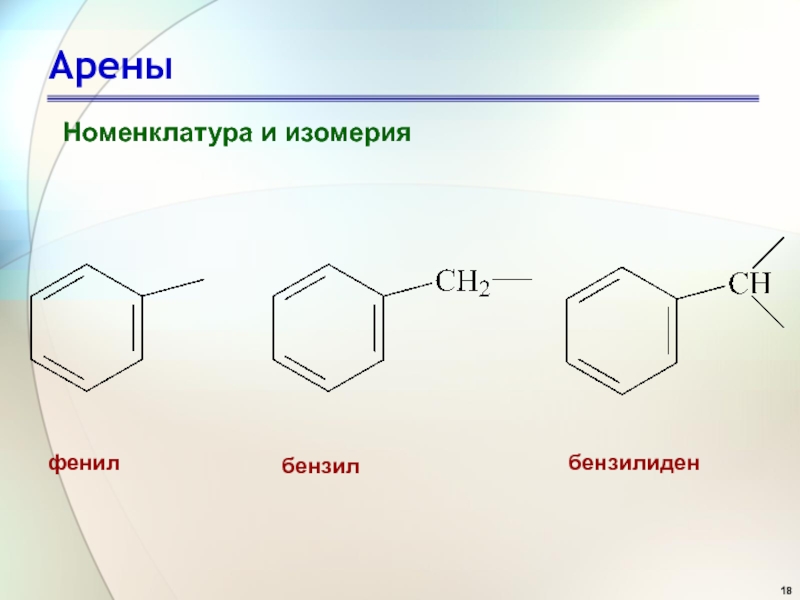
- 16. Арены Номенклатура и изомерия
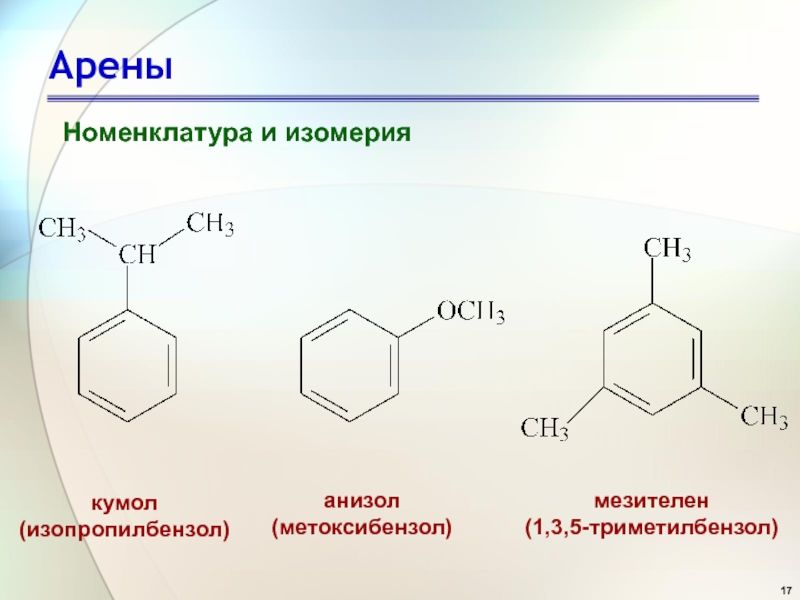
- 17. Арены Номенклатура и изомерия
- 18. Арены Номенклатура и изомерия фенил бензил бензилиден
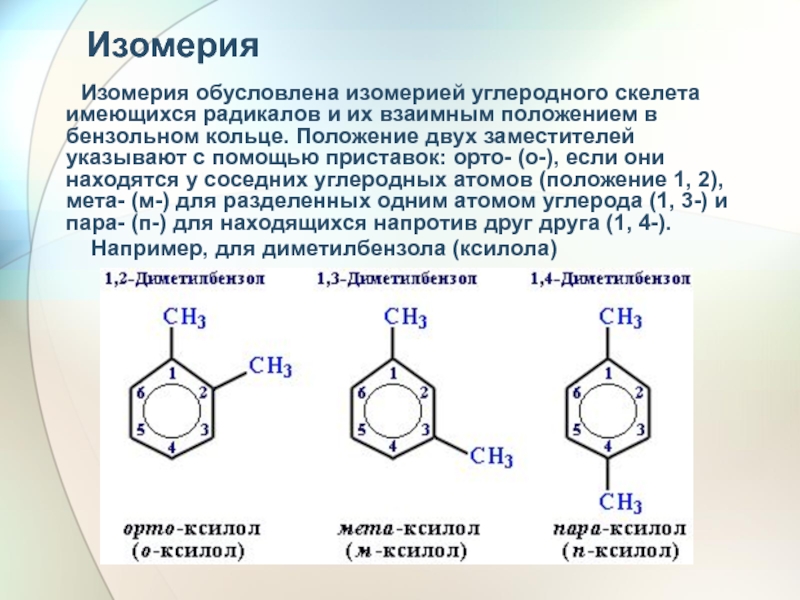
- 19. Изомерия
- 20. Физические свойства. Первые члены гомологического ряда бензола
- 21. Физические свойства бензола Бесцветная жидкость со своеобразным
- 22. Химические свойства аренов Бензольное
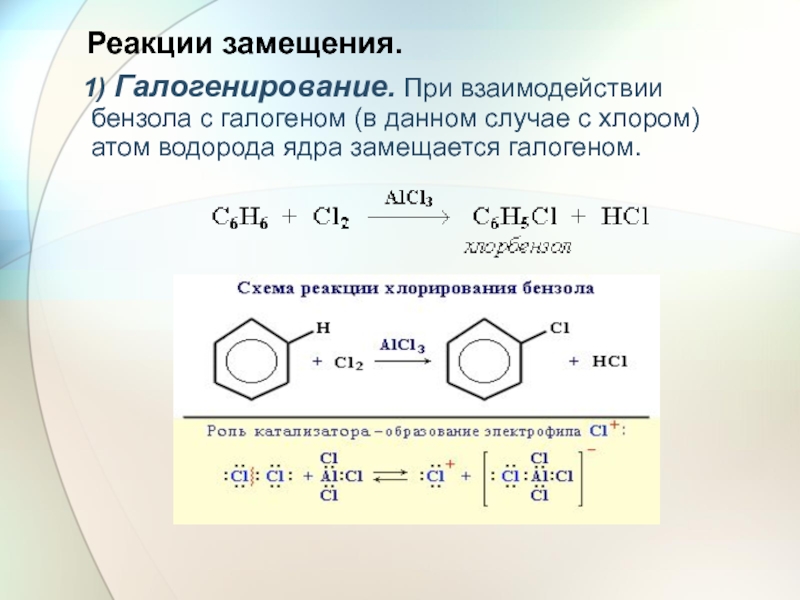
- 23. Реакции замещения. 1) Галогенирование. При
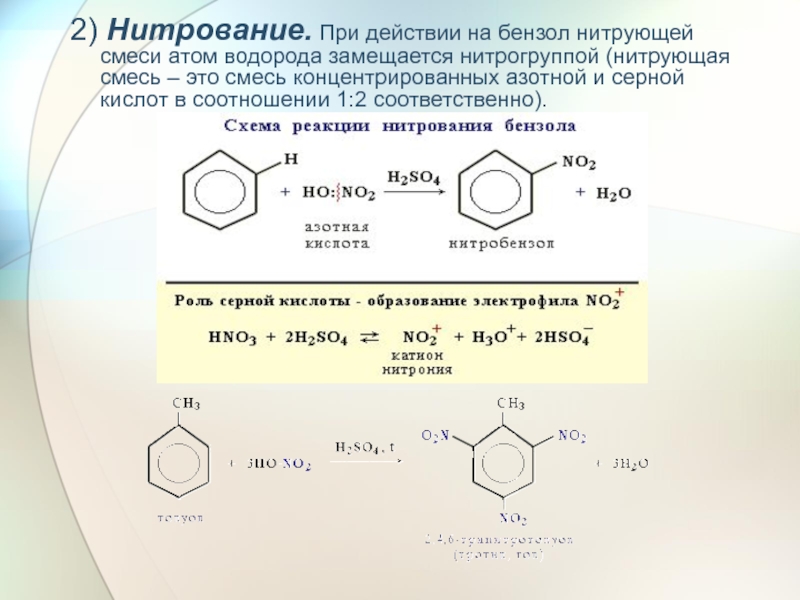
- 24. 2) Нитрование. При действии на бензол нитрующей
- 25. 3) Сульфирование осуществляется концентрированной серной кислотой или олеумом.
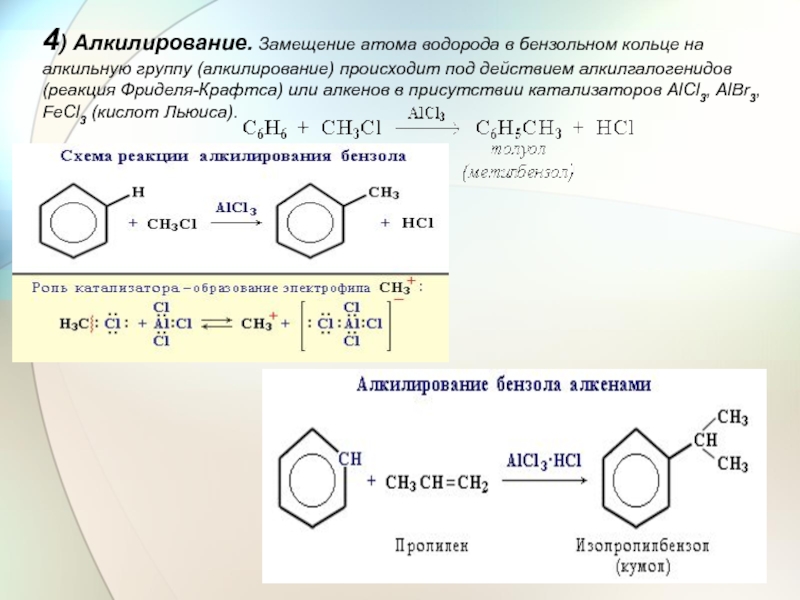
- 26. 4) Алкилирование. Замещение атома
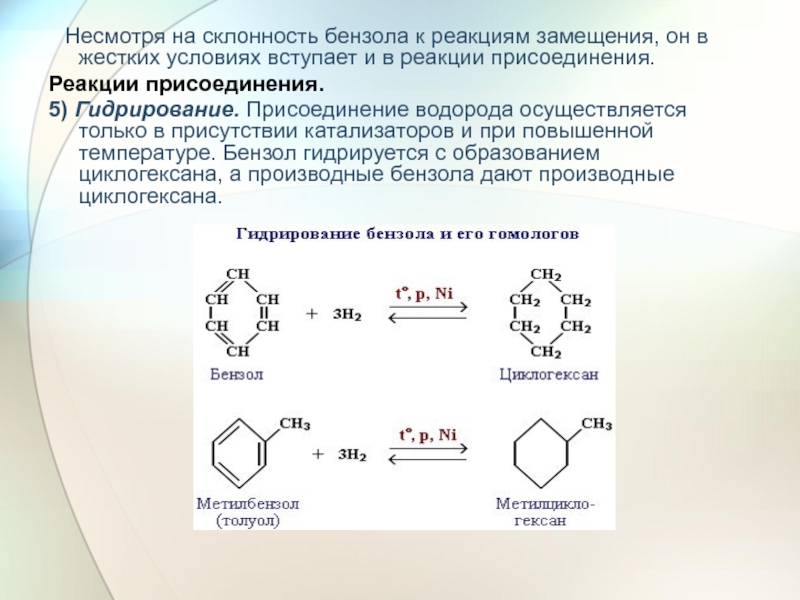
- 27. Несмотря на склонность бензола к
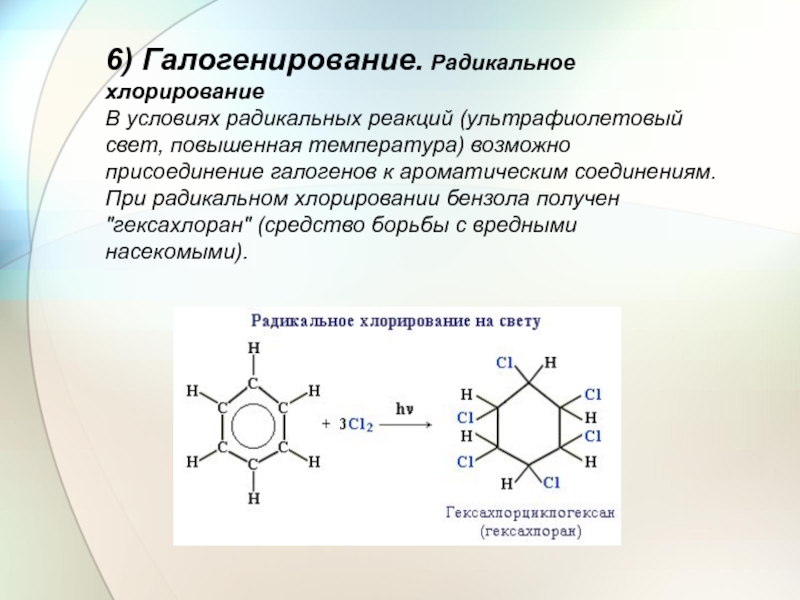
- 28. 6) Галогенирование. Радикальное хлорирование В условиях
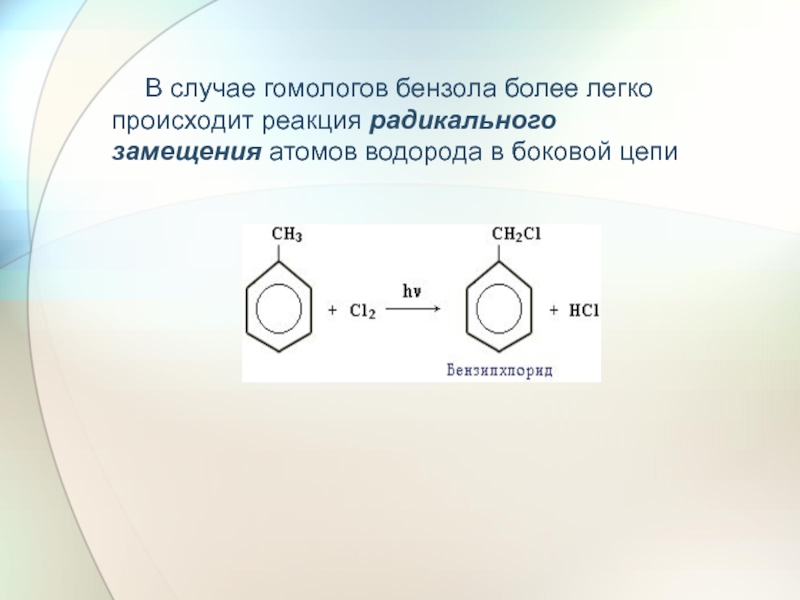
- 29. В случае гомологов бензола
- 30. Запомните Если в
- 31. Реакции окисления. 7) Толуол,
- 32. 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода
- 33. 3) Циклическая тримеризация ацетилена и его гомологов над
- 34. Применение ароматических углеводородов
- 35. Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных
Слайд 2Арены
(Ароматические соединения)
Они представляют собой – циклические органические соединения, которые имеют в
Слайд 3Арены
Ароматические соединения, или арены, — большая группа соединений карбоциклического ряда, молекулы
СnН2n-6
Слайд 4История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это
Слайд 5Второе рождение
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол
Слайд 6Новое получение
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол
Слайд 7Фридрих Кекуле
Фридрих Август Кекуле фон Штрадониц (нем. Friedrich August Kekulé von
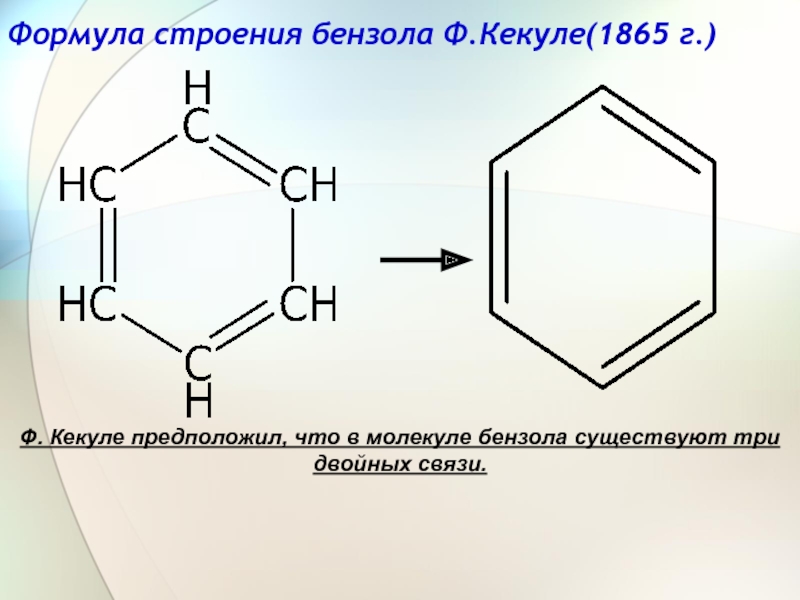
Слайд 8Формула строения бензола Ф.Кекуле(1865 г.)
Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
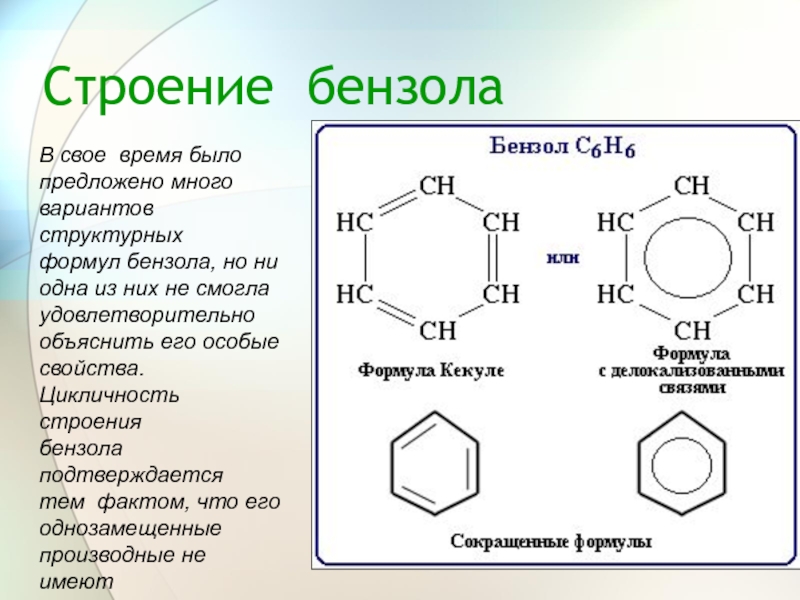
Слайд 9Строение бензола
В свое время было
предложено много
вариантов структурных
формул бензола, но ни
одна
удовлетворительно
объяснить его особые
свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
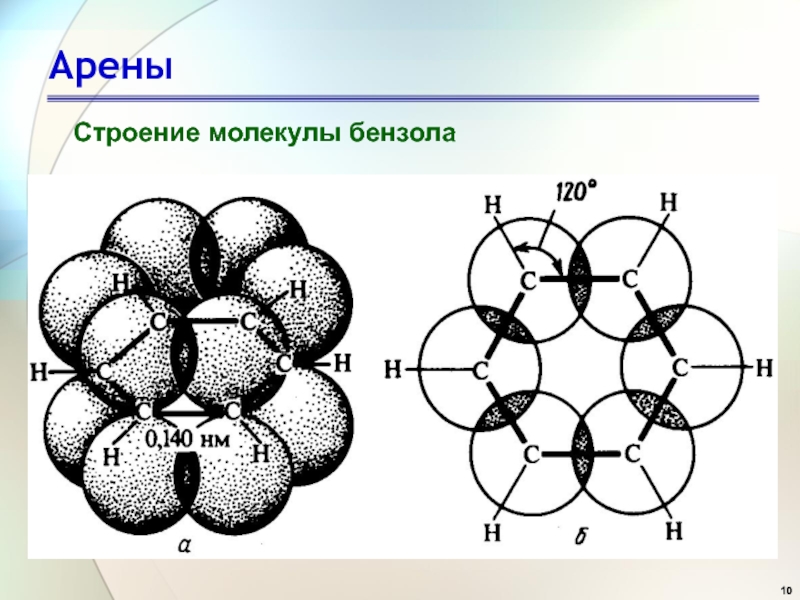
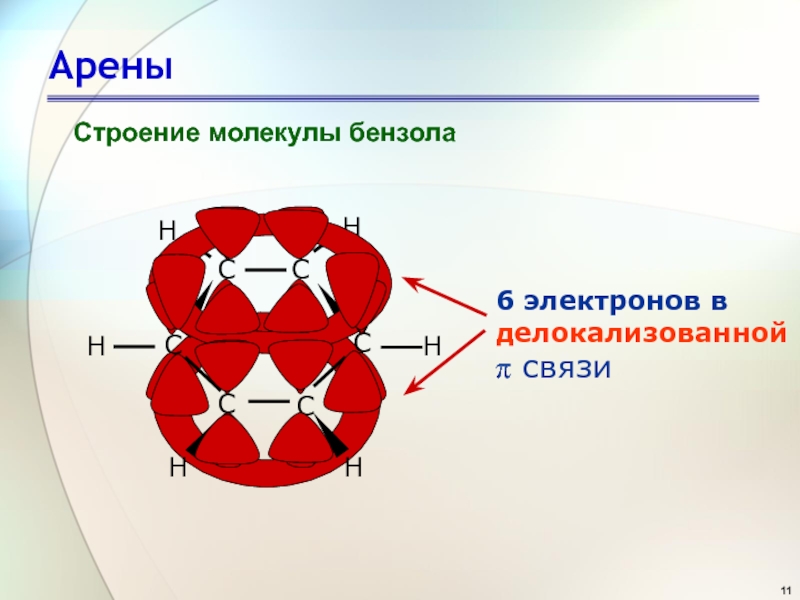
Слайд 14Арены
«Ароматичность» – совокупность особых
свойств бензола
Правило Хюккеля (1931): плоские циклические
Э.Хюккель вывел правило (1931)
Слайд 16Арены
Номенклатура и изомерия
стирол
(винилбензол)
толуол
(метилбензол)
о-ксилол
(1,2-диметилбензол)
Слайд 17Арены
Номенклатура и изомерия
кумол
(изопропилбензол)
анизол
(метоксибензол)
мезителен
(1,3,5-триметилбензол)
Слайд 19Изомерия
Изомерия обусловлена изомерией
Например, для диметилбензола (ксилола)
Слайд 20Физические свойства.
Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.)
Слайд 21Физические свойства бензола
Бесцветная жидкость со своеобразным резким запахом.
Температура плавления 5,5 °C,
С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями. Растворимость в воде 1,79 г/л (при 25 °C).
Слайд 22Химические свойства аренов
Бензольное ядро обладает высокой прочностью, чем
Слайд 23Реакции замещения.
1) Галогенирование. При взаимодействии бензола с галогеном (в
Слайд 242) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается
Слайд 253) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный
C6H6 + H2SO4 —SO3? C6H5 – SO3H + H2O
(бензолсульфокислота)
Слайд 26
4) Алкилирование. Замещение атома водорода в бензольном кольце на
Слайд 27 Несмотря на склонность бензола к реакциям замещения, он в
Реакции присоединения.
5) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
Слайд 286) Галогенирование. Радикальное хлорирование В условиях радикальных реакций (ультрафиолетовый свет, повышенная
Слайд 29 В случае гомологов бензола более легко происходит реакция
Слайд 30Запомните
Если в молекуле бензола один из атомов
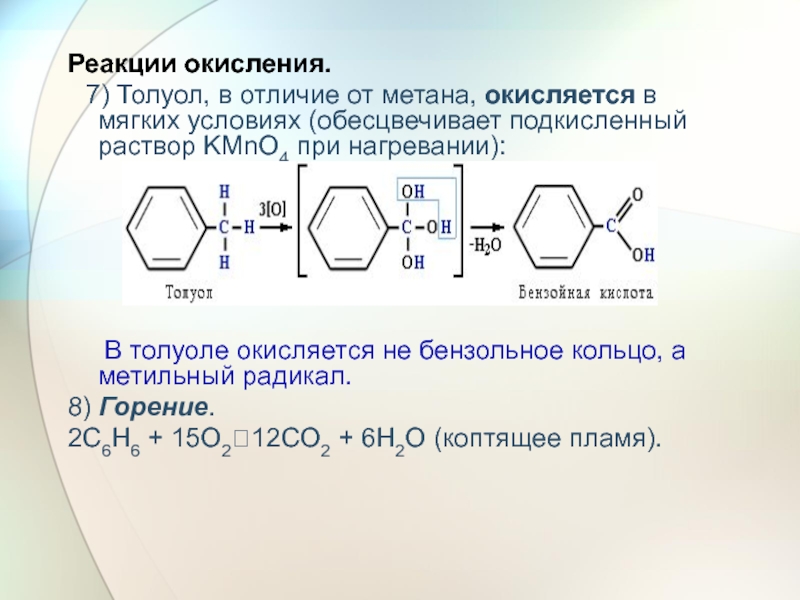
Слайд 31Реакции окисления.
7) Толуол, в отличие от метана, окисляется
В толуоле окисляется не бензольное кольцо, а метильный радикал.
8) Горение.
2C6H6 + 15O2?12CO2 + 6H2O (коптящее пламя).
Слайд 32 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ
C7H16 ––500°C→ C6H5 – CH3 + 4H2
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
C6H12 ––300°C,Pd→ C6H6 + 3H2
Получение
Слайд 333) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C
3C2H2 ––600°C→ C6H6
4) Сплавление солей ароматических кислот со щелочью или натронной известью.
C6H5-COONa + NaOH ––t°→ C6H6 + Na2CO3
5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами.
C6H6 + CH3Cl ––AlCl3→ C6H5 – CH3 + HCl
C6H6 + CH2 = CH2 ––H3PO4→ C6H5–CH2–CH3
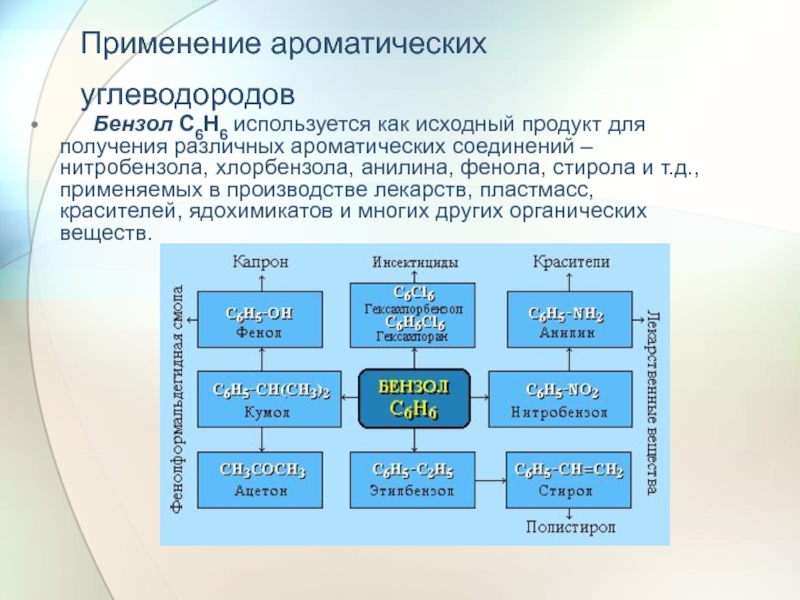
Слайд 34Применение ароматических углеводородов
Бензол С6Н6 используется как исходный
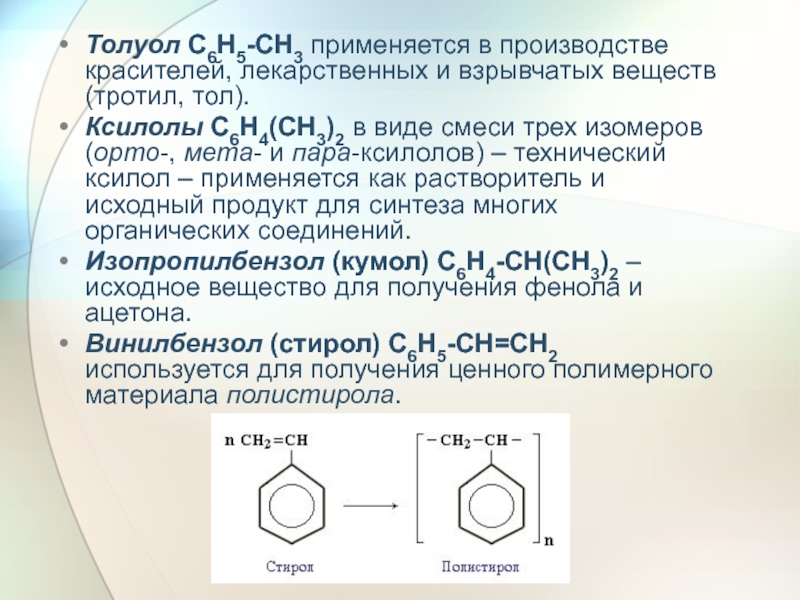
Слайд 35Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил,
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.