С.Н.Дильмагамбетов
________________________________________________________
Профессор кафедры химических дисциплин
ЗКГМУ им. Марата Оспанова
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) презентация
Содержание
- 1. Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
- 2. Растворы – гомогенные системы
- 3. Вещества, растворы и расплавы которых проводят электрический
- 4. Сильные и слабые электролиты Степень диссоциации
- 9. Слабые многоосновные кислоты и многокислотные основания диссоциируют
- 11. Закон действующих масс применительно к электролитам
- 12. Закон разбавления Оствальда Закон разбавления Оствальда выведен В.Оствальдом в 1888 году
- 13. Сильные электролиты Ионная атмосфера – каждый ион
- 14. Ионная сила раствора Силы межионного взаимодействия зависят
- 15. Ионное произведение воды Вода –
- 16. Постоянство ионного произведения воды дает возможность вычислить
- 17. Водородный показатель Среду водного раствора удобно характеризовать
Слайд 1Лекция №3
Основные положения теории растворов электролитов, используемых в аналитической химии
Для студентов
2 курса фармацевтического факультета
Слайд 2
Растворы – гомогенные системы переменного состава, образованные по крайней мере двумя
компонентами, один из которых обычно принимают за растворитель.
Раствор – однофазная система переменного состава, состоящая из двух или более компонентов.
Растворитель – компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
В растворе устанавливается равновесие между
всеми формами существования вещества.
Н2С2О4 ⇄ Н+ + НС2О4‾
НС2О4‾ ⇄ Н+ + С2О42-
Уравнение материального баланса имеет вид:
с°(Н2С2О4) = [Н2С2О4] + [НС2О4‾] + [С2О42-].
Раствор – однофазная система переменного состава, состоящая из двух или более компонентов.
Растворитель – компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
В растворе устанавливается равновесие между
всеми формами существования вещества.
Н2С2О4 ⇄ Н+ + НС2О4‾
НС2О4‾ ⇄ Н+ + С2О42-
Уравнение материального баланса имеет вид:
с°(Н2С2О4) = [Н2С2О4] + [НС2О4‾] + [С2О42-].
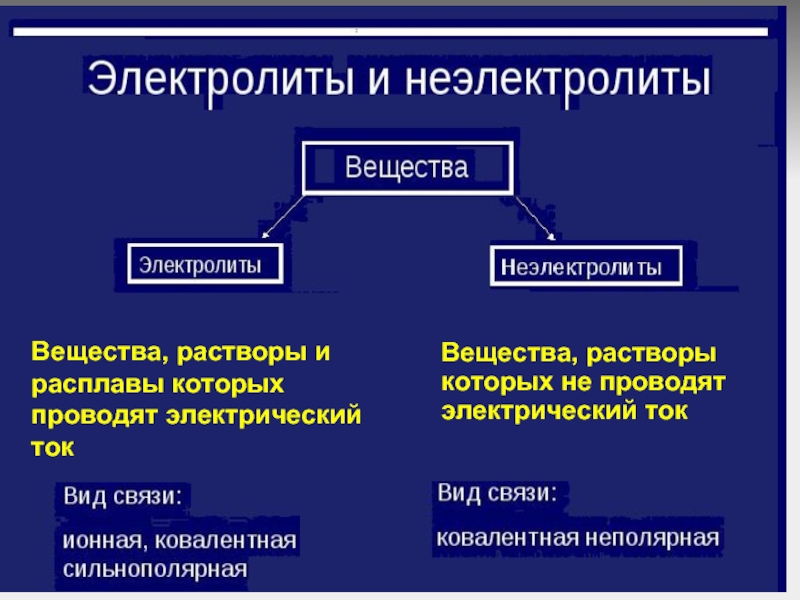
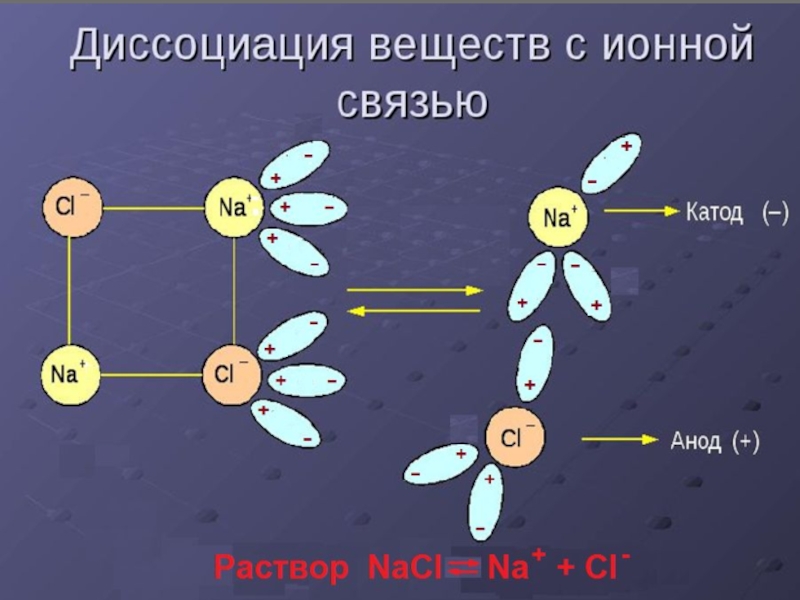
Слайд 3Вещества, растворы и расплавы которых проводят электрический
ток
Вещества, растворы которых не
проводят электрический ток
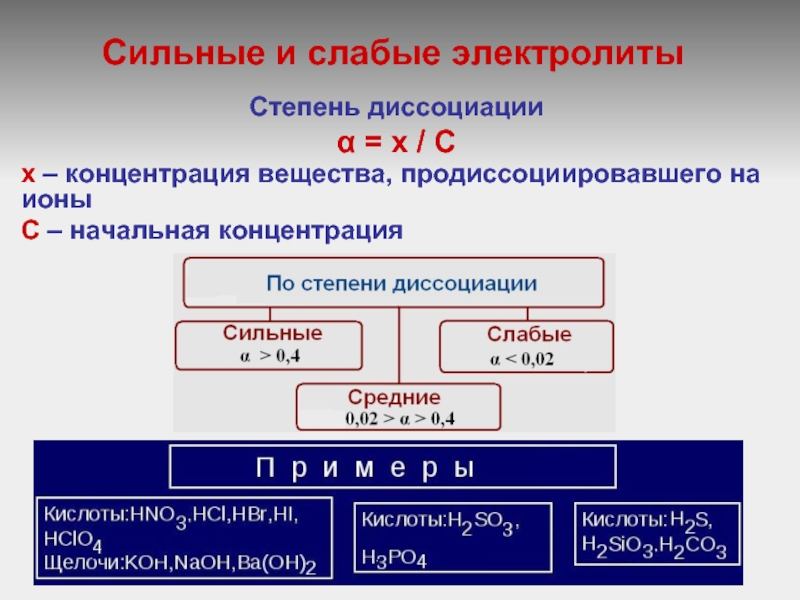
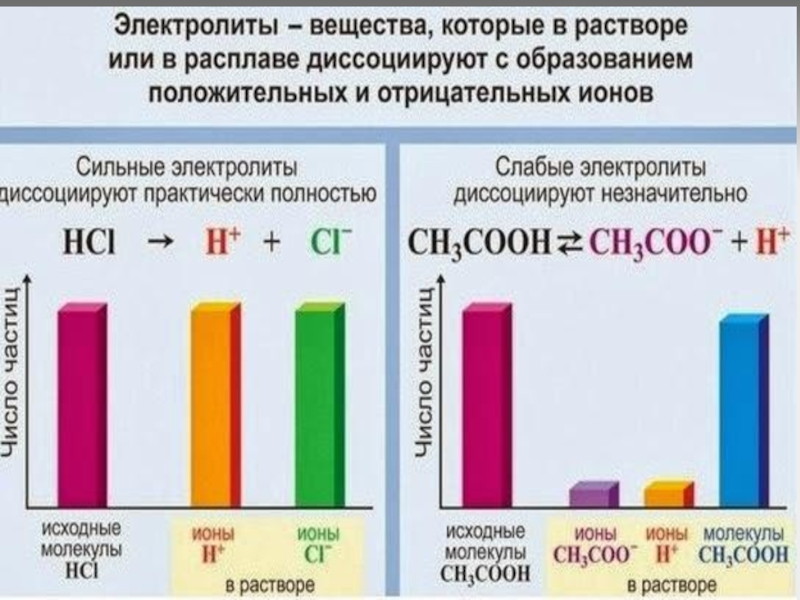
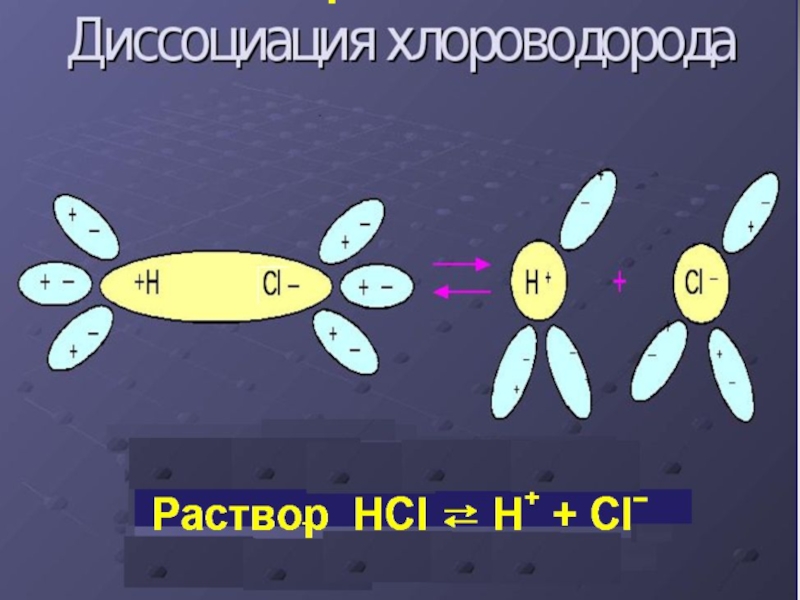
Слайд 4Сильные и слабые электролиты
Степень диссоциации
α = х / С
х – концентрация вещества, продиссоциировавшего на ионы
C – начальная концентрация
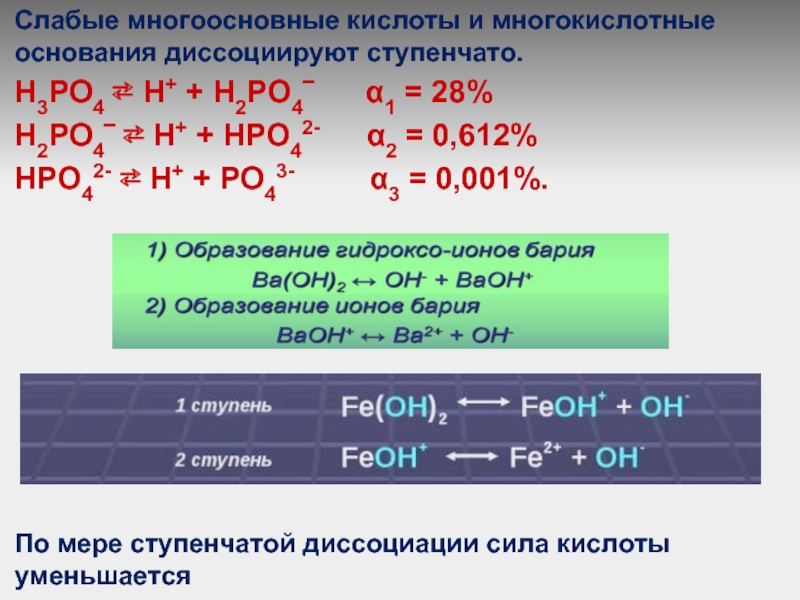
Слайд 9Слабые многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Н3РO4 ⇄ Н+
+ Н2РO4‾ α1 = 28%
Н2РO4‾ ⇄ Н+ + НРO42- α2 = 0,612%
НРO42- ⇄ Н+ + РO43- α3 = 0,001%.
По мере ступенчатой диссоциации сила кислоты уменьшается
Н2РO4‾ ⇄ Н+ + НРO42- α2 = 0,612%
НРO42- ⇄ Н+ + РO43- α3 = 0,001%.
По мере ступенчатой диссоциации сила кислоты уменьшается
Слайд 11
Закон действующих масс
применительно к электролитам
aА + bВ ⇄ cС + dD
Для
водных растворов слабых кислот и оснований
НА ⇄ Н+ + А‾
ВОН ⇄ В+ + ОН‾
Равновесные состояния в растворах слабых кислот и оснований характеризуются соответствующими константами равновесия, которые называются константами ионизации (диссоциации).
НА ⇄ Н+ + А‾
ВОН ⇄ В+ + ОН‾
Равновесные состояния в растворах слабых кислот и оснований характеризуются соответствующими константами равновесия, которые называются константами ионизации (диссоциации).
Слайд 12Закон разбавления Оствальда
Закон разбавления Оствальда выведен В.Оствальдом в 1888 году
и им же подтвержден опытным
путём. Устанавливает зависимость между степенью диссоциации и константой диссоциации.
НА ⇄ Н+ + А‾
См – концентрация слабой кислоты(моль/дм3);
Α – степень диссоциации;
Смα – число ионизируемых молекул НА Вильгельм Фридрих Оствальд
См(1 – α) – концентрация неионизированных (1853 – 1935)
молекул НА Лауреат Нобелевской премии, 1909
Подставляя полученные значения в уравнение
константы ионизации, получим:
Математическое выражение закона разбавления Оствальда
НА ⇄ Н+ + А‾
См – концентрация слабой кислоты(моль/дм3);
Α – степень диссоциации;
Смα – число ионизируемых молекул НА Вильгельм Фридрих Оствальд
См(1 – α) – концентрация неионизированных (1853 – 1935)
молекул НА Лауреат Нобелевской премии, 1909
Подставляя полученные значения в уравнение
константы ионизации, получим:
Математическое выражение закона разбавления Оствальда
Слайд 13Сильные электролиты
Ионная атмосфера – каждый ион окружается
противоположными ионами, что приводит
к
замедлению движения заряженной частицы.
(теория Дебая-Гюккеля)
Активностью иона называется эффективная,
кажущаяся концентрация, согласно которой он участвует в химических реакциях.
а = С·f
F – коэффициент активности
Понятие f введено датским ученым Бьеррумом в 1918 г.
замедлению движения заряженной частицы.
(теория Дебая-Гюккеля)
Активностью иона называется эффективная,
кажущаяся концентрация, согласно которой он участвует в химических реакциях.
а = С·f
F – коэффициент активности
Понятие f введено датским ученым Бьеррумом в 1918 г.
Слайд 14Ионная сила раствора
Силы межионного взаимодействия зависят от концентрации не только данного
электролита, но и концентрации всех других электролитов, присутствующих в растворе.
Ионная сила раствора - мера интенсивности
электрического поля, создаваемого ионами в
растворе.
Поэтому величина f зависит от ионной силы раствора, обозначаемой I, которая учитывает влияние всех присутствующих в растворе электролитов.
Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом.
I = ½(с1z12 + с2z22 +......сnzn2)
с – концентрация данного иона; z – заряд иона.
Ионная сила раствора - мера интенсивности
электрического поля, создаваемого ионами в
растворе.
Поэтому величина f зависит от ионной силы раствора, обозначаемой I, которая учитывает влияние всех присутствующих в растворе электролитов.
Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом.
I = ½(с1z12 + с2z22 +......сnzn2)
с – концентрация данного иона; z – заряд иона.
Слайд 15
Ионное произведение воды
Вода – слабый электролит
Н2O ⇄ Н+ + OН‾
Константа ионизации
(диссоциации)
После преобразования
К∙[Н2O] = [Н+]·[OН‾] = Kв = 1,0·10-14
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды.
В воде и водных растворах произведение ионов водорода и гидроксид-ионов есть величина постоянная.
После преобразования
К∙[Н2O] = [Н+]·[OН‾] = Kв = 1,0·10-14
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды.
В воде и водных растворах произведение ионов водорода и гидроксид-ионов есть величина постоянная.
Слайд 16Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов Н+, если
известна концентрация ионов ОНˉ и наоборот.
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
Нейтральная среда
[Н+] = [ОН‾] = 10-7 моль/дм3
Кислая среда
[Н+] > [ОН‾] [Н+] > 10-7 моль/дм3
Щелочная среда
[Н+] < [ОН‾] [Н+] < 10-7 моль/дм3
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
Нейтральная среда
[Н+] = [ОН‾] = 10-7 моль/дм3
Кислая среда
[Н+] > [ОН‾] [Н+] > 10-7 моль/дм3
Щелочная среда
[Н+] < [ОН‾] [Н+] < 10-7 моль/дм3
Слайд 17Водородный показатель
Среду водного раствора удобно характеризовать не концентрацией ионов водорода, а
водородным показателем.
рН = -lg[Н+]
нейтральная среда рН = 7
кислая среда pH < 7
щелочная среда pH > 7
рН = -lg[Н+]
нейтральная среда рН = 7
кислая среда pH < 7
щелочная среда pH > 7








![Ионное произведение воды Вода – слабый электролитН2O ⇄ Н+ + OН‾Константа ионизации (диссоциации)После преобразованияК∙[Н2O]](/img/tmb/2/142174/264e046449032b0d20e724a27e3a6e9d-800x.jpg)