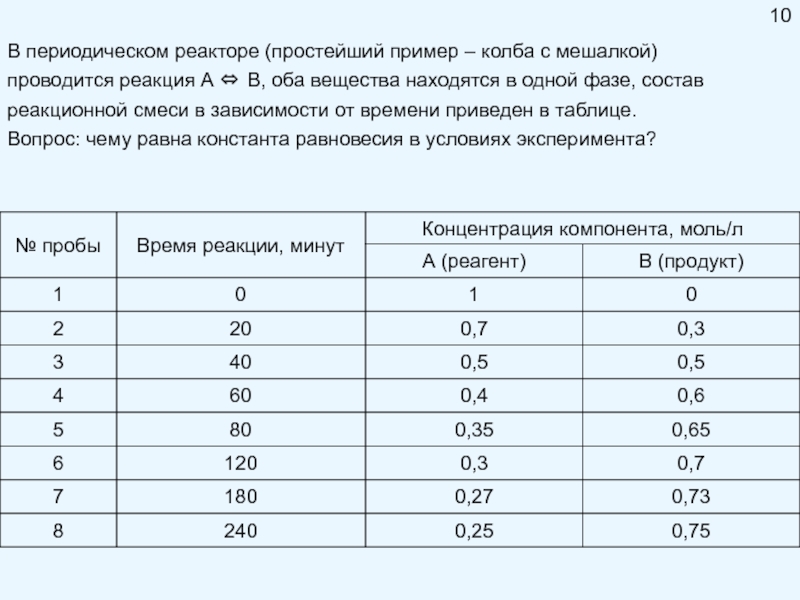
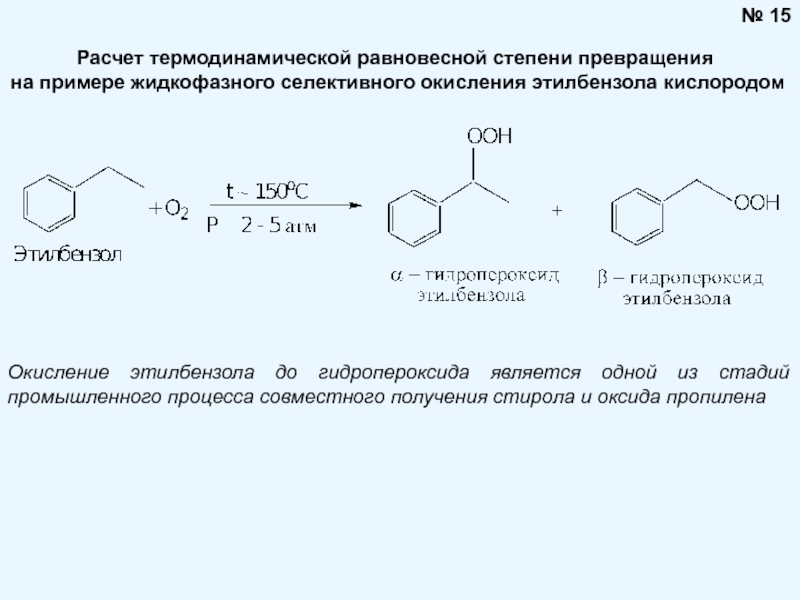
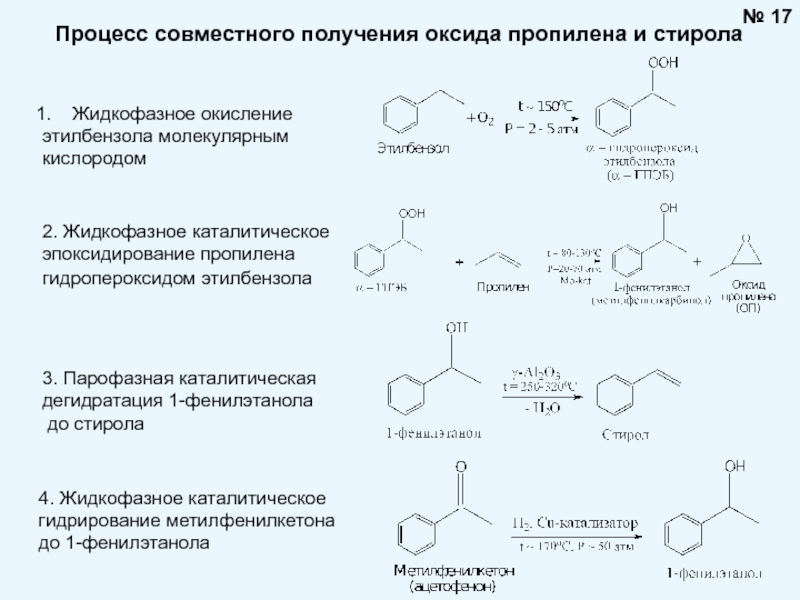
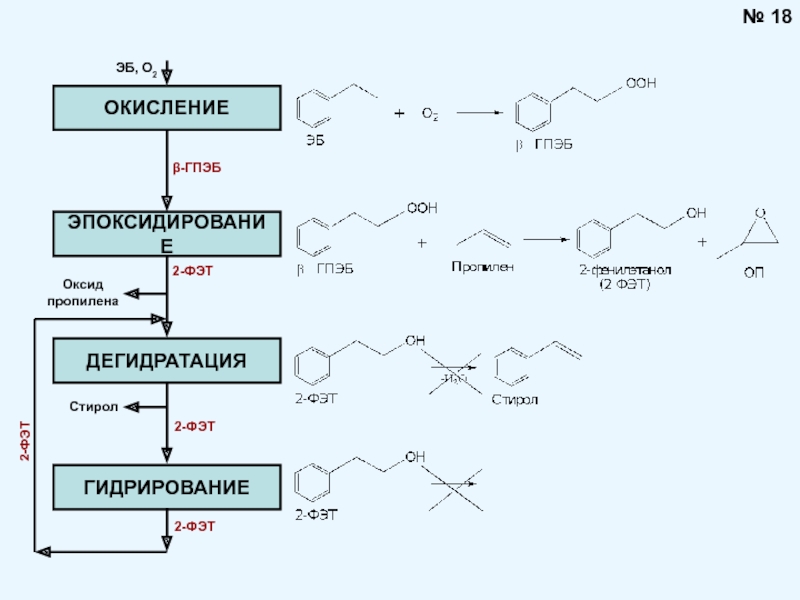
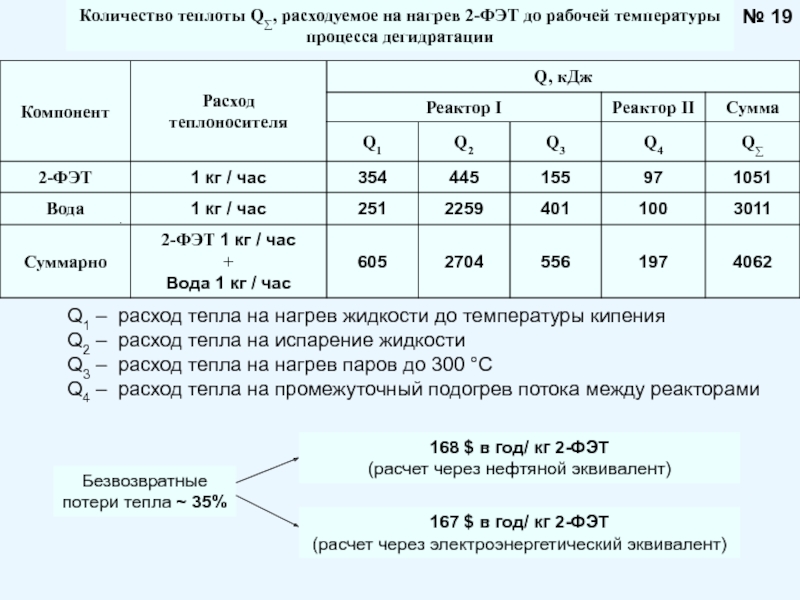
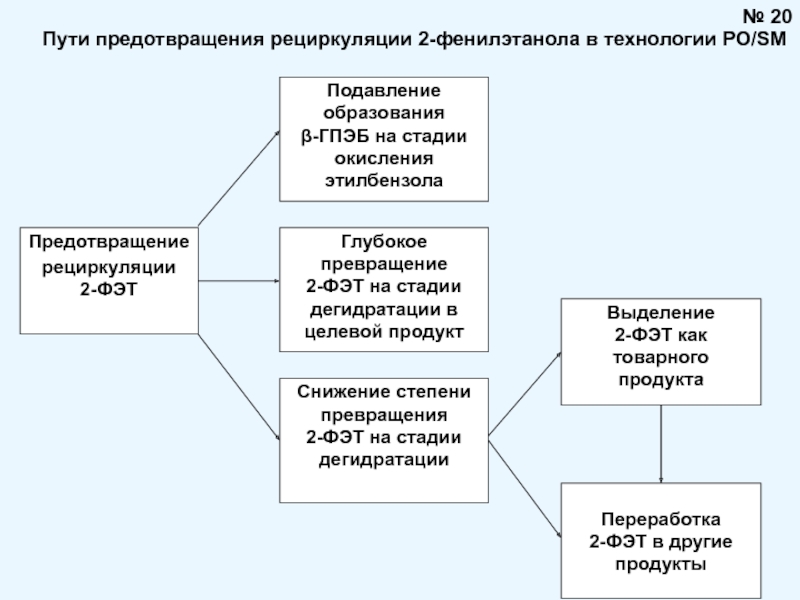
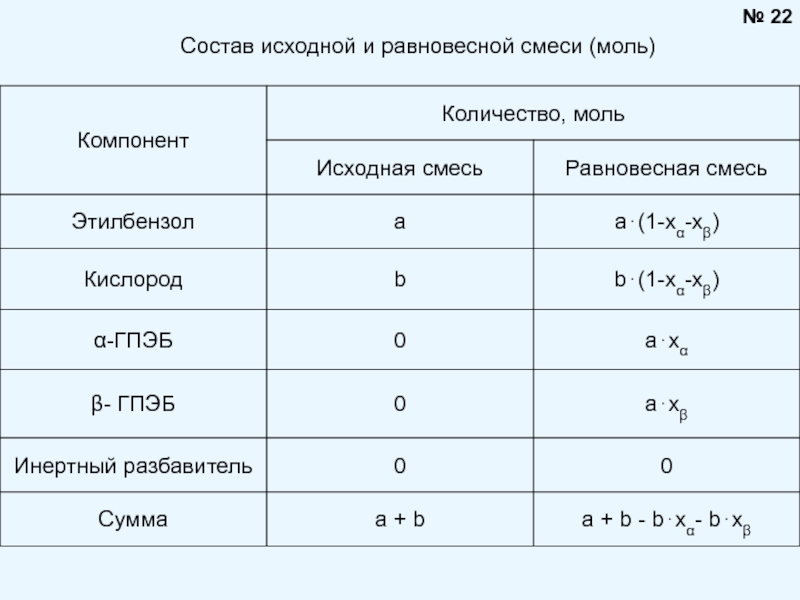
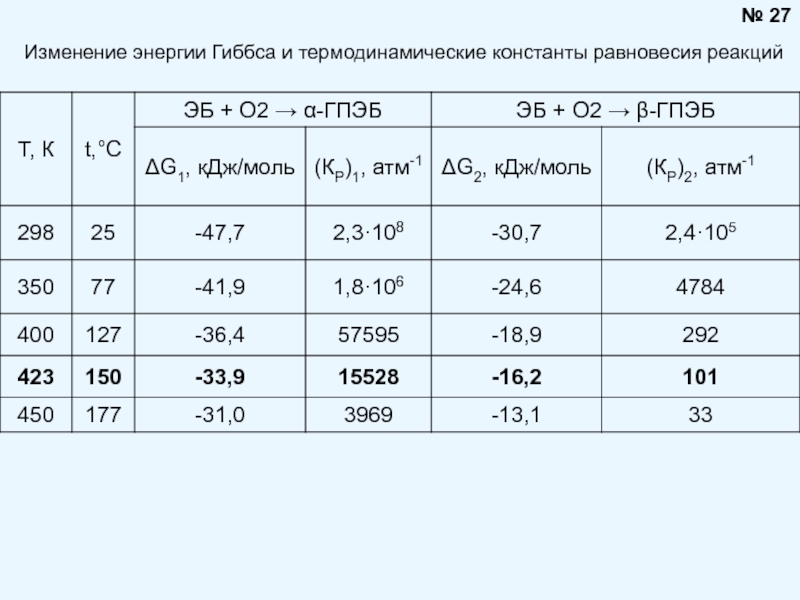
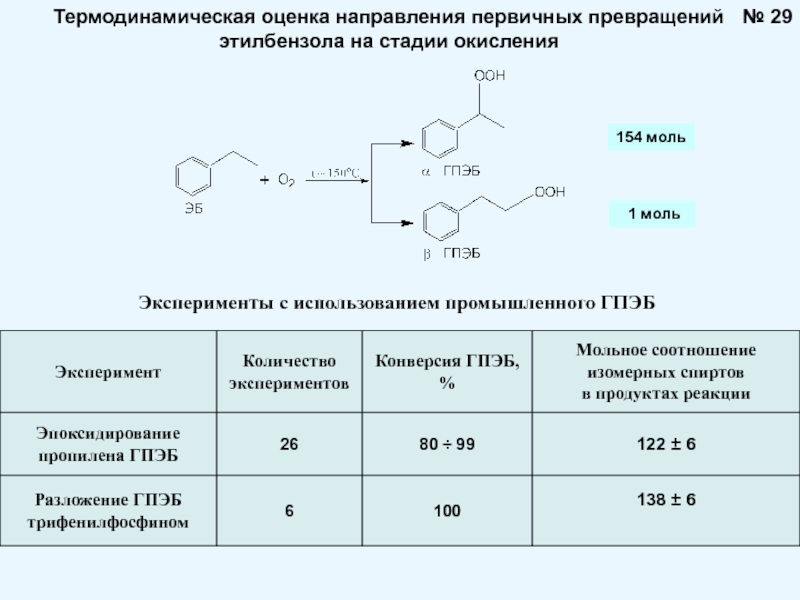
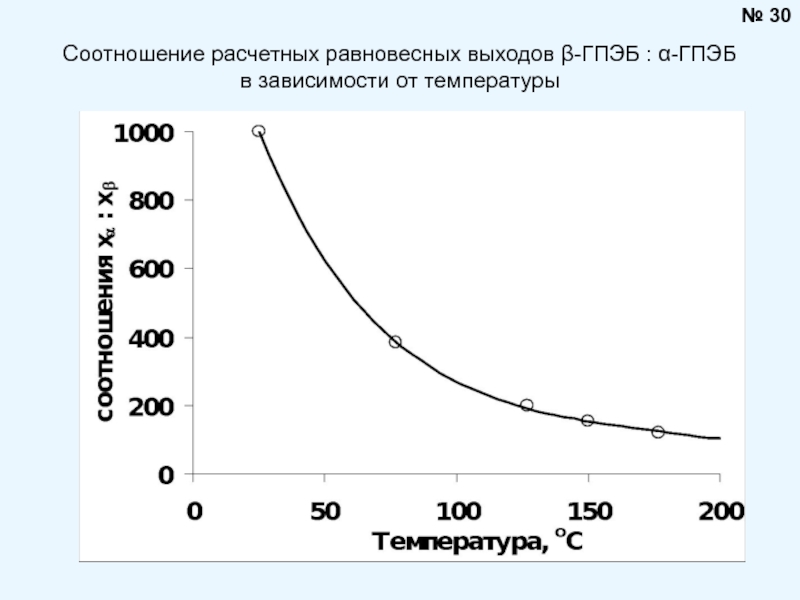
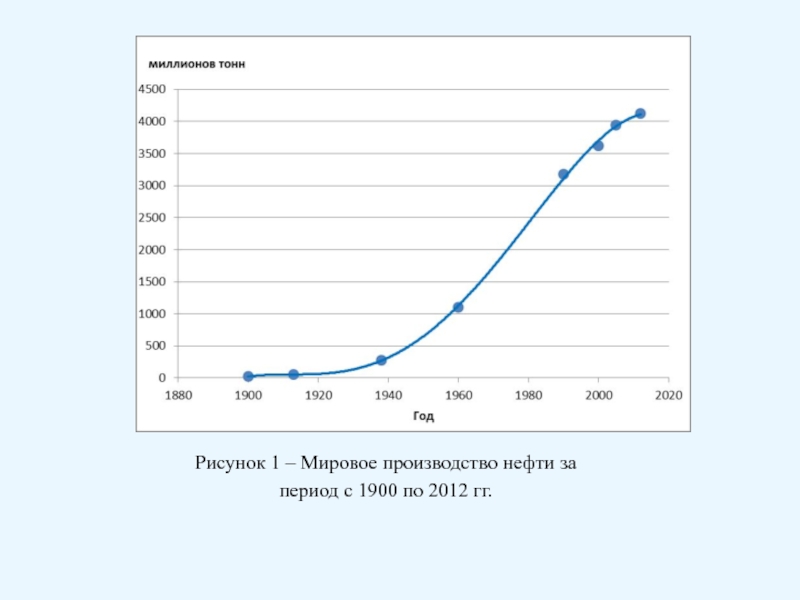
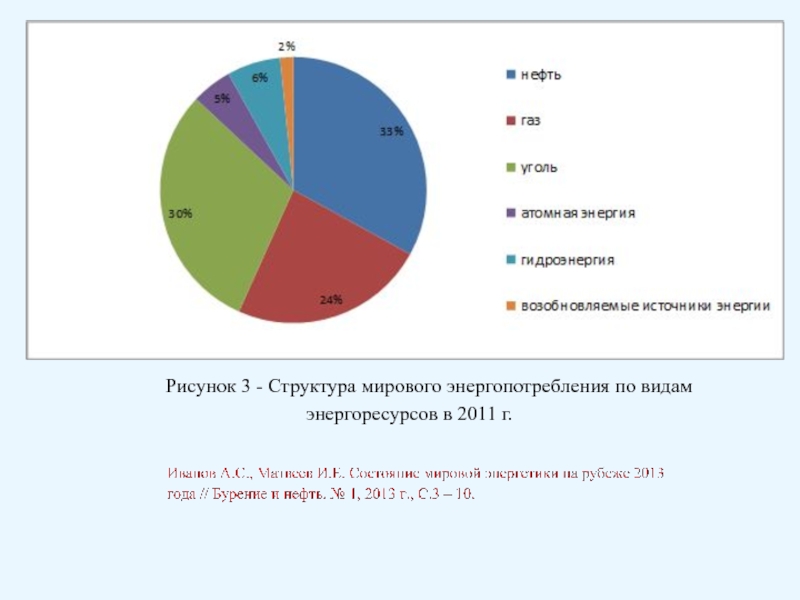
Брауна (предложенного в 1884 году французским химиком Анри Луи Ле-Шателье ) формулируется следующим образом:
Если на систему, находящуюся в состоянии равновесия воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия (температура, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение.
Фактически, воздействие на равновесную систему в большей степени изменяет скорость одного из направлений – прямого или обратного, в результате чего система переходит в новое состояние равновесия, при котором скорости прямой и обратной реакции вновь станут равными, но будут отличаться от первоначального значения.
Принцип Ле-Шателье мы используем для качественной оценки изменения внешних условий на положение равновесия.
2