- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основания, кислоты, соли в свете ТЭД презентация
Содержание
- 1. Основания, кислоты, соли в свете ТЭД
- 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ процесс распада электролита на ионы
- 3. Теория электролитической диссоциации ( С. Аррениус,
- 4. ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ Сильные электролиты – при
- 5. СТЕПЕНЬ ДИССОЦИАЦИИ В растворах слабых электролитов устанавливается
- 6. КОНСТАНТА ДИССОЦИАЦИИ Константа диссоциации – показывает отношение
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Электролиты при растворении гидратируются
- 8. ОСНОВАНИЯ В СВЕТЕ ТЭД Основаниями называются вещества,
- 9. ВИДЫ ОСНОВАНИЙ 1. Щелочи - растворимые в
- 10. КИСЛОТНОСТЬ ОСНОВАНИЙ Кислотность основания определяется числом гидроксильных групп
- 11. СИЛЬНЫЕ И СЛАБЫЕ ОСНОВАНИЯ
- 12. КИСЛОТЫ В СВЕТЕ ТЭД Кислота – это
- 13. ВИДЫ КИСЛОТ Безкислородные кислоты: HCl, HBr, HF,
- 14. ОСНОВНОСТЬ КИСЛОТ Основность кислот определяется количеством ионов
- 15. СИЛЬНЫЕ И СЛАБЫЕ КИСЛОТЫ
- 16. СОЛИ В СВЕТЕ ТЭД Соли – это сложные вещества, образованные
- 17. ВИДЫ СОЛЕЙ Средние соли – все атомы
- 18. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ Водородный показатель – характеризует концентрацию
- 19. ШКАЛА PH И ИНДИКАТОРЫ
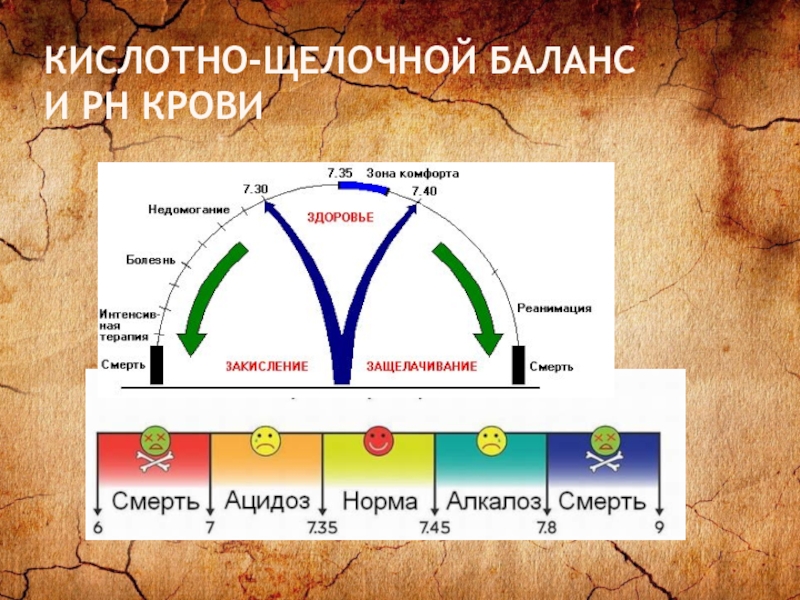
- 21. КИСЛОТНО-ЩЕЛОЧНОЙ БАЛАНС И РН КРОВИ
- 22. Проверьте свой кислотно-щелочной баланс с помощью pH
- 24. ЭЛЕКТРОЛИЗ Электролиз – окислительно-восстановительные реакции, которые протекают
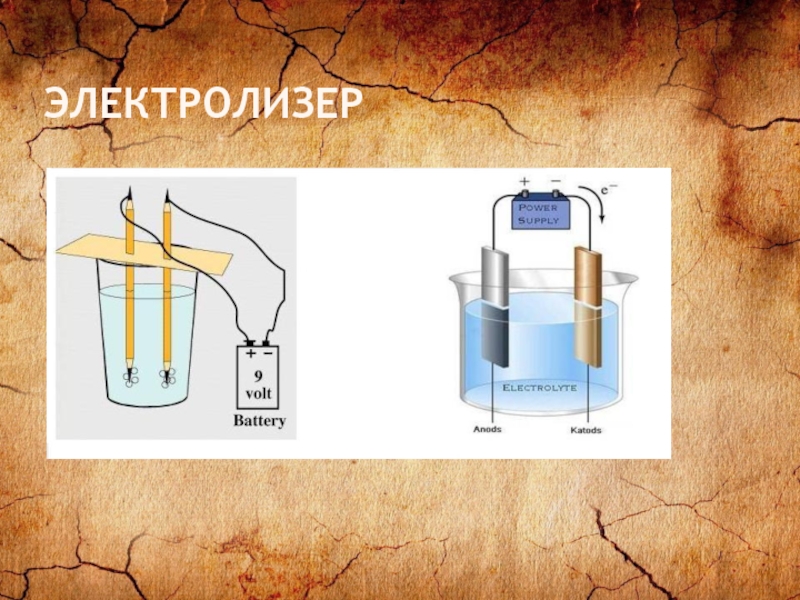
- 25. ЭЛЕКТРОЛИЗЕР
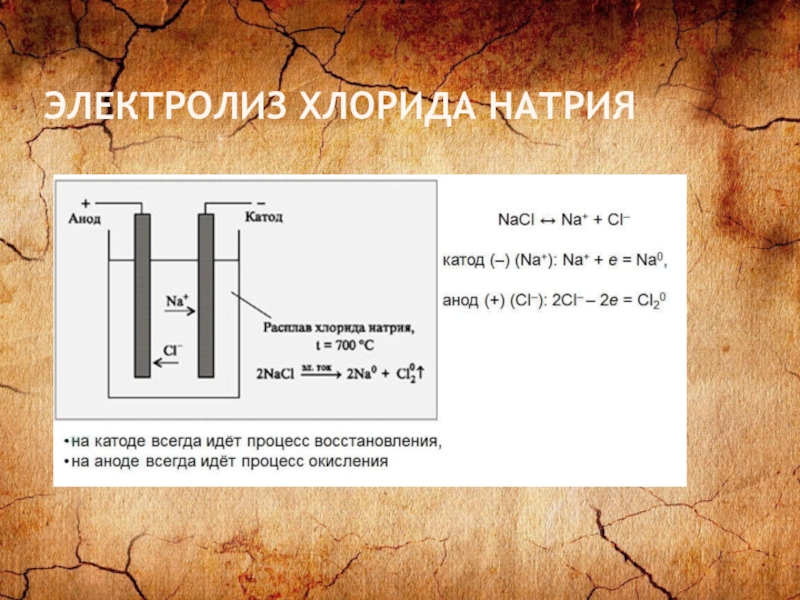
- 26. ЭЛЕКТРОЛИЗ ХЛОРИДА НАТРИЯ
- 27. ЭЛЕКТРОЛИЗ ВОДЫ Видеотека: Электролиз воды
- 28. ЭЛЕКТРОЛИЗ РАСТВОРА СУЛЬФАТА МЕДИ Видеотека: Электролиз сульфата меди
- 29. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Получение щелочных и щелочно-земельных металлов
Слайд 3
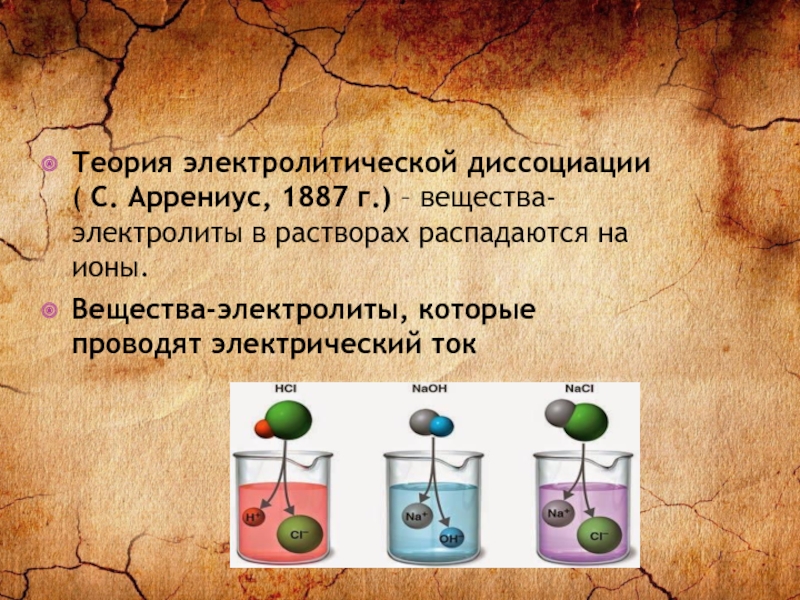
Теория электролитической диссоциации ( С. Аррениус, 1887 г.) – вещества-электролиты в
растворах распадаются на ионы.
Вещества-электролиты, которые проводят электрический ток
Вещества-электролиты, которые проводят электрический ток
Слайд 4ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ
Сильные электролиты – при растворении полностью распадаются на ионы
(растворимые соли, сильные кислоты, щелочи)
Слабые электролиты – незначительно диссоциируют на ионы (слабые кислоты, нерастворимые основания и гидроксид амония NH4OH, малорастворимые соли)
Неэлектролиты – не распадаются на ионы (простые вещества, нерастворимые оксиды, большинство органических веществ)
Слабые электролиты – незначительно диссоциируют на ионы (слабые кислоты, нерастворимые основания и гидроксид амония NH4OH, малорастворимые соли)
Неэлектролиты – не распадаются на ионы (простые вещества, нерастворимые оксиды, большинство органических веществ)
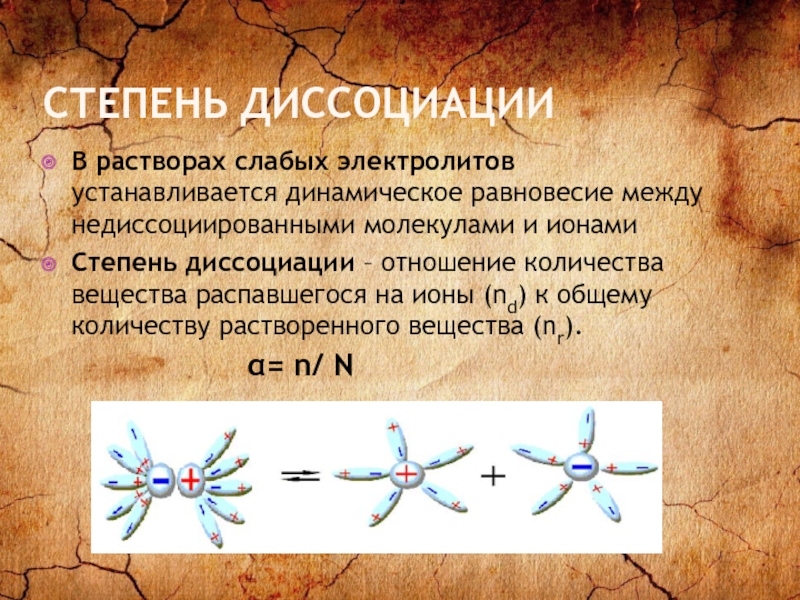
Слайд 5СТЕПЕНЬ ДИССОЦИАЦИИ
В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами
и ионами
Степень диссоциации – отношение количества вещества распавшегося на ионы (nd) к общему количеству растворенного вещества (nr).
α= n/ N
Степень диссоциации – отношение количества вещества распавшегося на ионы (nd) к общему количеству растворенного вещества (nr).
α= n/ N
Слайд 6КОНСТАНТА ДИССОЦИАЦИИ
Константа диссоциации – показывает отношение концентрации ионов к концентрации недиссоциированных
молекул
Константа диссоциации зависит от:
Природы (силы)электролита
Температуры
Концентрации
Видеотека:
Электролиты
Влияние температуры на диссоциацию
Влияние концентрации на диссоциацию
Константа диссоциации зависит от:
Природы (силы)электролита
Температуры
Концентрации
Видеотека:
Электролиты
Влияние температуры на диссоциацию
Влияние концентрации на диссоциацию
Слайд 7ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД
Электролиты при растворении гидратируются и распадаются на ионы (катионы+
и анионы-).
Под действием электрического тока катионы+ движутся к катоду(-), анионы- движутся к аноду(+).
Диссоциация это обратимый процесс: наряду с распадом вещества на ионы идет процесс обратной ассоциации в молекулы и кристаллы.
Под действием электрического тока катионы+ движутся к катоду(-), анионы- движутся к аноду(+).
Диссоциация это обратимый процесс: наряду с распадом вещества на ионы идет процесс обратной ассоциации в молекулы и кристаллы.
Слайд 8ОСНОВАНИЯ В СВЕТЕ ТЭД
Основаниями называются вещества, в которых атомы металла связаны
с гидроксильными группами Me(ОН)n
Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
KOH K+ + OH—
NH4OH NH+4 + OH—
Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
KOH K+ + OH—
NH4OH NH+4 + OH—
Слайд 9ВИДЫ ОСНОВАНИЙ
1. Щелочи - растворимые в воде основания (гидроксиды металлов I
и II групп). Кристаллические вещества, устойчивы к разложению.
2. Нерастворимые и малорастворимые основания (большинство оснований ,гидроксиды металлов побочных подгрупп: Cu(OH)2, Fe(OH) 3 и др. Твердые вещества, легко разлагаются на оксид и воду:
Cu(OH)2 CuO + H2 О
2. Нерастворимые и малорастворимые основания (большинство оснований ,гидроксиды металлов побочных подгрупп: Cu(OH)2, Fe(OH) 3 и др. Твердые вещества, легко разлагаются на оксид и воду:
Cu(OH)2 CuO + H2 О
Слайд 10КИСЛОТНОСТЬ ОСНОВАНИЙ
Кислотность основания определяется числом гидроксильных групп (равно количеству молекул кислоты, необходимой
для нейтрализации).
NН4ОН — однокислотное основание,
Са(ОН)2 — двухкислотное,
Fе(ОН)3 — трехкислотное (многокислотное)
Двух и многокислотные основания
диссоциируют ступенчато:
Ca(ОН)2 Са(ОН)+ + OH— (первая ступень)
Ca(OH)+ Ca2++OH— (вторая ступень)
Константа диссоциации второй и третьей ступени значительно ниже первой.
NН4ОН — однокислотное основание,
Са(ОН)2 — двухкислотное,
Fе(ОН)3 — трехкислотное (многокислотное)
Двух и многокислотные основания
диссоциируют ступенчато:
Ca(ОН)2 Са(ОН)+ + OH— (первая ступень)
Ca(OH)+ Ca2++OH— (вторая ступень)
Константа диссоциации второй и третьей ступени значительно ниже первой.
Слайд 12КИСЛОТЫ В СВЕТЕ ТЭД
Кислота – это сложное вещество, в молекуле которого
имеется один или несколько атомов водорода и кислотный остаток Hn(Ac).
Кислота - электролит, при диссоциации которого в качестве катионов образуются только катионы водорода (Н+).
HCl Н+ + Cl—
H2SO4 Н+ + НSО—4
Кислота - электролит, при диссоциации которого в качестве катионов образуются только катионы водорода (Н+).
HCl Н+ + Cl—
H2SO4 Н+ + НSО—4
Слайд 13ВИДЫ КИСЛОТ
Безкислородные кислоты: HCl, HBr, HF, H2S и др. (образуют сильные
неметаллы VI и VII гр.). Представляют растворы газов в воде.
Кислородсодержащие кислоты : H2SO4 ; H2СO3; H3PO4. – Как правило жидкости.
Кислородсодержащие кислоты : H2SO4 ; H2СO3; H3PO4. – Как правило жидкости.
Слайд 14ОСНОВНОСТЬ КИСЛОТ
Основность кислот определяется количеством ионов водорода Н+, равно количеству молекул
простого основания необходимого для нейтрализации.
Диссоциация многоосновной кислоты
протекает ступенчато.
Константа диссоциации второй и третьей ступени значительно ниже чем первой.
Н3РО4 Н+ + Н2РО—4 - первая ступень
Н2РО—4 Н+ + НРO2-4 - вторая ступень
НРО2-4 Н+ PОЗ—4 - третья ступень
Диссоциация многоосновной кислоты
протекает ступенчато.
Константа диссоциации второй и третьей ступени значительно ниже чем первой.
Н3РО4 Н+ + Н2РО—4 - первая ступень
Н2РО—4 Н+ + НРO2-4 - вторая ступень
НРО2-4 Н+ PОЗ—4 - третья ступень
Слайд 16СОЛИ В СВЕТЕ ТЭД
Соли – это сложные вещества, образованные атомами металлов и кислотных остатков
МеnАс.
Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков.
(NH4)2SO4 2NH+4 + SO2-4
Na3PO4 3Na+ + PO3-4
Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков.
(NH4)2SO4 2NH+4 + SO2-4
Na3PO4 3Na+ + PO3-4
Слайд 17ВИДЫ СОЛЕЙ
Средние соли – все атомы кислорода замещены металлом. KCl, FeSO4,
Na3PO4
Кислые соли – содержат Н+ диссоциируют ступенчато:
KHSO4 K+ + HSO—4
HSO—4 H++SO2-4
Основные соли – содержат гидроксильную группу ОН—, диссоциируют ступенчато:
Mg(OH)Cl Mg(OH)++Cl—
Mg(OH)+ Mg2++OH—
Кислые соли – содержат Н+ диссоциируют ступенчато:
KHSO4 K+ + HSO—4
HSO—4 H++SO2-4
Основные соли – содержат гидроксильную группу ОН—, диссоциируют ступенчато:
Mg(OH)Cl Mg(OH)++Cl—
Mg(OH)+ Mg2++OH—
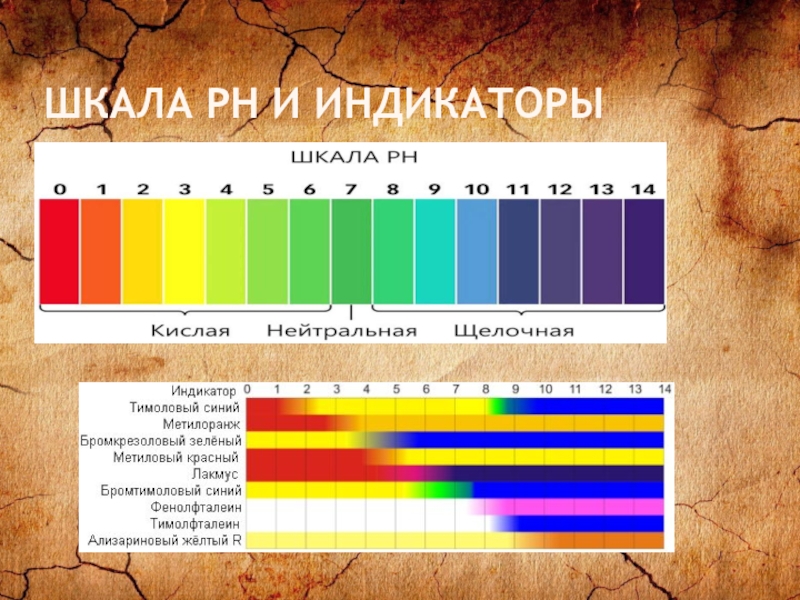
Слайд 18ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Водородный показатель – характеризует концентрацию свободных ионов водорода в воде
или водном растворе: pH = -log[H+].
Диссоциация воды (очень незначительно):
Н2O Н+ + ОН—
[H+] = [ОН—] = 10 —7 моль/л.
pH = - lg [H+] = 7 - нейтральная среда
При добавлении кислоты:
Н2O + HCl = Н2O + H+ + Cl—
0 ≤ рН <7 – кислая среда
При добавлении основания:
Н2O + КОН = Н2O + К+ + ОН—
7< рН ≤14 – щелочная среда
Диссоциация воды (очень незначительно):
Н2O Н+ + ОН—
[H+] = [ОН—] = 10 —7 моль/л.
pH = - lg [H+] = 7 - нейтральная среда
При добавлении кислоты:
Н2O + HCl = Н2O + H+ + Cl—
0 ≤ рН <7 – кислая среда
При добавлении основания:
Н2O + КОН = Н2O + К+ + ОН—
7< рН ≤14 – щелочная среда
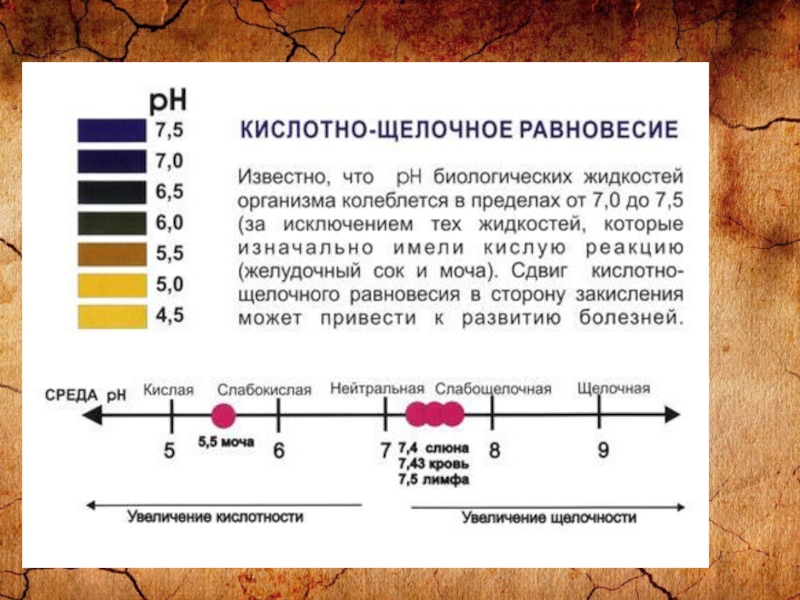
Слайд 22Проверьте свой кислотно-щелочной баланс с помощью pH тест-полосок С помощью pH тест-полосок
можно легко, быстро и точно определить уровень pH, не выходя из дома. Если уровень pH мочи колеблется в пределах 6,0-6,4 утром и 6,4-7,0 вечером, то ваш организм функционирует нормально. Если в слюне отметка уровня pH остается между 6,4-6,8 в течение всего дня – это также свидетельствует о здоровье ва-шего организма. Наиболее оптимальный уровень pH слюны и мочи слегка кислый, в пределах 6,4-6,5. Лучшее время для определения уровня pH – за 1 час до еды или спустя 2 часа после еды. Регулярно проверяйте уровень вашего pH.
Слайд 24ЭЛЕКТРОЛИЗ
Электролиз – окислительно-восстановительные реакции, которые протекают на электродах при прохождении электрического
тока через расплав или раствор электролита.
Электрический ток – самый сильный окислитель и восстановитель!
В процессе электролиза восстанавливаются даже ионы щелочных металлов и окисляются ионы галогенов и кислорода.
Электрический ток – самый сильный окислитель и восстановитель!
В процессе электролиза восстанавливаются даже ионы щелочных металлов и окисляются ионы галогенов и кислорода.
Слайд 29ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Получение щелочных и щелочно-земельных металлов и аллюминия
Получение галогенов, водорода и
кислорода
Нанесение металлических покрытий – никелирование, хромирование, золочение (гальваностегия)
Изготовление рельевных металлических копий (гальванопластика)
Очистка цветных металлов от примесей (рафинирование)
Нанесение металлических покрытий – никелирование, хромирование, золочение (гальваностегия)
Изготовление рельевных металлических копий (гальванопластика)
Очистка цветных металлов от примесей (рафинирование)